Содержание статьи:
- Что такое белок
- Виды белков
- Синтез белка
- Состав белков
- Свойства
- Функции белков
- Строение
- Переваривание белков
- Обмен белков в организме
- Продукты богатые белком
- Норма в день для организма
- Усваиваемость белка
- Вред белков
Белки – это важные компоненты, которые имеют большое значение для нормальной работы организма. Источниками этих веществ являются животные и растительные продукты. Чтобы белковые элементы полноценно усваивались организмом, необходимо правильно употреблять их.

Что такое белок
Белок — это органическое соединение, которое включает альфа-аминокислоты. Они соединяются в цепь пептидной связью. В живых организмах белковый состав определяется генетическим кодом. В процессе выработки этих веществ обычно принимает участие 20 аминокислот. Их сочетания создают белковые молекулы, которые отличатся своими свойствами.
Виды белков

Виды белков бывают следующие:
- Белки куриных яиц. Они усваиваются лучше всего и считаются эталонными. Всем известно, что яйца включают белок, который почти на 100 % состоит из альбумина, и желток.
- Казеин. При попадании в желудок вещество превращается в сгусток, который долгое время переваривается. Это обеспечивает невысокую скорость расщепления белка, что провоцирует стабильное снабжение организма аминокислотами.
- Белки молочной сыворотки. Такие компоненты расщепляются быстрее всего. Уровень аминокислот и пептидов в крови увеличивается уже в течение 1 часа после употребления таких продуктов. При этом кислотообразующая функция желудка остается неизменной.
- Соевые белки. Такие вещества имеют сбалансированный состав важных аминокислот. После употребления подобных продуктов снижается содержание холестерина. Потому такую пищу стоит есть людям с лишним весом. При этом главным минусом соевых белков считается наличие ингибитора пищеварительного фермента трипсина.
- Растительные белки. Такие вещества усваиваются человеческим организмом достаточно плохо. Их клетки обладают толстыми оболочками, которые не поддаются влиянию пищеварительного сока. Также проблемы с усвоением обусловлены наличием ингибиторов пищеварительных ферментов в отдельных растениях.
- Рыбный белок. Изолят рыбного белка достаточно медленно расщепляется до состояния аминокислот.
Синтез белка

Синтез белка осуществляется в особых частицах – рибосомах.
Этот процесс происходит в несколько стадий:
- активация аминокислот;
- инициация белковой цепи;
- элонгация;
- терминация;
- сворачивание и процессинг.
Состав белков

Состав белков представляет собой линейные полимеры, которые включают остатки α-L-аминокислот. Также в белковых молекулах могут присутствовать модифицированные аминокислотные остатки и составляющие неаминокислотной природы.
Аминокислоты обозначают сокращениями, включающими 1 или 3 буквы. Белки, которые имеют длину от 2 до нескольких десятков аминокислотных остатков, называют пептидами. Если наблюдается высокая степень полимеризации, их именуют белками. Однако такое деление считается достаточно условным.
Свойства белков

Для белков характерны следующие свойства:
- Различная растворимость в воде. Белковые элементы, которые растворяются, приводят к формированию коллоидных растворов.
- Гидролиз. Под влиянием ферментов или растворов минеральных кислот разрушается первичное строение белка и формируется смесь аминокислот.
- Денатурация. Под этим термином понимают частичное или полное разрушение структуры белковой молекулы. Этот процесс может происходить под воздействием разных факторов – повышенных температур, растворов солей тяжелых металлов, кислот или щелочей, радиоактивного излучения, отдельных органических веществ.
Функции белков
Рассмотрим детальнее ряд важных функций белков:
- Строительная. Такие вещества принимают участие в формировании клеток и внеклеточных элементов. Они присутствуют в составе мембранклеток, сухожилий, волос.
- Транспортная. Белковый компонент крови, который называется гемоглобином, присоединяет кислород и распространяет его в разные ткани и органы. После чего обратно переносит углекислый газ.
- Регуляторная. Гормоны белкового характера участвуют в обменных процессах. Инсулин отвечает за регуляцию содержания глюкозы в крови, обеспечивает выработку гликогена, повышает трансформацию углеводов в жиры.
- Защитная. При попадании в организм инородных объектов или микроорганизмов вырабатываются особенные белки – антитела. Они помогают связать и нейтрализовать антигены. Фибрин, который вырабатывается из фибриногена, останавливает кровотечения.
- Двигательная. Существуют особые сократительные белковые элементы. К ним относят актин и миозин. Эти веществаобеспечивают сокращение мышечных тканей.
- Сигнальная. В поверхностной клеточной мембране присутствуют белковые молекулы, которые могут менять третичную структуру под влиянием внешних факторов. Это помогает принимать сигналы извне и передавать в клетку команды.
- Запасающая. У животных белковые вещества обычно не запасаются. К исключениям относят яичный альбумин и казеин, который присутствует в молоке. При этом белки способствуют скоплению определенных веществ. Распад гемоглобина приводит к тому, что железо не выводится, а сохраняется. Благодаря этому формируется комплекс с ферритином.
- Энергетическая. Распад 1 г белка сопровождается синтезом 17,6 кДж энергии. Вначале белковые элементы распадаются до аминокислот, а затем – до конечных продуктов. В результате вырабатывается вода, аммиак и углекислый газ. При этом белки применяются в качестве источника энергии лишь в том случае, если остальные – израсходованы.
- Каталитическая. Это одна из наиболее важных функций белковых элементов. За нее отвечают ферменты, которые активизируют биохимические процессы в клеточных структурах.
Строение белков

Среди органических веществ белки, которые называются биополимерами, считаются самыми многочисленными. Они отличаются разнообразием. На долю этих веществ приходится 50-80 % сухой массы клетки.
Белковые молекулы отличаются большими размерами. Потому их нередко именуют макромолекулами. В строение белков входят углерод, водород, азот, кислород. Помимо этого, в них могут присутствовать сера, железо, фосфор.
Белки отличаются числом – от 100 до нескольких тысяч, составом, последовательностью мономеров. В качестве мономеров выступают аминокислоты.
Переваривание белков

Белки усваиваются в желудке и тонком кишечнике. Процесс переваривания представляет собой гидролитическое расщепление белков до аминокислот.
Он имеет определенные особенности:
- протеолитические ферменты продуцируются в неактивном состоянии;
- активирование наблюдается в просвете пищеварительного тракта за счет частичного протеолиза;
- протеазы пищеварительного тракта характеризуются субстратной специфичностью – они могут относиться к эндопептидам или экзопептидазам.
Основным ферментом желудка, который расщепляет белки, считается пепси. Он синтезируется в неактивном состоянии и представляет собой профермент пепсиноген. Под воздействием соляной кислоты наблюдается частичный протеолиз пепсиногена. В результате появляется активная форма – пепсин.
Обмен белков в организме

Обмен белков в организме значительно сложнее, чем метаболизм липидов или углеводов. Жирные кислоты попадают в клетки почти в исходном виде, а углеводы – служат источником энергии. При этом основной строитель мышц претерпевает немало изменений в организме. На отдельных этапах белок преобразуется в углеводы. Как следствие, вырабатывается энергия.
Существует несколько этапов белкового обмена, для каждого из которых характерны определенные особенности:
- Попадание белков в организм. Под действием слюны происходит расщепление связей гликогена. Как следствие, формируется глюкоза, доступная для усвоения. Оставшиеся ферменты запечатываются. На этой стадии белки, которые присутствуют в продуктах, распадаютсяна отдельные элементы.Впоследствии они будут перевариваться.
- Переваривание. Под действием панкреатина и остальных ферментов наблюдается последующая денатурация до белков первого порядка. Организм способен получать аминокислоты исключительно из простейших белковых цепей. Для этого он вырабатывает кислоту. Это облегчает расщепление веществ.
- Расщепление на аминокислоты. Под действием клеток слизистых оболочек кишечника денатурированные белки попадают в кровь. Простой белок преобразуется организмом в аминокислоты.
- Расщепление до энергии. Под действием большого количества заменителей инсулина и ферментов для усваивания углеводов белок трансформируется в глюкозу. При нехватке энергии организм не выполняет денатурацию белка, а сразуегорасщепляет. В результате вырабатывается чистая энергия.
- Перераспределение аминокислот. Белковые элементы циркулируют в системном кровотоке и под действием инсулина попадают во все клетки. Как следствие, образуются требуемые аминокислотные связи. По мере распространения белков по организму происходит восстановление фрагментов мышечных элементов и структур, которые связаны со стимуляцией выработки, работой мозга, дальнейшей ферментацией.
- Образование новых белковых структур. Аминокислоты связываются с микроразрывами в мышцах и приводят к созданию новых тканей. Как следствие, наблюдается гипертрофия мышц. Аминокислоты в требуемом составе трансформируются в мышечно-белковую ткань.
- Обмен белков. При избытке таких структур под влиянием инсулина они снова проникают в систему кровообращения. Это приводит к формированию новых структур. При существенном напряжении в мышцах, длительном голодании или в период заболевания организм использует белки для компенсации недостатка аминокислот в остальных тканях.
- Перемещение липидных структур. Белки, которые соединяются в фермент липазу, способствуют перемещению и перевариванию с желчью полинасыщенных жирных кислот. Эти элементы принимают участие в перемещении жиров и выработке холестерина. С учетом состава аминокислот белки могут синтезироваться в полезный или вредный холестерин.
- Выведение окисленных продуктов. Использованные аминокислоты покидают организм с продуктами обмена. Мышцы, которые повреждаются вследствие нагрузок, тоже выводятся из организма.
Продукты богатые белком

Существует довольно много источников таких элементов. Животные продукты богатые белком, бывают следующие:
- Куриное мясо. 100 г продукта включает около 20 г белков. При этом такое мясо почти не содержит жира. Это актуально для людей, которые контролируют свой вес или занимаются спортом.
- Рыба. Самыми ценными источниками белка считаются тунец и лосось. Помимо этого, в продуктах имеются ценные кислоты омега-3, которые обеспечивают стабилизацию функций сердца и улучшают настроение.
- Свинина. В зависимости от жирности мяса в 100 г продукта может присутствовать 11-16 г белков. Также свинина включает витамины группы В.
- Яйца. В 1 яйце присутствует 6 г белка. Также продукт включает витамин В12 и холин.
- Говядина. На 100 г продукта приходится 19 г белков. Также говядина включает железо, карнитин и креатин
К растительным источникам белков стоит отнести следующее:
- Бобовые. Эти продукты включают большое количество белков. 100 г гороха содержит 23 г этих компонентов, а в сое присутствует 34 г белков.
- Орехи. Они представляют собой ценные источники белков и включают ненасыщенные жирные кислоты.
- Грибы. Эти продукты включают 2-5 % белков от общего количества. При этом есть сведения, что пищевые компоненты из грибов усваиваются с большим трудом.
- Гречка. В 100 г продукта присутствует 13 г белков. В гречке нет глютена, потому она вызывает аллергических реакций. При этом крупа включает фитонутриенты, которые сказываются на выработке инсулина и восстанавливают метаболизм.
Норма белка в день для организма

Норма белка в день для организма взрослого человека составляет минимум 50 г в чистом виде, что соответствует 150 г белого мяса или рыбы. Люди, которые активно занимаются спортом и нацелены на развитие мышечных тканей, должны употреблять большее количество белков.
Для профилактики распада мышечной ткани женщины должны употреблять минимум 1 г белка на 1 кг веса. Однако оптимальным количеством считается 2 г. Для мужчин этот параметр увеличивается до 3 г. Это означает, что представитель сильного пола весом 90 кг должен съедать в день 270 г чистого белка.
Усваиваемость белка

При употреблении таких веществ, стоит помнить о чувстве меры. Избыточное количество белков представляет определенную опасность. Они с трудом перевариваются и могут вызвать нарушения пищеварительных функций.
Проблемы с усвоением белков могут возникать в следующих ситуациях:
- Избыточное количество белка за 1 прием пищи. За 1 прием организм не может усвоить больше 35 г белков. Помимо этого, избыток таких веществ отрицательно влияет на пищеварительные функции. Организм не способен переварить большое количество протеинов. Как следствие, неусвоенная часть начинает гнить в пищеварительных органах. Это провоцирует запоры, увеличение ацетона и нарушения в работе поджелудочной железы.
- Систематическое переедание. Диетологи советуют придерживаться принципов дробного питания – 4-5 раз в день. Это помогает лучше переваривать пищу, в том числе и белки.
- Употребление большого количества трудноперевариваемых белков. Протеины могут усваиваться в разном объеме. Есть белки, которые легко перевариваются. Однако существуют и трудноперевариваемые продукты. Эталоном белковой пищи считаются куриные яйца. Также к легким белкам относят нежирные кисломолочные продукты, куриное филе, кролика.
- Исключение жиров. Безусловно, жирные продукты содержат большое количество калорий и с трудом усваиваются. Однако полностью отказываться от них не следует. Это чревато гормональными нарушениями, ухудшением состояния волос и кожи. Также исключение жиров провоцирует нарушение процесса переваривания белков. Чтобы обеспечить эффективную работу печени и выведение продуктов синтеза белка, стоит включать в рацион желчегонные жиры. Они присутствуют в оливковом и кунжутном маслах.
- Дефицит жидкости. Нарушение питьевого режима провоцирует разные проблемы, включая ухудшение усвоения белка. В сутки человек должен пить 30-40 мл воды на 1 кг массы тела. В жаркую погоду или при серьезных физических нагрузках норма дополнительно повышается на 500-800 мл.
- Неправильные дополнения к белкам. Чтобы протеины усваивались максимально хорошо, их рекомендуется сочетать с овощами. В такой пище присутствуют ферменты и клетчатка. Это облегчает переваривание белков.
Вред белков

Нарушения белкового обмена представляют большой вред для организма. Эти вещества принимают участие почти во всех физиологических процессах. При нарушении обмена белков есть риск развития опасных нарушений.
При этом для здоровых людей белки представляют опасность лишь при избыточном потреблении в течение долгого периода времени. При соблюдении белковых диет, которые базируются на употреблении большого количества протеинов, нужно помнить о чувстве меры. Такие системы питания должны быть кратковременными и плавными.
Избыточное количество белков в рационе провоцирует поражение почек и печени. Это связано со сложным процессом выведения веществ. В этом случае вырабатываются кетоновые тела, которые провоцируют отравление организма.
При некоторых патологиях есть противопоказания к употреблению белков. К ним относят подагру, недостаточность почек и печени, хроническую форму панкреатита.
Белки представляют собой ценные вещества, которые принимают участие во всех физиологических процессах. Потому каждый человек должен употреблять достаточное количество протеинов. При этом необходимо помнить о чувстве меры и соблюдать рекомендации врачей.
Белки выполняют ведущую роль в жизни организмов, преобладая в них и количественно. В теле животных они составляют 40-50% сухой массы, в растениях – 20-35%. Это самая разнообразная группа молекул – как химически, так и функционально. Состав и структура белков определяет огромное разнообразие их функций в клетке: их так много, что невозможно перечислить и описать их все. Однако можно сгруппировать эти функции в следующие восемь категорий. Но этот список также будет неполным.

- Ферментативная (каталитическая). Ферменты имеют белковое происхождение. Это трёхмерные глобулярные (свёрнутые) белки, плотно прилегающие к молекуле для её расщепления или сборки. Такая подгонка ускоряет специфические химические реакции в клетке.
- Защитная. Другие глобулярные белки используют свою форму для распознавания чужеродных микроорганизмов и раковых клеток. Эти приёмные устройства формируются эндокринной и иммунной системами. Многие живые организмы выделяют белки, ядовитые для других. Токсины синтезируют ряд животных, грибов, растений, микроорганизмов. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
- Транспортная. Глобулярные белки присоединяют и транспортируют мелкие молекулы и ионы. Например, транспортный белок гемоглобин переносит кислород и углекислоту с потоком крови. Мембранные транспортные белки помогают молекулам и ионам двигаться через плазмалемму. Альбумины крови транспортируют жирные кислоты, глобулины – ионы металлов и гормоны.
- Структурная. Белковые молекулы входят в состав всех клеточных мембран и органоидов. Из белков построены элементы цитоскелета, сократительные структуры мышечных волокон. Структурными являются кератин в волосах, фибрин в сгустках крови, коллаген в коже, связках, сухожилиях и костях. В состав связок, стенок артерий и лёгких входит также структурный белок эластин.
- Двигательная. Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Мышцы сокращаются за счёт движения двух видов белковых нитей: актина и миозина. Контрактильные (лат. contraho, contractum – стягивать, сокращать) протеины играют ключевую роль в цитоскелете и передвижении веществ внутри клетки. Белок тубулин также входит в состав микротрубочек веретена деления, ресничек и жгутиков эукариотических клеток.
- Регуляторная. Крошечные белки, называемые гормонами, служат межклеточными посланниками в теле животных. Другие белки регулируют синтез РНК на ДНК, включая и выключая гены. Кроме того белки получают информацию, действуя в качестве рецепторов клеточной поверхности (эту функцию иногда считают отдельной, называя рецепторной).
- Запасающая. Кальций и железо хранятся в организме в виде ионов, связанных с белками хранения. В семенах растений запасаются резервные белки, которые используются зародышем при прорастании, а затем и проростком как источник азота.
- Энергетическая. После расщепления до аминокислот белки могут служить источником энергии в клетке. При полном окислении 1 г белка выделяется 17,6 кДж энергии. Однако белки расходуются на энергетические нужды лишь в крайних случаях, когда исчерпаны запасы углеводов и липидов.
 Сравнительный размер молекул белков. Слева направо: антитело (IgG) (150 кДа), гемоглобин (66,8 кДа), гормон инсулин, фермент аденилаткиназа и фермент глютаминсинтетаза.
Сравнительный размер молекул белков. Слева направо: антитело (IgG) (150 кДа), гемоглобин (66,8 кДа), гормон инсулин, фермент аденилаткиназа и фермент глютаминсинтетаза.Автор: en:User:Gareth White, CC BY-SA 2.0
Функции белков
| |||
| Функция | Класс белка | Образцы | Примеры использования |
| Каталитическая | Ферменты | Карбогидразы | Расщепляют полисахариды |
| Протеазы | Разрушают белки | ||
| Полимеразы | Синтезируют нуклеиновые кислоты | ||
| Киназы | Фосфорилируют сахара и белки | ||
| Защитная | Иммуноглобулины | Антитела | Маркируют чужеродные белки для элиминации (удаления) |
| Токсины | Змеиный яд | Блокирует нервные импульсы | |
| Клеточные белки-антигены | МНС-белки (главный комплекс гистосовместимости) | Опознание чужеродных белков | |
| Транспортная | Циркуляционные транспортёры | Гемоглобин | Переносит кислород и углекислый газ крови |
| Миоглобин | Переносит кислород и углекислый газ в скелетных мышцах и мышце сердца | ||
| Цитохромы | Транспортируют электроны | ||
| Мембранные транспортные белки | Натриево-калиевый насос | Возбуждение мембраны | |
| Протонный насос | Хемиосмос | ||
| Транспортёр глюкозы | Транспортирует глюкозу в клетки | ||
| Структурная | Волокна | Коллаген | Образует хрящ |
| Кератин | Формирует волосы, ногти, перья и др. | ||
| Фибрин | Образует сгустки крови | ||
| Двигательная | Мускулы | Актин | Сокращение мышечных волокон |
| Миозин | Сокращение мышечных волокон | ||
| Регуляционная | Осмотические белки | Сывороточный альбумин | Поддерживает осмотическую концентрацию крови |
| Регуляторы генов | Репрессор | Регулирует транскрипцию | |
| Гормоны | Инсулин | Контролирует уровень глюкозы в крови | |
| Вазопрессин | Увеличивает задержку воды почками | ||
| Окситоцин | Регулирует сокращение матки и выделение молока | ||
| Запасающая | Ион-связывание | Ферритин | Хранит железо, особенно в селезёнке |
| Казеин | Хранит ионы в молоке | ||
| Кальмодулин | Связывает ионы кальция | ||
Белки – это полимеры
Белки, или протеины – это нерегулярные (не имеющие определённой закономерности в последовательности мономеров) полимеры, состоящие из мономеров, называемые аминокислотами. Протеины, в состав молекул которых входит от пятидесяти до нескольких тысяч остатков аминокислот, называются белками. Молекулы с меньшим количеством мономеров именуются пептидами.
 Общие сведения о пептидах и белках
Общие сведения о пептидах и белкахБелок состоит из одной или нескольких длинных неразветвлённых цепей. Каждая цепь называется полипептидом и состоит из аминокислот, скреплённых пептидными связями. Термины «белок» и «полипептид» часто используются свободно, что может вызывать путаницу. Для белка, который включает только одну полипептидную цепь, оба термина являются синонимами.
В природе существуют около 500 аминокислот. В образовании белков обычно (но не всегда) участвуют только 20 из них – их называют белокобразующими. Порядок соединения мономеров в белке определяет его структуру и функции. Многие учёные считают, что аминокислоты были первыми органическими молекулами, появившимися на Земле. Возможно, океаны, которые существовали в начале истории нашей планеты, содержали большое их разнообразие.
 Белокобразующие аминокислоты
Белокобразующие аминокислотыАвтотрофные организмы синтезируют все необходимые им аминокислоты из продуктов фотосинтеза и азотсодержащих неорганических соединений. Для гетеротрофов источником аминокислот являются продукты питания. В организме человека и животных некоторые аминокислоты могут синтезироваться из продуктов обмена веществ (в первую очередь — из других аминокислот). Такие аминокислоты называются заменимыми.
Другие же, так называемые незаменимые аминокислоты, не могут быть собраны в организме и поэтому должны постоянно поступать в него в составе белков пищи. Протеины, содержащие остатки всех незаменимых аминокислот, называются полноценными. Неполноценные белки – это те, в составе которых отсутствуют остатки тех или иных незаменимых аминокислот.
Незаменимыми аминокислотами для человека являются: триптофан, лизин, валин, изолейцин, треонин, фенилаланин, метионин и лейцин. Для детей незаменимыми являются также аргинин и гистидин.
Полипептидные цепи могут быть очень длинными и включать самые разные комбинации аминокислотных остатков. Каждый конкретный белок характеризуется строго постоянным составом и последовательностью аминокислот.
 Димер мембранного белка кальсеквестрина.
Димер мембранного белка кальсеквестрина.Deposition authors: Wang, S., Trumble, W.R., Liao, H., Wesson, C.R., Dunker, A.K., Kang, C., CC BY 3.0
Белки, образованные только остатками аминокислот, называются простыми. Сложными являются протеины, имеющие в своём составе компонент неаминокислотной природы. Это могут быть ионы металлов (Fe2+, Zn2+, Mg2+, Mn2+), липиды, нуклеотиды, сахара и др. Простыми белками являются альбумины крови, фибрин, некоторые ферменты (трипсин) и др. Сложные белки – это большинство ферментов, иммуноглобулины (антитела).
Состав аминокислот
Аминокислоты, как следует из их названия, содержат основную аминогруппу (— NH2), а также кислотную карбоксильную группу (—COOH), обе они связаны с центральным атомом углерода. Углерод дополнительно скреплен с водородом и функциональной белковой группой, называемой радикалом (R). Эти компоненты полностью заполняют все связи центрального атома углерода.
 Общая структура α-аминокислот, составляющих белки (кроме пролина).
Общая структура α-аминокислот, составляющих белки (кроме пролина).Автор: User:X-romix
Уникальный характер каждой аминокислоты определяется природой группы радикала. Обратите внимание, что если группа радикала не содержит атома водорода (Н), как в глицине, то аминокислота хиральна и может существовать в форме двух энантиомеров: d или L. В белках живых систем содержатся обычно α (L)-аминокислоты, а β (d)-аминокислоты встречаются крайне редко.
Группа радикала определяет химические свойства аминокислот – они могут быть полярными или неполярными, гидрофобными или гидрофильными. Серин с радикалом -CH2OH является полярной молекулой, Аланин, который имеет –CH3 как группу радикала – неполярен.
Существуют также основные аминокислоты (более чем с одной аминогруппой) и кислые аминокислоты (более чем с одной карбоксильной группой). Наличие дополнительной амино- или карбоксильной группы оказывает влияние на свойства аминокислоты, которые играют определяющую роль в формировании пространственной структуры белка.
В состав радикала некоторых аминокислот (например, цистеина) входят атомы серы. Все 20 аминокислот сгруппированы в пять химических классов, основанных на группе их радикала.
- Неполярные аминокислоты, такие как лейцин, часто имеют в качестве радикала —CH2 или —CH3.
- Полярные незаряженные аминокислоты, такие как треонин, с радикалом, содержащим кислород или гидроксильную группу (-OH).
- Заряженные аминокислоты, такие как глутаминовая кислота, с радикалом, имеющим кислоты или основания, способные к ионизации.
- Ароматические аминокислоты, такие как фенилаланин, имеющий группу радикала, содержащую органическое (углеродное) кольцо с чередованием одиночных и двойных связей. Они также неполярны.
- Аминокислоты, обладающие особыми функциями и свойствами. Например, метионин, который часто является первой аминокислотой в цепи белков, пролин, вызывающий перегибы в цепях, цистин, связывающий цепи вместе.
Каждая аминокислота влияет на форму белка по-разному, в зависимости от химической природы боковых групп. Например, части белковой цепи с многочисленными неполярными аминокислотами сворачиваются внутрь своей цепи путём гидрофобного исключения.
Белки и пептидные связи
В дополнении к группе радикала каждая аминокислота имеет положительно заряженную аминогруппу (NH3 +) на одном конце и отрицательно заряженную гидроксильную группу (COO -) на другом. Амино- и карбоксильные группы у пары аминокислот могут подвергаться реакции дегидрации (выделение молекулы воды) с образованием ковалентной связи. Ковалентная связь, скрепляющая две аминокислоты, называется пептидной. Скреплённые таким способом аминокислоты не могут свободно вращаться вокруг N-C связи. Этот факт является основным фактором образования конструкции белковых молекул.
 Пептидная связь
Пептидная связьНаличие как основной, так и кислотной групп обусловливает амфотерность (проявление как кислотных, так и основных свойств) и высокую реакционную способность аминокислот.
При соединении двух аминокислот образуется дипептид. На одном конце молекулы дипептида находится свободная аминогруппа, на другом — свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие аминокислоты, образуя олигопептиды. Если таким образом соединяется более 10 остатков аминокислот, то образуется полипептид.
Новаторская работа Фредерика Сангера в начале 1950-х годов доказала, что каждый вид белка имеет определённую аминокислотную последовательность. Для отщепления аминокислот он использовал химические методы, после этого определял их. Сангер преуспел в расшифровке аминокислотной последовательности инсулина. Он продемонстрировал, что все молекулы инсулина имеют одинаковый состав аминокислот.
Уровни структурной организации белков
Форма белка определяет его функцию. Один из способов изучить что-то столь же маленькое как белок – посмотреть на него при помощи коротковолнового излучения, которое представлено рентгеновскими лучами. Рентгеновские лучи пропускают через белок для получения дифракции его узора. Эта картинка кропотливо анализируется и позволяет исследователю построить трёхмерное изображение молекулы с положением каждого её атома. Первым белком, проанализированным таким образом, был миоглобин; вскоре такому же анализу был подвергнут связанный с ним белок гемоглобин.
Когда было изучено достаточное количество протеинов, стал очевиден общий принцип их строения: в каждом исследованном белке все внутренние аминокислоты, такие как лейцин, валин и фенилаланин, неполярны. Тенденция воды к исключению неполярных молекул буквально толкает такие части цепи аминокислот внутрь протеина. Неполярные аминокислоты вынуждены тесно контактировать друг с другом, оставляя мало свободного места внутри молекулы. Полярные и заряженные аминокислоты концентрируются на поверхности белка, за исключением немногих, играющих ключевые функциональные роли.
Структура белков, как правило, описывается как иерархия четырёх уровней: первичного, вторичного, третичного и четвертичного. Мы рассмотрим эту точку зрения, а затем интегрируем её с более современным подходом, вытекающим из расширяющихся знаний о белковой структуре.
 Уровни организации молекул белка
Уровни организации молекул белкаПервичная структура белков
Первичная структура белка – это его аминокислотная последовательность, т. е. это цепочка из множества аминокислотных остатков, соединённых пептидными связями. Это наиболее важная структура, так как именно она определяет форму, свойства и функции белка. На основе первичной структуры создаются другие формы молекулы.
Группы радикалов, которыми отличаются аминокислоты, не играют роли в пептидной цепи белков и протеин может включать любую последовательность аминокислот. Так как любая из 20 аминокислот может появиться в любом месте, белок, содержащий 100 мономеров, может образовать любую из 20 100 различных аминокислотных последовательностей. Это важное свойство белков позволяет им быть разнообразными, но каждый из них функционирует только при определённой аминокислотной последовательности.

Вторичная структура белка
Боковые и пептидные группы полипептидных цепей могут образовывать водородные связи. Вторичная структура белка возникает в результате связывания атомов водорода NH-групп и кислорода CO-групп. Полипептидная цепь при этом спирально закручивается. Водородные связи слабые, но благодаря их большому числу они обеспечивают стабильность этой структуры. Спиральную конфигурацию имеют, например, молекулы кератина, миозина и коллагена.
Водородные связи пептидов могут образовываться с водой. Если связей с водой будет слишком много, белки не смогут приобрести глобулярной структуры. Лайнус Полинг предположил, что пептидные группы могут взаимодействовать друг с другом, если пептид свёрнут в спираль, которую он назвал α-спиралью. Этот вид регулярного взаимодействия в пептиде формирует его вторичную структуру.
 Вторичная структура инсулина
Вторичная структура инсулинаДругая форма вторичной структуры формируется между зонами пептида, расположенными в один ряд, в результате чего получается плоская молекула, собранная в складки, называемая β-листом. Части белка могут быть либо параллельными, либо антипараллельными – в зависимости от того, являются ли смежные участки пептида ориентированными в одном или в противоположном направлении.
Эти два вида вторичной структуры создают зоны белка – цилиндрические (α-спирали) и плоские (β-листы). Конечная структура белка может включать области каждого типа вторичной структуры. Например ДНК-связывающие белки обычно имеют области α-спирали, которые могут лежать поперёк ДНК и взаимодействовать непосредственно с основаниями ДНК. Белки порины, образующие отверстия в мембранах, состоят из β-листов. В гемоглобине α и β-структуры (глобины) имеют в молекуле свои зоны.
 Вторичная структура белков
Вторичная структура белковТретичная структура белков
Окончательная структура химически связанных белков называется третичной. Третичная структура формируется за счет образования водородных, ионных и других связей, возникающих в водной среде между разными группами атомов белковой молекулы вторичной структуры.
У некоторых белков важную роль в образовании третичной структуры играют S – S связи (дисульфидные) между остатками цистеина (аминокислоты, содержащей серу). При этом полипептидная спираль укладывается в своеобразный клубок (глобулу) таким образом, что гидрофобные аминокислотные радикалы погружаются внутрь глобулы, а гидрофильные располагаются на поверхности и взаимодействуют с молекулами воды. Третичной структурой определяются специфичность белковых молекул, их биологическая активность. Её имеют многие белки, например миоглобин (белок, который участвует в создании запаса кислорода в мышцах) и трипсин (фермент, расщепляющий белки пищи в кишечнике).
Третичная структура стабилизируется рядом сил, в том числе:
- водородными связами между радикалами различных аминокислот;
- электростатическим притяжением радикалов с противоположными зарядами;
- гидрофобным исключением неполярных радикалов;
- ковалентными дисульфидными связами.
На стадии третичной структуры по форме молекул белки можно разделить на две группы:
- глобулярные – имеют округлую форму. Такую форму имеют глобулины и альбумины крови, фибриноген, гемоглобин;
- фибриллярные – характеризуются вытянутой, нитевидной формой молекул. Это кератин, коллаген, миозин, эластин и др.

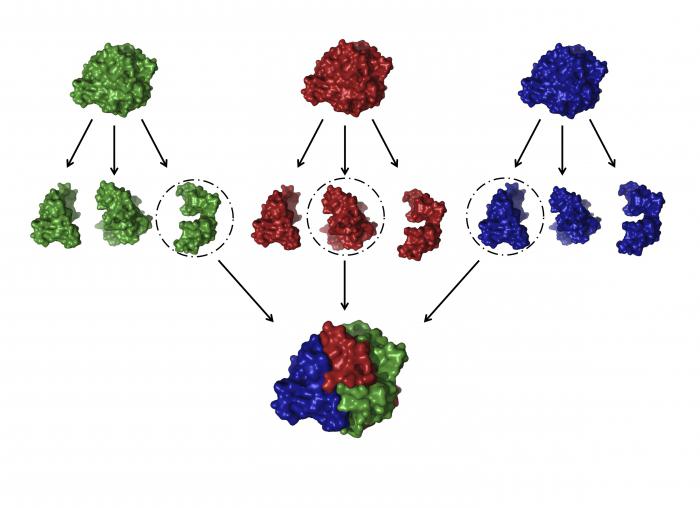
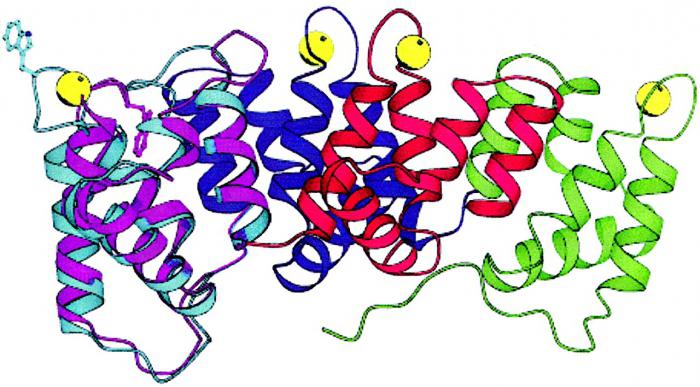
Четвертичная структура белка
Когда два или более полипептида связываются с образованием функционального белка, отдельные его цепи называются субъединицами. Расположение этих субъединиц и есть четвертичная структура. Субъединицы в таких белках чаще всего неполярны, поэтому они не связаны химически и отвечают за отдельные виды деятельности. Прочность четвертичной структуры обеспечивается взаимодействием слабых межмолекулярных сил.
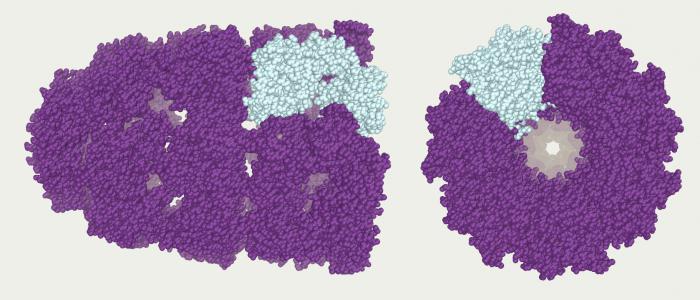
Четвертичная структура характерна для белка гемоглобина. Вспомните, что гемоглобин состоит из двух α-цепей и двух β-цепей, а ещё в его состав входит небелковый компонент – гем.
Субъединицы располагаются в их окончательной четвертичной структуре. Это конечная структура некоторых, но не всех белков. У протеинов, которые состоят только из одной полипептидной цепи, например у фермента лизоцима, конечной структурой является третичная.

Мотивы и домены – структурные элементы белков
Ручное определение последовательности аминокислот в белке – трудоёмкая работа. Эту ситуацию изменило открытие способности хранения информации о белке молекулой ДНК. Первоначально геном человека был расшифрован вручную. Появление технологий следующего поколения привело к заметному ускорению секвенирования.
Сегодня расшифрованы более 40 000 бактериальных геномов и почти 8 000 геномов эукариот, в том числе 80 последовательностей генов млекопитающих. Так как состав ДНК имеет непосредственное отношение к последовательности аминокислот в белках, у биологов теперь есть огромная база данных строения протеинов.
Новая информация заставила задуматься о логике генетического кода и основных закономерностях структуры белка. Исследователи до сих пор рассматривают иерархическую систему из четырёх уровней как важную, но в лексикон биологов вошли и новые термины: мотив укладки и белковый домен.
Мотив укладки белковых молекул
Когда биологи обнаружили третичную структуру белка (ещё более трудоёмкая работа, чем определение последовательности аминокислот в цепи), они заметили сходные элементы, расположенные в непохожих белках. Подобные структуры называются мотивами, а иногда «сверхсекундными структурами». Термин «мотив» заимствован из искусства и относится к тематическому повторяющемуся элементу в музыке или дизайне.
Один общий мотив β-α-β образует так называемую «складку Россмана» у большого количества протеинов. Вторым часто встречающимся мотивом является β-баррель, который представляет собой β-лист, сложенный по кругу, чтобы сформировать трубку. Третий тип мотива – спираль-поворот-спираль, состоит из двух α-спиралей, разделённых изгибом. Его используют белки для связывания с молекулой ДНК.
Логику структуры мотивов укладки исследователи до сих пор не могут понять. Вероятно, если аминокислоты являются буквами в языке белков, то мотивы представляют собой повторяющиеся слова или фразы. Мотивы укладки помогли определить неизвестные функции белков, а база данных белковых мотивов используется для поиска новых неизвестных протеинов.
Мотивы укладки являются довольно консервативными и встречаются в белках, которые не имеют ни функциональных, ни эволюционных связей. Определение мотивов укладки лежит в основе физической, или рациональной классификации белков.
Белковые домены
Домены – это функциональные единицы в виде глобулы внутри более крупной структуры белков. Их можно рассматривать как субструктуры внутри третичной структуры белка. В языке белков это «абзацы». Большинство белков состоит из нескольких доменов, которые выполняют различные части функций протеинов.
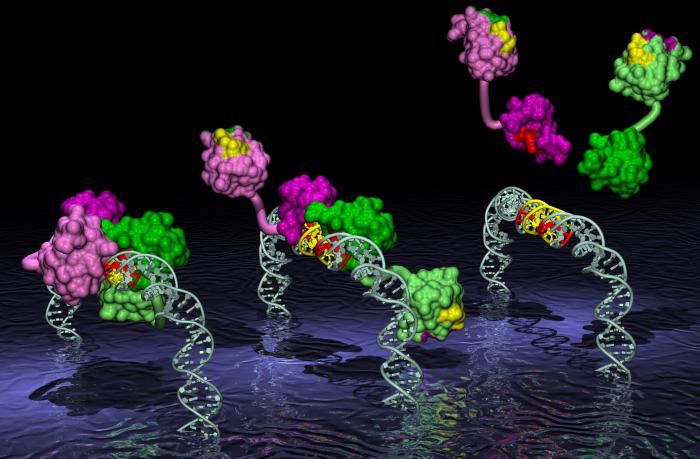
Во многих структурах эти домены могут быть физически разделены. Например, так устроены факторы транскрипции – белки, которые связываются с ДНК и инициируют построение РНК по комплементарной ей ДНК. Было выяснено, что если ДНК-связывающие области поменять местами с факторами транскрипции, специфичность фактора может быть изменена без изменения его способности стимулировать транскрипцию. Эксперименты по замене доменов были проведены со многими факторами транскрипции, и они указывают, что активационные и ДНК-связывающие домены действуют отдельно.
Эти образования также могут помогать протеинам складываться. По мере того, как полипептидная цепь приобретает свою структуру, домены принимают правильную форму. Это действие может быть продемонстрировано экспериментально. Искусственное продуцирование фрагмента полипептида, который образует домен в интактном белке, показывает, что фрагмент складывается, чтобы сформировать такую же структуру, как у прототипа.
Процесс складывания, белки-шапероны
Первоначально биохимики думали, что новоиспечённые белки сворачиваются спонтанно, пробуя различные конфигурации, как гидрофобные взаимодействия с водой толкают неполярные аминокислоты внутрь белков до тех пор, пока не будет достигнута их окончательная структура. Оказалось, что эта точка зрения слишком проста. Цепи протеинов могут быть сложены многими способами, поэтому пробы и ошибки заняли бы слишком много времени. По мере того как первичная цепь складывается, приобретая финальную структуру, неполярные «липкие» внутренние участки во время промежуточных стадий обнажаются. Если эти промежуточные формы поместить в пробирку со средой, идентичной той, что внутри клетки, они прилипают к другим, и нежелательные белки-партнёры образуют клейкую массу.
Как клетки избегают того, чтобы их белки слипались в массу? Ответ на вопрос появился во время изучения необычных мутаций, которые спасают бактериальные клетки от размножения внутри них вирусов. При этом белки вирусов, произведённые внутри клетки, не могут сложиться как следует. Дальнейшее исследование помогло выяснить, что клетки содержат белки-шапероны, помогающие другим белкам складываться правильно.
 Свёртывание белков
Свёртывание белковВ настоящее время молекулярные биологи выявили массу белков, действующих как шапероны. Это большой класс полимеров, который можно разделить на подклассы. Представители шаперонов были найдены в каждом исследуемом организме. Некоторые из них, называемые тепловыми шоковыми белками, вырабатывается в ответ на повышение температуры тела. Высокие температуры служат фактором денатурации белков, шоковые белки-шопероны помогают белкам правильно сворачиваться и в такой ситуации.
Один из хорошо изученных классов этих белков, названных шаперонинами, был изучен у кишечной палочки (Escherichia coli). У мутантов при инактивации шаперонинов 30% бактериального белка не складывались должным образом. Шаперонины собираются в комплекс, напоминающий цилиндрический контейнер. Белки могут заходить в этот контейнер, и даже неправильно сложенные молекулы складываются там заново.
Исследователи склонны думать о белках как о фиксированных структурах, но это не относится к шаперонинам. Их гибкость поразительна. Видимо, это нужно им для выполнения своих функций. Клетки используют эти белки для складывания некоторых молекул протеинов и восстановления их неправильной структуры.
Денатурация инактивирует белки
Еще одной важной особенностью белков является то, что они проявляют свою активность лишь в узких температурных рамках и в определённом диапазоне кислотности среды.
Если условия, окружающие белок, изменяются, то он может частично потерять свою структуру или полностью развернуться. Этот процесс называется денатурацией. Белки могут быть денатурированы, когда рН, температура или ионная концентрация окружающего раствора изменена. Денатурация происходит вследствие разрыва водородных, ионных, дисульфидных и других связей, стабилизирующих пространственную структуру белковых молекул. При этом может утрачиваться их четвертичная, третичная и даже вторичная структуры.
Денатурированные белки как правило биологически неактивны. Это особенно значимо в отношении ферментов: так как почти каждая химическая реакция происходит при их помощи, жизненно важно, чтобы они функционировали нормально.
До появления морозильников и холодильников единственным способом предохранения продуктов от размножения в них микроорганизмов было хранение их внутри раствора, содержащего высокую концентрацию соли или уксуса, которые денатурировали ферменты микроорганизмов и предотвращали их рост.
Большинство ферментов функционирует в очень узком диапазоне условий окружающей среды. У каждого энзима этот диапазон специфичен. Ферменты крови, которые работают при рН около 7,4, быстро денатурируют в кислой среде желудка. И наоборот, протеолитические ферменты желудка, работающие при рН=2 или менее, разбираются в основной среде крови. Аналогично у организмов, живущих вблизи океанических гидротермальных источников, есть ферменты, которые хорошо работают только в экстремальных температурах (до 100°С). Эти организмы не могут выжить в более прохладных водах, потому что их энзимы не функционируют должным образом при относительно низких температурах.
Если нормальные показатели окружающего раствора восстанавливаются, небольшой белок, не потерявший первичной структуры, может восстановиться. Этот процесс называется ренатурацией, он происходит благодаря взаимодействию неполярных аминокислот и воды. Первоначально этот процесс был установлен для энзима рибонуклеазы, его ренатурация привела к выводу, что первичная структура определяет третичную структуру белка. Более сложные белки редко складываются вновь из-за их сложной окончательной структуры. Их денатурация носит необратимый характер.

Важно отличать денатурацию от диссоциации. Субъединицы белков с четвертичной структурой могут быть диссоциированы (разделены) без потери своей индивидуальной третичной структуры. Например, молекула гемоглобина может диссоциировать на 4 молекулы (2 α-глобина и 2 β-глобина) без денатурации свёрнутых глобиновых белков. Они легко восстанавливают свою четвертичную структуру из четырёх субъединиц.
Вам будет интересно
Строение белков — урок. Химия, 8–9 класс.
Белки являются обязательной составной частью любого живого организма и играют важнейшую роль в обеспечении процессов жизнедеятельности.
В состав белков обязательно входят четыре химических элемента: углерод, водород, кислород и азот. Многие белки содержат серу. В состав некоторых входит фосфор. Есть белки, содержащие атомы металлов.
Белки — природные высокомолекулярные вещества (полимеры), состоящие из остатков аминокислот.
Аминокислотные остатки соединены в макромолекулах белков пептидной группой −NH−CO−, поэтому белки относят к полипептидам.
В состав белков входят двадцать аминокислот строения Nh3−C|H−COOHR. Аминокислотные остатки соединяются в макромолекулы белков в различной последовательности. Число аминокислотных остатков в молекулах тоже может быть разное. Поэтому многообразие белков практически безгранично. Каждый организм на Земле имеет свой собственный неповторимый набор белков.
Белковые молекулы могут содержать от одного до нескольких сотен и даже тысяч аминокислотных остатков, поэтому их относительные молекулярные массы изменяются от десятков тысяч до нескольких миллионов. Так, относительная молекулярная масса гемоглобина равна \(68 000\), яичного белка — \(44 000\), а вируса гриппа — \(32 000 000\).
Свойства белка в первую очередь определяются порядком соединения аминокислотных остатков в полипептидной цепи.
Последовательность аминокислотных остатков в макромолекуле называется первичной структурой белка.
Первичная структура
Существуют вторичная (спираль) и третичная (клубок) структуры белковых молекул. Они образуются в результате внутримолекулярного взаимодействия частей полипептидной цепи.
Вторичная структура
Третичная структура
Несколько белковых молекул могут соединяться друг с другом и образовывать четвертичную структуру.
Четвертичная структура
Источники:
Рудзитис Г. Е., Фельдман Ф. Г. Химия. 9 класс. М.: Просвещение, 2009. — 170 с.
Габриелян О. С. Химия. 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2011. — 226 с.
Вишневская Е. И., Ельницкий А. П. и др. Химия. 9 класс. Минск: Нар. асвета, 2012. — 199 с.
«Жизнь, есть способ существования белковых тел»
Ф. Энгельс.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д.
I. Состав белков
Белки (полипептиды) – биополимеры, построенные из остатков α-аминокислот, соединенных пептидными (амидными) связями. В состав этих биополимеров входят мономеры 20 типов. Такими мономерами являются аминокислоты. Каждый белок по своему химическому строению является полипептидом. Некоторые белки состоят из нескольких полипептидных цепей. В составе большинства белков находится в среднем 300-500 остатков аминокислот. Известно несколько очень коротких природных белков, длиной в 3-8 аминокислот, и очень длинных биополимеров, длиной более чем в 1500 аминокислот. Образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот:
Аминокислоты соединяются друг с другом за счёт образования новой связи между атомами углерода и азота – пептидной (амидной):
Из двух аминокислот (АК) можно получить дипептид, из трёх – трипептид, из большего числа АК получают полипептиды (белки).
II. Функции белков
Функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. Основным источником α — аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают α — аминокислоты. Многие α — аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белковα — аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми. К ним относятся валин, лейцин, треонин, метионин, триптофан и др. (см. таблицу). При некоторых заболеваниях человека перечень незаменимых аминокислот расширяется.

Рис. 5. Функции белков в организме
1. Каталитическая функция
Oсуществляется с помощью специфических белков — катализаторов (ферментов). При их участии увеличивается скорость различных реакций обмена веществ и энергии в организме.
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК. Известно несколько тысяч ферментов. Среди них такие, как, например пепсин, расщепляют белки в процессе пищеварения.
2. Транспортная функция
Cвязывание и доставка (транспорт) различных веществ от одного органа к другому.
Так, белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин. Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях.
3. Защитная функция
Cвязывание и обезвреживание веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов.
Защитную функцию выполняют специфические белки (антитела — иммуноглобулины), образующиеся в организме (физическая, химическая и иммунная защита). Так, например, защитную функцию выполняет белок плазмы крови фибриноген, участвуя в свертывании крови и тем самым уменьшая кровопотери.
4. Сократительная функция (актин, миозин)
B результате взаимодействия белков происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
5. Структурная функция
Белки составляют основу строения клетки. Некоторые из них (коллаген соединительной ткани, кератин волос, ногтей и кожи, эластин сосудистой стенки, кератин шерсти, фиброин шелка и др.) выполняют почти исключительно структурную функцию.
В комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных образований.
6. Гормональная (регуляторная) функция
Способность передавать сигналы между тканями, клетками или организмами.
Выполняют белки-регуляторы обмена веществ. Они относятся к гормонам, которые образуются в железах внутренней секреции, некоторых органах и тканях организма.
7. Питательная функция
Осуществляется резервными белками, которые запасаются в качестве источника энергии и вещества.
Например: казеин, яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат источником питания для новорожденного.
Разнообразные функции белков определяются α-аминокислотным составом и строением их высокоорганизованных макромолекул.
III. Физические свойства белков
Белки – очень длинные молекулы, которые состоят из звеньев аминокислот, сцепленных пептидными связями. Это – природные полимеры, молекулярная масса белков колеблется от нескольких тысяч до нескольких десятков миллионов. Например, альбумин молока имеет молекулярную массу 17400, фибриноген крови – 400.000, белки вирусов – 50.000.000. Каждый пептид и белок обладают строго определенным составом и последовательностью аминокислотных остатков в цепи, это и определяет их уникальную биологическую специфичность. Количество белков характеризует степень сложности организма (кишечная палочка – 3000, а в человеческом организме более 5 млн. белков).
Первый белок, с которым мы знакомимся в своей жизни, это белок куриного яйца альбумин — хорошо растворим в воде, при нагревании свертывается (когда мы жарим яичницу), а при долгом хранении в тепле разрушается, яйцо протухает. Но белок спрятан не только под яичной скорлупой. Волосы, ногти, когти, шерсть, перья, копыта, наружный слой кожи — все они почти целиком состоят из другого белка, кератина. Кератин не растворяется в воде, не свертывается, не разрушается в земле: рога древних животных сохраняются в ней так же хорошо, как и кости. А белок пепсин, содержащийся в желудочном соке, способен разрушать другие белки, это процесс пищеварения. Белок инрерферон применяется при лечении насморка и гриппа, т.к. убивает вызывающие эти болезни вирусы. А белок змеиного яда способен убивать человека.
IV. Классификация белков
С точки зрения пищевой ценности белков, определяемой их аминокислотным составом и содержанием так называемых незаменимых аминокислот, белки подразделяются на полноценные и неполноценные.
К полноценным белкам относятся преимущественно белки животного происхождения, кроме желатины, относящейся к неполноценным белкам.
Неполноценные белки — преимущественно растительного происхождения. Однако некоторые растения (картофель, бобовые и др.) содержат полноценные белки. Из животных белков особенно большую ценность для организма представляют белки мяса, яиц, молока и др.
В состав многих белков помимо пептидных цепей входят и неаминокислотные фрагменты, по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки содержат только аминокислотные цепи, сложные белки содержат также неаминокислотные фрагменты (Например, гемоглобин содержит железо).
По общему типу строения белки можно разбить на три группы:
1. Фибриллярные белки — нерастворимы в воде, образуют полимеры, их структура обычно высокорегулярна и поддерживается, в основном, взаимодействиями между разными цепями. Белки, имеющие вытянутую нитевидную структуру. Полипептидные цепи многих фибриллярных белков расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слои.
Большинство фибриллярных белков не растворяются в воде. К фибриллярным белкам относят например, α-кератины (на их долю приходится почти весь сухой вес волос, белки шерсти, рогов, копыт, ногтей, чешуи, перьев), коллаген — белок сухожилий и хрящей, фиброин — белок шёлка).
2. Глобулярные белки — водорастворимы, общая форма молекулы более или менее сферическая. Среди глобулярных и фибриллярных белков выделяют подгруппы. К глобулярным белкам относятся ферменты, иммуноглобулины, некоторые гормоны белковой природы (например, инсулин) а также другие белки, выполняющие транспортные, регуляторные и вспомогательные функции.
3. Мембранные белки — имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки. Мембранные белки выполняют функцию рецепторов, то есть осуществляют передачу сигналов, а также обеспечивают трансмембранный транспорт различных веществ. Белки-транспортеры специфичны, каждый из них пропускает через мембрану только определённые молекулы или определённый тип сигнала.
Белки – неотъемлемая часть пищи животных и человека. Живой организм отличается от неживого в первую очередь наличием белков. Для живых организмов характерно огромное разнообразие белковых молекул и их высокая упорядоченность, что и определяет высокую организацию живого организма, а также способность двигаться, сокращаться, воспроизводиться, способность к обмену веществ и к многим физиологическим процессам.
V. Строение белков
Фишер Эмиль Герман, немецкий химик-органик и биохимик. В 1899 начал работы по химии белков. Используя созданный им в 1901 эфирный метод анализа аминокислот, Ф. впервые осуществил качественные и количественные определения продуктов расщепления белков, открыл валин, пролин (1901) и оксипролин (1902), экспериментально доказал, что аминокислотные остатки связываются между собой пептидной связью; в 1907 синтезировал 18-членный полипептид. Ф. показал сходство синтетических полинептидов и пептидов, полученных в результате гидролиза белков. Ф. занимался также изучением дубильных веществ. Ф. создал школу химиков-органиков. Иностранный член-корреспондент Петербургской АН (1899). Нобелевская премия (1902).
Разнообразные функции белков определяются α-аминокислотным составом и строением их высокоорганизованных макромолекул.
Выделяют 4 уровня структурной организации белков:
|
1. Первичная структура — определенная последовательность α-аминокислотных остатков в полипептидной цепи. |
|
|
2. Вторичная структура – a) конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О. Одна из моделей вторичной структуры — α-спираль.
б) Другая модель — β-форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи.
|
А Б
|
|
3. Третичная структура — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий. |
|
|
4. Четвертичная структура — агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей |
|
Молекула белка стремится не только к реализации своей биоактивности, но и к наиболее компактной структуре, позволяющей ей максимально реализовать свои функции.

Рис. Строение белков
Строение белков: вторичная структура
Строение белков: третичная структура
Иллюстрация. Четвертичная структура белка (на примере гемоглобина)
VI. Тренажеры
Тренажер №1: “Биологические функции белков”
Тренажер №2: “Свойства белков”
ЦОРы
Фильм: «Функции белков»
Функции белков
строение и функции. Свойства белков
Как известно, белки — основа зарождения жизни на нашей планете. По теории Опарина-Холдейна именно коацерватная капля, состоящая из молекул пептидов, стала основой зарождения живого. Это и не вызывает сомнений, ведь анализ внутреннего состава любого представителя биомассы показывает, что эти вещества есть во всем: растениях, животных, микроорганизмах, грибах, вирусах. Причем они очень разнообразны и макромолекулярны по природе.
Названий у этих структур четыре, все они являются синонимами:
- белки;
- протеины;
- полипептиды;
- пептиды.

Белковые молекулы
Их количество поистине неисчислимо. При этом все белковые молекулы можно разделить на две большие группы:
- простые — состоят только из аминокислотных последовательностей, соединенных пептидными связями;
- сложные — строение и структура белка характеризуются дополнительными протолитическими (простетическими) группами, называемыми еще кофакторами.
При этом сложные молекулы также имеют свою классификацию.
Градация сложных пептидов
- Гликопротеиды — тесно связанные соединения белка и углевода. В структуру молекулы вплетаются простетические группы мукополисахаридов.
- Липопротеиды — комплексное соединение из белка и липида.
- Металлопротеиды — в качестве простетической группы выступают ионы металлов (железо, марганец, медь и другие).
- Нуклеопротеиды — связь белка и нуклеиновых кислот (ДНК, РНК).
- Фосфопротеиды — конформация протеина и остатка ортофосфорной кислоты.
- Хромопротеиды — очень схожи с металлопротеидами, однако элемент, входящий в состав простетической группы, представляет собой целый окрашенный комплекс (красный — гемоглобин, зеленый — хлорофилл и так далее).
У каждой рассмотренной группы строение и свойства белков различны. Функции, которые они выполняют, также варьируются в зависимости от типа молекулы.
Химическое строение белков
С данной точки зрения протеины — это длинная, массивная цепь аминокислотных остатков, соединяющихся между собой специфическими связями, называемыми пептидными. От боковых структур кислот отходят ответвления — радикалы. Такое строение молекулы было открыто Э. Фишером в начале XXI века.
Позже более подробно были изучены белки, строение и функции белков. Стало ясно, что аминокислот, образующих структуру пептида, всего 20, но они способны комбинироваться самым разным способом. Отсюда и разнообразие полипептидных структур. Кроме того, в процессе жизнедеятельности и выполнения своих функций белки способны претерпевать ряд химических превращений. В результате они меняют структуру, и появляется уже совсем новый тип соединения.
Чтобы разорвать пептидную связь, то есть нарушить белок, строение цепей, нужно подобрать очень жесткие условия (действие высоких температур, кислот или щелочей, катализатора). Это объясняется высокой прочностью ковалентных связей в молекуле, а именно в пептидной группе.
Обнаружение белковой структуры в условиях лаборатории проводится при помощи биуретовой реакции — воздействия на полипептид свежеосажденным гидроксидом меди (II). Комплекс пептидной группы и иона меди дает ярко-фиолетовую окраску.
Существует четыре основные структурные организации, каждая из которых имеет свои особенности строения белков.
Уровни организации: первичная структура
Как уже упоминалось выше, пептид — это последовательность аминокислотных остатков с включениями, коферментами или же без них. Так вот первичной называют такую структуру молекулы, которая является природной, естественной, представляет собой истинно аминокислоты, соединенные пептидными связями, и больше ничего. То есть полипептид линейного строения. При этом особенности строения белков такого плана — в том, что такое сочетание кислот является определяющим для выполнения функций белковой молекулы. Благодаря наличию данных особенностей возможно не только идентифицировать пептид, но и предсказать свойства и роль совершенно нового, еще не открытого. Примеры пептидов, обладающих природным первичным строением, — инсулин, пепсин, химотрипсин и другие.
Вторичная конформация
Строение и свойства белков этой категории несколько меняются. Такая структура может сформироваться изначально от природы либо при воздействии на первичную жестким гидролизом, температурой или иными условиями.
Данная конформация имеет три разновидности:
- Ровные, правильные, стереорегулярные витки, построенные из остатков аминокислот, которые закручиваются вокруг основной оси соединения. Удерживаются вместе только водородными связями, возникающими между кислородом одной пептидной группировки и водородом другой. Причем строение считается правильным из-за того, что витки равномерно повторяются через каждые 4 звена. Такая структура может быть как левозакрученной, так и правозакрученной. Но в большинстве известных белков преобладает правовращающий изомер. Такие конформации принято называть альфа-структурами.
- Состав и строение белков следующего типа отличается от предыдущего тем, что водородные связи образуются не между рядом стоящими по одной стороне молекулы остатками, а между значительно удаленными, причем на достаточно большое расстояние. По этой причине вся структура принимает вид нескольких волнообразных, извитых змейкой полипептидных цепочек. Есть одна особенность, которую должен проявлять белок. Строение аминокислот на ответвлениях должно быть максимально коротким, как у глицина или аланина, например. Этот тип вторичной конформации носит название бета-листов за способность будто слипаться при образовании общей структуры.
- Относящееся к третьему типу строение белка биология обозначает как сложные, разноразбросанные, неупорядоченные фрагменты, не обладающие стереорегулярностью и способные изменять структуру под воздействием внешних условий.
Примеров белков, имеющих вторичную структуру от природы, не выявлено.
Третичное образование
Это достаточно сложная конформация, имеющая название «глобула». Что собой представляет такой белок? Строение его основывается на вторичной структуре, однако добавляются новые типы взаимодействий между атомами группировок, и вся молекула словно сворачивается, ориентируясь, таким образом, на то, чтобы гидрофильные группировки были направлены внутрь глобулы, а гидрофобные — наружу.
Этим объясняется заряд белковой молекулы в коллоидных растворах воды. Какие же типы взаимодействий здесь присутствуют?
- Водородные связи — остаются без изменений между теми же самыми частями, что и во вторичной структуре.
- Гидрофобные (гидрофильные) взаимодействия — возникают при растворении полипептида в воде.
- Ионные притяжения — образуются между разнозаряженными группами аминокислотных остатков (радикалов).
- Ковалентные взаимодействия — способны формироваться между конкретными кислотными участками — молекулами цистеина, вернее, их хвостами.
Таким образом, состав и строение белков, обладающих третичной структурой, можно описать как свернутые в глобулы полипептидные цепи, удерживающие и стабилизирующие свою конформацию за счет разных типов химических взаимодействий. Примеры таких пептидов: фосфоглицераткеназа, тРНК, альфа-кератин, фиброин шелка и другие.
Четвертичная структура
Это одна из самых сложных глобул, которую образуют белки. Строение и функции белков подобного плана очень многогранны и специфичны.
Что собой представляет такая конформация? Это несколько (в некоторых случаях десятки) крупных и мелких полипептидных цепей, которые формируются независимо друг от друга. Но затем за счет тех же взаимодействий, что мы рассматривали для третичной структуры, все эти пептиды скручиваются и переплетаются между собой. Таким образом получаются сложные конформационные глобулы, которые могут содержать и атомы металлов, и липидные группировки, и углеводные. Примеры таких белков: ДНК-полимераза, белковая оболочка табачного вируса, гемоглобин и другие.
Все рассмотренные нами структуры пептидов имеют свои методы идентификации в лабораторных условиях, основанные на современных возможностях использования хроматографии, центрифугирования, электронной и оптической микроскопии и высоких компьютерных технологиях.
Выполняемые функции
Строение и функции белков тесно коррелируют друг с другом. То есть каждый пептид играет определенную роль, уникальную и специфическую. Встречаются и такие, которые способны выполнять в одной живой клетке сразу несколько значительных операций. Однако можно в обобщенном виде выразить основные функции белковых молекул в организмах живых существ:
- Обеспечение движения. Одноклеточные организмы, либо органеллы, или некоторые виды клеток способны к передвижениям, сокращениям, перемещениям. Это обеспечивается белками, входящими в состав структуры их двигательного аппарата: ресничек, жгутиков, цитоплазматической мембраны. Если же говорить о неспособных к перемещениям клетках, то белки могут способствовать их сокращению (миозин мышц).
- Питательная или резервная функция. Представляет собой накопление белковых молекул в яйцеклетках, зародышах и семенах растений для дальнейшего восполнения недостающих питательных веществ. При расщеплении пептиды дают аминокислоты и биологически активные вещества, которые необходимы для нормального развития живых организмов.
- Энергетическая функция. Помимо углеводов, силы организму могут давать и белки. При распаде 1 г пептида высвобождается 17,6 кДж полезной энергии в форме аденозинтрифосфорной кислоты (АТФ), которая расходуется на процессы жизнедеятельности.
- Сигнальная и регуляторная функция. Заключается в осуществлении тщательного контроля за происходящими процессами и передачи сигналов от клеток к тканям, от них к органам, от последних к системам и так далее. Типичным примером может служить инсулин, который строго фиксирует количество глюкозы в крови.
- Рецепторная функция. Осуществляется путем изменения конформации пептида с одной стороны мембраны и вовлечения в реструктуризацию другого конца. При этом и происходит передача сигнала и необходимой информации. Чаще всего такие белки встраиваются в цитоплазматические мембраны клеток и осуществляют строгий контроль над всеми веществами, проходящими через нее. Также оповещают о химических и физических изменениях окружающей среды.
- Транспортная функция пептидов. Ее осуществляют белки-каналы и белки-переносчики. Роль их очевидна — транспортировка необходимых молекул к местам с низкой концентрацией из частей с высокой. Типичным примером служит перенос кислорода и диоксида углерода по органам и тканям белком гемоглобином. Ими же осуществляется доставка соединений с невысокой молекулярной массой через мембрану клетки внутрь.
- Структурная функция. Одна из важнейших из тех, которые выполняет белок. Строение всех клеток, их органелл обеспечивается именно пептидами. Они подобно каркасу задают форму и структуру. Кроме того, они же ее поддерживают и видоизменяют в случае необходимости. Поэтому для роста и развития всем живым организмам необходимы белки в рационе питания. К таким пептидам можно отнести эластин, тубулин, коллаген, актин, кератин и другие.
- Каталитическая функция. Ее выполняют ферменты. Многочисленные и разнообразные, они ускоряют все химические и биохимические реакции в организме. Без их участия обычное яблоко в желудке смогло бы перевариться только за два дня, с большой вероятностью загнив при этом. Под действием каталазы, пероксидазы и других ферментов этот процесс происходит за два часа. В целом именно благодаря такой роли белков осуществляется анаболизм и катаболизм, то есть пластический и энергетический обмен.

Защитная роль
Существует несколько типов угроз, от которых белки призваны оберегать организм.
Во-первых, химическая атака травмирующих реагентов, газов, молекул, веществ различного спектра действия. Пептиды способны вступать с ними в химическое взаимодействие, переводя в безобидную форму или же просто нейтрализуя.
Во-вторых, физическая угроза со стороны ран — если белок фибриноген вовремя не трансформируется в фибрин на месте травмы, то кровь не свернется, а значит, закупорка не произойдет. Затем, наоборот, понадобится пептид плазмин, способный сгусток рассосать и восстановить проходимость сосуда.
В-третьих, угроза иммунитету. Строение и значение белков, формирующих иммунную защиту, крайне важны. Антитела, иммуноглобулины, интерфероны — все это важные и значимые элементы лимфатической и иммунной системы человека. Любая чужеродная частица, вредоносная молекула, отмершая часть клетки или целая структура подвергается немедленному исследованию со стороны пептидного соединения. Именно поэтому человек может самостоятельно, без помощи лекарственных средств, ежедневно защищать себя от инфекций и несложных вирусов.
Физические свойства
Строение белка клетки весьма специфично и зависит от выполняемой функции. А вот физические свойства всех пептидов схожи и сводятся к следующим характеристикам.
- Вес молекулы — до 1000000 Дальтон.
- В водном растворе формируют коллоидные системы. Там структура приобретает заряд, способный варьироваться в зависимости от кислотности среды.
- При воздействии жестких условий (облучение, кислота или щелочь, температура и так далее) способны переходить на другие уровни конформаций, то есть денатурировать. Данный процесс в 90% случаев необратим. Однако существует и обратный сдвиг — ренатурация.
Это основные свойства физической характеристики пептидов.
строение и биологические функции молекулы белка
Хотите узнать о строении и функции белка? Читайте далее, и вы узнаете: чем занимаются белки в организме человека, что такое первичная, вторичная, третичная и даже четвертичная структура белка, как классифицируют белки и какие последствия белкового голодания. Также можно посмотреть короткое видео о функциях белков.
Зачем он нужен, этот белок? Может, без него обойдемся?
Нет, не обойдемся. Бородатый основатель диалектического материализма Фридрих Энгельс сказал: жизнь – есть способ существования белковых тел. Иначе говоря, белок – это жизнь, нет белка – увы и ах. В норме белок составляет 50%, т.е. половину от сухой массы клетки, а от сухой массы тела человека они составляют от 45%.
Особенности строения белков позволяют им проявлять различные свойства, чем обусловлены их разнообразные биологические функции
Белки иначе называют протеинами, это одно и то же.
Функции белка в организме
- Белки или протеины являются теми кирпичиками, из которых сложен наш организм. Они являются структурными элементами клеточных мембран (липопротеины, гликопротеины), и внеклеточных структур. Коллаген образует сухожилия, он же отвечает за упругость кожи, кератин образует волосы и ногти.
- Транспорт необходимых элементов по организму. Гемоглобин переносит кислород от легких ко всем органам и тканям, а от них – уносит углекислый газ, белок альбумин переносит жирные кислоты, особые белки таскают холестерин. В составе клеточных мембран имеются белки, которые обеспечивают перенос некоторых веществ и ионов из клетки во внеклеточное пространство и обратно.
- Гормоны – особые вещества, регулирующие процессы обмена веществ – имеют белковую природу. Например, гормон инсулин загоняет сахар из плазмы крови в клетки
- Защита организма от чужеродных агентов. Гамма-глобулины обезвреживают микробов, интерфероны подавляют размножение вирусов. Фибрин останавливает кровотечения.
- Обеспечение сокращения двигательной мускулатуры и других сокращающихся тканей. Актин и миозин входят в состав мышц тела, тропонин, тропомиозин – мышц сердца.
- Протеины принимают сигналы из внешней среды и передают команды в клетку. Под воздействием факторов внешней среды сигнальные белки изменяют свою третичную структуру, что в свою очередь запускает цепь биохимических процессов. Так родопсин реагирует на свет, преобразуя световую энергию в электрическую, которая передается по нервным клеткам в головной мозг, где формируется зрительная картинка.
- Белки являются ферментами – катализаторами, благодаря которым возможно протекание биохимических реакций при низких температурах (370С).
- Регуляторная функция: протеины – регуляторы включают и выключают гены клетки, тем самым подавляя либо активируя биохимические процессы.
- Протеины, как правило, не накапливаются в организме, за исключением альбумина яйца и казеина молока. Лишних белков в организме нет. Однако, они могут соединяться с другими веществами и микроэлементами, препятствуя их выведению из организма. Так ферритин образует комплекс с железом, высвобождающимся при распаде гемоглобина, и вновь включает его в биологические процессы.
- Энергетическая функция. При распаде 1 г. белка выделяется 4 ккал (17,6 кДж). В качестве источника энергии белки используются при истощении других, нормативных источников – углеводов и жиров. Перефразируя Д.И.Менделеева, можно сказать, что топить белками, это все равно что топить ассигнациями, настолько они ценны для организма.
Строение молекулы белка
Молекула белка — это длинная цепочка, т.е. полимер, состоящая из мономеров – аминокислот. Почему аминокислот? Потому что у каждой молекулы есть хвост органической кислоты C-O-OH и аминогруппа NH2. В цепочке-полимере каждый мономер – аминокислота присоединяет свой кислотный остаток к аминогруппе другого мономера, получается прочная связь, именуемая пептидной.
Понятия белок и пептид близки, но не равнозначны. Обычно пептидами называют некоторую последовательность аминокислотных остатков. Выделяют олигопептиды – короткие цепочки в 10-15 аминокислот и полипептиды – длинные цепочки аминокислотных последовательностей. Белок – это полипептид, имеющий особую форму пространственной организации.
Нанизывая аминокислоты, как бусинки в ожерелке, формируется первичная структура белка, т.е. последовательность аминокислотных остатков.
В пространстве белок существует не в виде вытянутой нитки, а завивается спиралью, т.е. формирует вторичную структуру.
Спиралька сворачивается в шарик – глобулу, это уже третичная структура белка.
Некоторые белки (не все) имеют четвертичную структуру, объединяя в своем составе несколько молекул, каждая со своей первичной, вторичной и третичной структурой.
Зачем это надо знать? Потому что переваривание и усвоение белка напрямую зависит от его структуры: чем плотнее упакован белок в составе пищевого продукта, тем тяжелее он поддается перевариванию, тем больше энергии надо затратить на его усвоение.
Распад связей в молекуле белка называется денатурацией. Денатурация может быть обратимой, когда белок восстанавливает структуру, и необратимой. Необратимой денатурации белки подвергаются в том числе при воздействии высокой температуры – для человека это свыше 420С, именно поэтому лихорадка опасна для жизни.
Мы подвергаем белки контролируемой денатурации в процессе приготовления пищи, когда варим мясо или рыбу, кипятим молоко, жарим или варим яйца, варим каши и печем хлеб. При мягком температурном воздействии, белки с распавшимися связями становятся более доступными для пищеварительных ферментов и лучше усваиваются организмом. При длительном и жестком температурном воздействии – жарке на углях, длительной варке – происходит вторичная денатурация белка с образованием трудноперевариваемых соединений.
Аминокислоты
Существует более двух сотен различных аминокислот, но в составе белков — полимеров постоянно встречаются лишь двадцать. Эти 20 «магических» аминокислот делятся на две неравные группы: заменимые, т.е. те, которые могут вырабатываться самим организмом, и незаменимые (эссенциальные), они организмом человека не вырабатываются, и мы должны в обязательном порядке получать их с пищей.
К заменимым аминокислотам относятся: Аланин, Аргинин, Аспарагиновая кислота, Глицин, Глутаминовая кислота, Пролин, Серин, Тирозин, Цистин.
Незаменимые аминокислоты: Валин, Изолейцин, Лейцин, Лизин, Метионин, Треонин, Триптофан, Фенилаланин
Для детей незаменимыми аминокислотами являются Аргинин и Гистидин.
Классификация белков
По содержанию аминокислот белки делятся на полноценные и неполноценные.
Полноценный белок содержит в своем составе все необходимые аминокислоты, а неполноценный белок, соответственно, каких-то аминокислот не содержит.
Для строительства всех белков организма важно не только наличие всех аминокислот, но и их пропорции в пищевом продукте. Пища, наиболее близкая по аминокислотному составу белкам тела человека, является оптимальной. Если какой-то одной аминокислоты не хватает, другие аминокислоты не могут использоваться организмом, более того, для того, чтобы возместить нехватку, начнут распадаться собственные белки, в первую очередь белки – ферменты, участвующие в процессах биосинтеза, и мышечные белки. В условиях недостатка той или иной незаменимой аминокислоты, другие аминокислоты оказываются избыточными, хотя этот избыток относительный. Распадающиеся мышечные белки образуют высокотоксичные продукты обмена и усиленно выводятся организмом, создавая отрицательных азотистый баланс. Человек начинает хиреть, хотя может искренне считать, что с питанием у него все в порядке.
По своему происхождению белки делятся на животные и растительные.
К животным белкам относятся белки яиц, молока и молочных продуктов, рыбы и морепродуктов, мясо животных и птиц.
К растительным белкам относятся белки зерновых, бобовых, орехов и грибов.
Продукты питания считаются белковыми, если они содержат не меньше 15% белка.
Все животные белки являются полноценными, т.е. содержат полный набор аминокислот. Большинство растительных белков являются неполноценными.
Последствия белкового голодания
При недостаточном поступлении белка с пищей в организме развиваются дегенеративные процессы, связанные с невозможностью выполнять необходимые функции. В первую очередь страдает иммунитет. Человек становится предрасположен к вирусным и бактериальным инфекциям, болезни приобретают затяжной, хронический характер. Начинают выпадать волосы, кожа становится дряблой, морщинистой. Страдает волевая сфера, человека охватывает апатия, полное нежелание чем-либо заниматься, присоединяется депрессия. Уменьшается мышечная масса, замедляется обмен веществ. Начинаются проблемы с пищеварением, появляется т.н. «синдром раздраженного кишечника», когда прием пищи сопровождается метеоризмом, поносы сменяются запорами и наоборот. Угнетается детородная функция, у женщин прекращаются месячные. В тяжелых случаях начинаются структурные изменения в органах и тканях, видимое истощение. Белковое голодание детей приводит к умственной отсталости.
Тяжелое белковое голодание в наше время в цивилизованных странах, куда мы относим и нашу страну, если исключить заболевания, типа туберкулеза или онкологии, встречаются у людей, практикующих безумные голодные диеты в маниакальном стремлении похудеть.
Последнее сообщение касалось Анджелины Джоли, ее госпитализировали с весом 35 кг – такими застали советские освободители узников нацистских конц.лагерей. Вряд ли живые скелеты являли собой образцы красоты.
Однако недостаток белка – не такое уж редкое состояние, объясняющееся нездоровой структурой питания, сложившейся вследствие относительной дороговизны белковых продуктов. В стремлении сэкономить люди переходят на углеводно-жировую диету с потреблением неполноценного растительного белка. Свою лепту вносят полуфабрикаты, изготовленные из суррогатов, и белковыми продуктами не являющимися. Так человек, покупающий готовые котлеты, колбасу, сосиски может искренне считать, что потребляет достаточно белка. Не заблуждайтесь.
В следующей статье вы узнаете, сколько и какого белка необходимо человеку, чтобы оставаться здоровым.
Оставляйте комментарии, делитесь информацией в социальных сетях. Галина Баева.
Белки, их строение и функции — Студопедия
Белки – это биологические гетерополимеры, мономерами которых являются аминокислоты. Белки синтезируются в живых организмах и выполняют в них определенные функции.
В состав белков входят атомы углерода, кислорода, водорода, азота и иногда серы. Мономерами белков являются аминокислоты – вещества, имеющие в своем составе неизменяемые части аминогруппу Nh3 и карбоксильную группу СООН и изменяемую часть – радикал. Именно радикалами аминокислоты отличаются друг от друга. Аминокислоты обладают свойствами кислоты и основания (они амфотерны), поэтому могут соединяться друг с другом. Их количество в одной молекуле может достигать нескольких сотен. Чередование разных аминокислот в разной последовательности позволяет получать огромное количество различных по структуре и функциям белков.
В белках встречается 20 видов различных аминокислот, некоторые из которых животные синтезировать не могут. Они получают их от растений, которые могут синтезировать все аминокислоты. Именно до аминокислот расщепляются белки в пищеварительных трактах животных. Из этих аминокислот, поступающих в клетки организма, строятся его новые белки.
Структура белковой молекулы . Под структурой белковой молекулы понимают ее аминокислотный состав, последовательность мономеров и степень скрученности молекулы, которая должна умещаться в различных отделах и органоидах клетки, причем не одна, а вместе с огромным количеством других молекул.
Последовательность аминокислот в молекуле белка образует его первичную структуру. Она зависит от последовательности нуклеотидов в участке молекулы ДНК (гене), кодирующем данный белок. Соседние аминокислоты связаны пептидными связями, возникающими между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты.
Длинная молекула белка сворачивается и приобретает сначала вид спирали. Так возникает вторичная структура белковой молекулы. Между СО и NH – группами аминокислотных остатков, соседних витков спирали, возникают водородные связи, удерживающие цепь.
Молекула белка сложной конфигурации в виде глобулы (шарика), приобретает третичную структуру. Прочность этой структуры обеспечивается гидрофобными, водородными, ионными и дисульфидными S-S связями.
Некоторые белки имеют четвертичную структуру, образованную несколькими полипептидными цепями (третичными структурами). Четвертичная структура так же удерживается слабыми нековалентными связями – ионными, водородными, гидрофобными. Однако прочность этих связей невелика и структура может быть легко нарушена. При нагревании или обработке некоторыми химическими веществами белок подвергается денатурации и теряет свою биологическую активность. Нарушение четвертичной, третичной и вторичной структур обратимо. Разрушение первичной структуры необратимо.
В любой клетке есть сотни белковых молекул, выполняющих различные функции. Кроме того, белки имеют видовую специфичность. Это означает, что каждый вид организмов обладает белками, не встречающимися у других видов. Это создает серьезные трудности при пересадке органов и тканей от одного человека к другому, при прививках одного вида растений на другой и т.д.
Функции белков. Каталитическая (ферментативная ) – белки ускоряют все биохимические процессы, идущие в клетке: расщепление питательных веществ в пищеварительном тракте, участвуют в реакциях матричного синтеза. Каждый фермент ускоряет одну и только одну реакцию (как в прямом, так и в обратном направлении). Скорость ферментативных реакций зависит от температуры среды, уровня ее рН, а также от концентраций реагирующих веществ и концентрации фермента.
Транспортная – белки обеспечивают активный транспорт ионов через клеточные мембраны, транспорт кислорода и углекислого газа, транспорт жирных кислот.
Защитная – антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь.
Структурная – одна из основных функций белков. Белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин – хрящи и сухожилия.
Сократительная – обеспечивается сократительными белками – актином и миозином.
Сигнальная – белковые молекулы могут принимать сигналы и служить их переносчиками в организме (гормонами). Следует помнить, что не все гормоны являются белками.
Энергетическая – при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры.
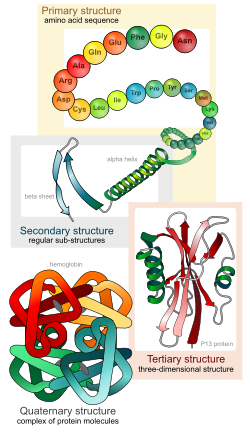 Структура белка , от первичной до четвертичной структуры.
Структура белка , от первичной до четвертичной структуры.Белковая структура описывает, как организованы белковые молекулы. Именно эта структура заставляет белки работать.
Белки являются важными биологическими макромолекулами, присутствующими во всех организмах. Они представляют собой полимеры, образованные из 20 возможных аминокислот путем трансляции РНК. Белковые структуры имеют размеры от десятков до нескольких тысяч аминокислот. [1]
После трансляции белки складываются в определенные формы. Это не сделано химическими связями, но более слабыми силами, такими как водородные связи. Чтобы понять, как работают белки, часто необходимо обнаружить их трехмерную структуру. Для этого в биофизике используются такие методы, как рентгеновская кристаллография, ЯМР-спектроскопия и интерферометрия с двойной поляризацией.
Белок может переключаться с одной формы на другую, выполняя свою работу. Альтернативные состояния одного и того же белка называются конформациями.Например, фермент будет иметь по меньшей мере две конформации: одну с коэнзимом и одну без нее. Форма со своим коферментом будет иметь две конформации: одну с субстратом и одну без.
Существует четыре различных уровня структуры белка.
Первичная структура [изменить | изменить источник]
Белки — это молекулы, которые состоят из одной или нескольких цепей аминокислот. Каждый отдельный белок имеет определенный набор аминокислот в определенном порядке. Первичная структура относится к последовательности аминокислот одной полипептидной цепи от ее начала (N-конец) до ее конца (C-конец).Аминокислоты удерживаются вместе определенным типом ковалентной связи, известной как пептидная связь, которая образуется в процессе биосинтеза или трансляции белка.
Вторичная структура [изменить | изменить источник]
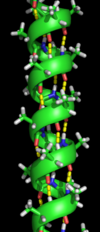 Альфа-спираль с водородными связями (желтые точки)
Альфа-спираль с водородными связями (желтые точки)Вторичная структура относится к частям белковой цепи, которые образуют регулярные структуры. Существует два основных типа вторичной структуры: альфа-спираль и бета-нить (бета-лист). Альфа-спирали — это спирали, которые вращаются по часовой стрелке, а бета-нити образуют бета-лист, где цепи лежат рядом друг с другом.Два типа вторичной структуры были предложены в 1951 году Линусом Полингом и его коллегами. [2] В отличие от полипептидной цепи, которая связана через ковалентные пептидные связи, вторичная структура образована водородными связями.
Третичная структура [изменить | изменить источник]
Это форма (пространственная организация) всей молекулы белка. Белковый фолдинг в значительной степени самоорганизуется. Это главным образом сделано первичной структурой белка — его последовательностью аминокислот. [3] Это называется догмой Анфинсена. [4] Однако среда, в которой синтезируется и складывается белок, также влияет на его окончательную форму.
Четвертичная структура [изменить | изменить источник]
Если белки построены из субъединиц, это дает другой уровень структуры. Это, четвертичная структура, то, как субъединицы соединяются вместе. Например, гемоглобин имеет две альфа-цепи и две бета-цепи. И альфа-цепи, и бета-цепи кодируются кластером из шести или семи генов, которые обеспечивают код для различных версий молекулы. [5] [6]
- Образовательный портал: Белки IV: первичная, вторичная, третичная и четвертичная структура. [2]
Четыре типа белковой структуры
- Классы
- Класс 1 — 3
- Класс 4 — 5
- Класс 6 — 10
- Класс 11 — 12
- КОНКУРСЫ
- BBS
- 000000000000 Книги
- NCERT Книги для 5 класса
- NCERT Книги Класс 6
- NCERT Книги для 7 класса
- NCERT Книги для 8 класса
- NCERT Книги для 9 класса
- NCERT Книги для 10 класса
- NCERT Книги для 11 класса
- NCERT Книги для 12-го класса
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
- NCERT Exemplar Class 12 9000al Aggar
Agard Agard Agard Agard Agulis Class 12- Классы
- Решения RS Aggarwal класса 10
- Решения RS Aggarwal класса 11
- Решения RS Aggarwal класса 10 90 003 Решения RS Aggarwal Class 9
- Решения RS Aggarwal Class 8
- Решения RS Aggarwal Class 7
- Решения RS Aggarwal Class 6
- Решения RD Sharma
- Решения RD Sharma класса 9
- Решения RD Sharma Class 7 Решения RD Sharma Class 8
- Решения RD Sharma Class 9
- Решения RD Sharma Class 10
- Решения RD Sharma Class 11
- Решения RD Sharma Class 12
- ФИЗИКА
- Механика
- 000000 Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- МАТС
- Теорема Пифагора
- Отношения и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убыток
- Полиномиальные уравнения
- Делительные дроби
- 000 ФОРМУЛЫ
- Математические формулы
- Алгебровые формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- S000
- S0003
- Pегипс Класс 6
- Образцы документов CBSE для класса 7
- Образцы документов CBSE для класса 8
- Образцы документов CBSE для класса 9
- Образцы документов CBSE для класса 10
- Образцы документов CBSE для класса 11
- Образец образца CBSE pers for Class 12
- CBSE Документ с вопросами о предыдущем году
- CBSE Документы за предыдущий год Class 10
- CBSE Вопросы за предыдущий год Class 12
- HC Verma Solutions
- HC Verma Solutions Класс 11 Физика
- Решения HC Verma Class 12 Physics
- Решения Lakhmir Singh
- Решения Lakhmir Singh Class 9
- Решения Lakhmir Singh Class 10
- Решения Lakhmir Singh Class 8
- Примечания
- CBSE
- Notes
- CBSE Класс 7 Примечания CBSE
- Класс 8 Примечания CBSE
- Класс 9 Примечания CBSE
- Класс 10 Примечания CBSE
- Класс 11 Примечания CBSE
- Класс 12 Примечания CBSE
- Дополнительные вопросы CBSE 8 класса
- Дополнительные вопросы CBSE 8 по естественным наукам
- CBSE 9 класса Дополнительные вопросы
- CBSE 9 дополнительных вопросов по науке CBSE 9000 Класс 10 Дополнительные вопросы по математике
- Класс 3
- Класс 4
- Класс 5
- Класс 6
- Класс 7
- Класс 8
- Класс 9
- Класс 10
- Класс 11
- Класс 12
- Решения NCERT для класса 11
- Решения NCERT для физики класса 11
- Решения NCERT для класса 11 Химия Решения для класса 11 Биология
- NCERT Solutions для Класс 12 Физика
- Решения NCERT для 12 класса Химия
- Решения NCERT для 12 класса Биология
- Решения NCERT для 12 класса Математика
- Решения NCERT Класс 12 Бухгалтерский учет
- Решения NCERT Класс 12 Бизнес исследования
- Решения NCERT Класс 12 Экономика
- NCERT Solutions Class 12 Бухгалтерский учет Часть 1
- NCERT Solutions Class 12 Бухгалтерский учет Часть 2
- NCERT Solutions Class 12 Микроэкономика
- NCERT Solutions Class 12 Коммерция
- NCERT Solutions Class 12 Макроэкономика
- Решения NCERT для класса 4 Maths
- Решения NCERT для класса 4 EVS
- Решения NCERT для класса 5 Ma
СТРУКТУРА БЕЛКОВ На этой странице объясняется, как аминокислоты объединяются в белки и что понимают под первичной, вторичной и третичной структурами белков. Четвертичная структура не покрыта. Это относится только к белкам, состоящим из более чем одной полипептидной цепи. В учебном плане по химии IB есть упоминание о четвертичной структуре, но не о других учебных программах в Великобритании на этом уровне. | |
Примечание: Четвертичная структура может быть очень сложной, и я не знаю точно, какую глубину учебная программа IB хочет для этого (вот почему я ее не включил). Я подозреваю, что разыскивается довольно тривиально. Студенты IB должны спросить совета у своего учителя или лектора. | |
Первичная структура белков Рисование аминокислот В химии, если бы вы нарисовали структуру общей 2-аминокислоты, вы бы, вероятно, нарисовали ее так: Однако, чтобы нарисовать структуры белков, мы обычно скручиваем их так, что группа «R» торчит сбоку.Гораздо легче увидеть, что происходит, если вы это сделаете. Это означает, что две самые простые аминокислоты, глицин и аланин, будут показаны как: Пептиды и полипептиды Глицин и аланин могут сочетаться с удалением молекулы воды с образованием дипептида . Это может произойти одним из двух разных способов — поэтому вы можете получить два разных дипептида. Либо: или: В каждом случае связь, показанная синим цветом в структуре дипептида, известна как , , пептидная связь, , . В химии это также называется амидной связью, но, поскольку мы сейчас находимся в области биохимии и биологии, мы будем использовать их термины. Если бы вы объединили три аминокислоты, вы бы получили трипептид. Если вы объединили много и много вместе (как в цепочке белков), вы получите полипептид . Белковая цепь будет иметь где-то в диапазоне от 50 до 2000 аминокислотных остатков . Вы должны использовать этот термин, потому что, строго говоря, пептидная цепь не состоит из аминокислот. Когда аминокислоты соединяются вместе, молекула воды теряется. Пептидная цепь состоит из того, что осталось после потери воды — другими словами, она состоит из аминокислотных остатков и . По соглашению, когда вы рисуете пептидные цепи, группа -NH 2 , которая не была преобразована в пептидную связь, записывается на левом конце.Неизменная группа -COOH записана в правом конце. Конец пептидной цепи с группой -NH 2 известен как N-конец , а конец с группой -COOH является C-конец . Белковая цепь (с N-концом слева) будет выглядеть следующим образом: «R» группы происходят из 20 аминокислот, которые содержатся в белках.Пептидная цепь известна как основной цепи , а группы «R» известны как боковых цепей . | |
Примечание: В случае, когда группа «R» происходит от аминокислотного пролина, картина нарушается. В этом случае водород в азоте, ближайшем к группе «R», отсутствует, а группа «R» зацикливается и присоединяется к этому азоту, а также к атому углерода в цепи. Я упоминаю это для полноты — , а не , потому что вы должны были бы знать об этом в химии на этом вводном уровне. | |
Первичная структура белков Теперь есть проблема! Термин «первичная структура» используется двумя различными способами. В самом простом смысле этот термин используется для описания порядка аминокислот, соединенных вместе для образования белка. Другими словами, если вы замените группы «R» на последней диаграмме реальными группами, у вас будет первичная структура определенного белка. Эта первичная структура обычно показана с использованием сокращений для аминокислотных остатков.Эти сокращения обычно состоят из трех букв или одной буквы. Используя трехбуквенные сокращения, часть цепочки белка может быть представлена, например: Если вы посмотрите внимательно, вы найдете аббревиатуры для глицина (Gly) и аланина (Ala) среди других. Если бы вы следовали по цепочке белков до ее левого конца, вы бы обнаружили аминокислотный остаток с неприсоединенной группой -NH 2 . N-конец всегда пишется слева от диаграммы для первичной структуры белка — независимо от того, используете ли вы его полностью или используете эти сокращения. Более широкое определение первичной структуры включает все признаки белка, которые являются результатом ковалентных связей. Очевидно, что все пептидные связи состоят из ковалентных связей, так что это не проблема. Но есть еще одна особенность белков, которая также ковалентно связана. Он включает в себя аминокислоту цистеин. Если две боковые цепи цистеина оказываются рядом друг с другом из-за складывания в пептидной цепи, они могут реагировать с образованием серного мостика .Это еще одно ковалентное звено, поэтому некоторые люди считают его частью первичной структуры белка. Из-за того, как серные мостики влияют на сгиб белка, другие люди считают это частью третичной структуры (см. Ниже). Это, очевидно, потенциальный источник путаницы! | |
Важно: Вам необходимо знать, где ваши конкретные эксперты будут включать серные мосты — как часть первичной структуры или как часть третичной структуры.Вы должны проверить свой текущий учебный план и прошлые документы. Если вы изучаете программу обучения в Великобритании и не получили ее, перейдите по этой ссылке, чтобы узнать, как ее получить. | |
Вторичная структура белков В длинных белковых цепях есть области, в которых цепи организованы в регулярные структуры, известные как альфа-спирали (альфа-спирали) и бета-складчатые листы. Это вторичные структуры в белках. Эти вторичные структуры удерживаются вместе водородными связями. Они формируются, как показано на диаграмме между одной из неподеленных пар на атоме кислорода и водородом, присоединенным к атому азота: Хотя водородные связи всегда находятся между группами C = O и H-N, точная картина их различна для альфа-спирали и листа с бета-складками. Когда вы дойдете до них ниже, потратьте некоторое время, чтобы убедиться, что вы видите, как работают два разных механизма. | |
Важно: Если вы недовольны водородными связями и не знаете, что означает эта диаграмма, перейдите по этой ссылке, прежде чем продолжить.То, что следует, достаточно сложно визуализировать, не беспокоясь о водородных связях! Вы также должны точно узнать, сколько деталей вам нужно знать об этом следующем бите. Вполне может быть, что все, что вам нужно, это услышать об альфа-спирали и знать, что он удерживается водородными связями между группами C = O и N-H. Еще раз, вам нужно проверить свой учебный план и прошлые документы — особенно пометить схемы для предыдущих документов. Если вы перейдете по любой из этих ссылок, используйте кнопку НАЗАД в вашем браузере, чтобы вернуться на эту страницу. | |
Альфа-спираль В альфа-спирали белковая цепь намотана, как слабо свернутая пружина. «Альфа» означает, что если вы посмотрите вниз на длину пружины, то наматывание происходит по часовой стрелке, когда она отходит от вас. | |
Примечание: Если ваше визуальное воображение столь же безнадежно, как и мое, единственный способ по-настоящему понять это — взять кусочек проволоки и свернуть его в пружинную форму.Подойдет немного компьютерного лидерства. По правде говоря, если вы студент химии, вам вряд ли понадобится это знать. Если вторичная структура белка находится в вашей учебной программе, ваши экзаменаторы, скорее всего, только захотят, чтобы вы знали, как структуры скрепляются водородной связью. Проверьте прошлые бумаги, чтобы быть уверенным. Если вы читаете это как студент, изучающий биохимию или биологию, и у вас есть какой-то другой способ распознавания альфа-спирали, придерживайтесь любого метода, который вам дали. | |
Следующая диаграмма показывает, как альфа-спираль удерживается вместе водородными связями. Это очень упрощенная диаграмма, в которой пропущено множество атомов. Мы обсудим это более подробно после того, как вы на это взгляните. Что не так с диаграммой? Две вещи: Прежде всего, показаны только атомы на частях катушек, обращенных к вам. Если вы попытаетесь показать все атомы, все становится настолько сложным, что практически невозможно понять, что происходит. Во-вторых, я не предпринял никаких попыток установить правильные углы связи. Я намеренно нарисовал все связи в основной цепи, как будто они лежат вдоль спирали. По правде говоря, они торчат повсюду. Опять же, если вы нарисуете это правильно, спираль практически невозможно увидеть. Итак, что вам нужно заметить? Обратите внимание, что все группы «R» торчат из основной спирали вбок. Обратите внимание на правильное расположение водородных связей.Все группы N-H направлены вверх, а все группы C = O направлены вниз. Каждый из них участвует в водородной связи. И, наконец, хотя вы не можете видеть это на этой неполной диаграмме, каждый полный оборот спирали содержит 3,6 (приблизительно) аминокислотных остатка. Если бы у вас было целое число аминокислотных остатков за ход, каждая группа имела бы идентичную группу под ней на ходу ниже. Водородная связь не может происходить при таких обстоятельствах. Каждый ход имеет 3 полных аминокислотных остатка и два атома из следующего. Это означает, что каждый поворот смещен относительно тех, что выше и ниже, так что группы N-H и C = O приведены в соответствие друг с другом. Бета-плиссированные листы В бета-плиссированном листе цепи сложены так, что они лежат рядом друг с другом. Следующая диаграмма показывает так называемый «антипараллельный» лист. Все это означает, что соседние цепи движутся в противоположных направлениях.Учитывая то, как именно происходит это свертывание, это кажется неизбежным. На самом деле это не неизбежно! Можно сделать более сложное складывание, чтобы соседние цепи действительно двигались в одном направлении. Сейчас мы выходим за рамки требований химии уровня Великобритании (и ее эквивалентов). Сложенные цепи снова удерживаются вместе водородными связями, включающими точно такие же группы, что и в альфа-спирали. | |
Примечание: Обратите внимание, что нет причин, по которым эти листы должны быть изготовлены из четырех частей сложенной цепи рядом друг с другом, как показано на этой диаграмме.Это был произвольный выбор, который дал диаграмму, которая хорошо вписалась в экран! | |
Третичная структура белков Что такое третичная структура? Третичная структура белка — это описание того, как вся цепь (включая вторичные структуры) складывается в свою окончательную трехмерную форму. Это часто упрощается в модели, подобные следующей для фермента дигидрофолатредуктазы.Ферменты, конечно же, основаны на белках. | |
Примечание: Эта диаграмма была получена из банка данных белка RCSB. Если вы хотите найти больше информации о дигидрофолатредуктазе, их ссылочный номер для нее — 7DFR. В этом ферменте нет ничего особенного с точки зрения структуры. Я выбрал его, потому что он содержал только одну белковую цепь и имел примеры обоих типов вторичной структуры. | |
Модель демонстрирует альфа-спирали во вторичной структуре в виде витков «ленты». Листы с бета-складками показаны как плоские кусочки ленты, оканчивающиеся наконечником стрелки. Кусочки белковой цепи, которые представляют собой просто случайные витки и петли, показаны как кусочки «струны». Цветовое кодирование в модели помогает вам проследить путь вокруг структуры — пройти через спектр от темно-синего до красного цвета. Вы также заметите, что эта конкретная модель имеет две другие молекулы, связанные с ней (показаны как обычные молекулярные модели).Это две молекулы, чья реакция этого фермента катализирует. Что удерживает белок в его третичной структуре? Третичная структура белка удерживается за счет взаимодействия между боковыми цепями — группами «R». Это может произойти несколькими способами. Ионные взаимодействия Некоторые аминокислоты (такие как аспарагиновая кислота и глутаминовая кислота) содержат дополнительную группу -COOH. Некоторые аминокислоты (такие как лизин) содержат дополнительную группу -NH 2 . Можно получить перенос иона водорода из группы -COOH в группу -NH 2 с образованием цвиттерионов, как в простых аминокислотах. Очевидно, вы могли бы получить ионную связь между отрицательной и положительной группами, если бы цепочки складывались так, чтобы они были близко друг к другу. Водородные связи Обратите внимание, что сейчас мы говорим о водородных связях между боковыми группами, а не между группами на самом деле в основной цепи. Многие аминокислоты содержат группы в боковых цепях, в которых атом водорода связан с атомом кислорода или азота. Это классическая ситуация, когда может возникнуть водородная связь. Например, аминокислотный серин содержит группу -ОН в боковой цепи. Вы можете установить водородную связь между двумя остатками серина в разных частях сложенной цепи. Можно легко представить себе подобные водородные связи, включающие группы -ОН, или группы -COOH, или группы -CONH 2 , или группы -NH 2 в различных комбинациях, хотя вам следует помнить, что -COOH группа и группа -NH 2 будут образовывать цвиттерион и производить более сильную ионную связь вместо водородных связей. Ван-дер-Ваальса дисперсионные силы Некоторые аминокислоты имеют довольно большие углеводородные группы в своих боковых цепях. Несколько примеров показаны ниже. Временные флуктуирующие диполи в одной из этих групп могут вызвать противоположные диполи в другой группе на соседней свернутой цепи. Установленных дисперсионных сил будет достаточно, чтобы скрепить сложенную конструкцию. | |
Важно: Если вы недовольны дисперсионными силами Ван-дер-Ваальса, перейдите по этой ссылке. Используйте кнопку НАЗАД в вашем браузере, чтобы вернуться на эту страницу. | |
Серные мосты Серные мостики, которые образуются между двумя остатками цистеина, уже обсуждались в первичных структурах. Где бы вы ни решили разместить их, это никак не повлияет на их формирование!
© Джим Кларк 2004 (последняя редакция ноябрь 2016) | |
белка | Определение, структура и классификация
Белок , очень сложное вещество, присутствующее во всех живых организмах. Белки имеют большую пищевую ценность и принимают непосредственное участие в химических процессах, необходимых для жизни. Важность белков была признана химиками в начале 19-го века, в том числе шведским химиком Йенсом Якобом Берцелиусом, который в 1838 году придумал термин белок , слово, производное от греческого prōteios , что означает «занимать первое место».«Белки являются видоспецифичными; белки одного вида отличаются от белков другого вида. Они также специфичны для органов; Например, в одном организме мышечные белки отличаются от белков мозга и печени.
синтез белка Синтез белка. Encyclopædia Britannica, Inc.Популярные вопросы
Что такое белок?
Белок представляет собой встречающееся в природе чрезвычайно сложное вещество, состоящее из аминокислотных остатков, соединенных пептидными связями.Белки присутствуют во всех живых организмах и включают многие важные биологические соединения, такие как ферменты, гормоны и антитела.
Где происходит синтез белка?
Где хранится белок?
Белки не хранятся для дальнейшего использования у животных. Когда животное потребляет избыточные белки, они превращаются в жиры (глюкоза или триглицериды) и используются для снабжения энергией или создания энергетических резервов. Если животное не потребляет достаточного количества белка, организм начинает разрушать богатые белком ткани, такие как мышцы, что приводит к истощению мышц и в конечном итоге к смерти, если дефицит серьезный.
Что делают белки?
Белки необходимы для жизни и необходимы для широкого спектра клеточной деятельности. Белковые ферменты катализируют подавляющее большинство химических реакций, которые происходят в клетке. Белки обеспечивают многие структурные элементы клетки, и они помогают связывать клетки вместе в ткани. Белки в форме антител защищают животных от болезней, и многие гормоны являются белками. Белки контролируют активность генов и регулируют экспрессию генов.
Молекула белка очень велика по сравнению с молекулами сахара или соли и состоит из множества аминокислот, соединенных вместе для образования длинных цепей, подобно тому, как шарики расположены на веревочке. Есть около 20 различных аминокислот, которые встречаются в природе в белках. Белки схожей функции имеют сходный аминокислотный состав и последовательность. Хотя до сих пор невозможно объяснить все функции белка по его аминокислотной последовательности, установленные корреляции между структурой и функцией можно объяснить свойствами аминокислот, составляющих белки.
пептид Молекулярная структура пептида (небольшой белок) состоит из последовательности аминокислот. © raimund14 / FotoliaРастения могут синтезировать все аминокислоты; животные не могут, хотя все они необходимы для жизни. Растения могут расти в среде, содержащей неорганические питательные вещества, которые обеспечивают азот, калий и другие вещества, необходимые для роста. Они используют углекислый газ в воздухе во время процесса фотосинтеза с образованием органических соединений, таких как углеводы.Животные, однако, должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений низкое, животным требуются очень большие количества растительного материала, такие как жвачные животные (например, коровы), которые едят только растительный материал, чтобы удовлетворить свои потребности в аминокислотах. Животные, не являющиеся жвачными, включая людей, получают белки главным образом от животных и их продуктов, например мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой пищи, богатой белками ( см. питание человека).
бобовых; аминокислота Бобовые, такие как бобы, чечевица и горох, содержат много белка и содержат много незаменимых аминокислот. © Elenathewise / FotoliaСодержание белка в органах животных обычно намного выше, чем в плазме крови. Мышцы, например, содержат около 30 процентов белка, печень — от 20 до 30 процентов, а эритроциты — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных намного меньше, чем количество белка; белковые молекулы образуются в клетках путем ступенчатого выравнивания аминокислот и высвобождаются в жидкости организма только после завершения синтеза.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодняВысокое содержание белка в некоторых органах не означает, что важность белков связана с их количеством в организме или ткани; напротив, некоторые из наиболее важных белков, таких как ферменты и гормоны, встречаются в очень небольших количествах. Важность белков связана главным образом с их функцией. Все идентифицированные до настоящего времени ферменты являются белками. Ферменты, которые являются катализаторами всех метаболических реакций, позволяют организму накапливать химические вещества, необходимые для жизни — белки, нуклеиновые кислоты, углеводы и липиды — чтобы превращать их в другие вещества и разлагать их.Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регуляторными функциями. У всех позвоночных гемоглобин дыхательного белка действует как переносчик кислорода в крови, транспортируя кислород из легких в органы и ткани организма. Большая группа структурных белков поддерживает и защищает структуру организма животного.
гемоглобин Гемоглобин представляет собой белок, состоящий из четырех полипептидных цепей (α 1 , α 2 , β 1 и β 2 ).Каждая цепь присоединена к гемовой группе, состоящей из порфирина (органического кольцеобразного соединения), присоединенного к атому железа. Эти железо-порфириновые комплексы обратимо координируют молекулы кислорода, что напрямую связано с ролью гемоглобина в транспорте кислорода в крови. Encyclopædia Britannica, Inc. .
Добавить комментарий