Химические свойства белков | Химия онлайн
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:

При действии же кислот он выступает в форме катиона:
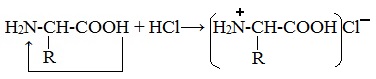
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи
.Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»

3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
5. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.


Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.



Причина появления окраски – образование комплексных соединений с координационным узлом: 
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)


Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Белки
Белки | Химия онлайн
«Жизнь, есть способ существования белковых тел…»
Ф. Энгельс
Белки (протеины, полипептиды) — биополимеры, построенные из остатков α-аминокислот, соединенных пептидными (амидными) связями.
Белки – это сложные высокомолекулярные природные соединения (биополимеры), макромолекулы которых состоят из остатков α-аминокислот, соединенных пептидными (амидными) связями -СО-NН- .
Белки (полипептиды) представляют собой высокомолекулярные органические вещества, состоящие из одной или нескольких длинных цепей аминокислотных остатков (α-аминокислот), соединённых в цепочку пептидной связью.
Белки – важнейшая составная часть пищи человека, отсутствие или недостаток их в пище может вызвать серьезные заболевания. Суточная потребность в белках для взрослого человека в среднем составляет 60-70 гр. в день.
Важно знать!
Исключительно важную роль играет сбалансированность питания человека по аминокислотам. При недостатке незаменимых аминокислот в пище организм саморазрушается. При этом страдает в первую очередь головной мозг, что приводит к различным заболеваниям центральной нервной системы, психическим расстройствам. Особенно уязвим молодой растущий организм.
Так, например, при нарушении синтеза тирозина из фенилаланина у детей развивается тяжелое заболевание финилпировиноградная олигофрения, вызывающее тяжелую умственную отсталость или гибель ребенка.
Белки — важнейший класс биологически активных веществ. Без белков невозможно представить себе жизнь. Они занимают первое место среди макромолекул не случайно, ведь там где есть белки, отмечены признаки жизни и, наоборот, там, где есть жизнь, обнаруживаются белки.
Белки чрезвычайно разнообразны по структуре и выполняют многочисленные биологические функции. Существуют многие миллиарды химически индивидуальных белков.

Количество белков характеризует степень сложности организма (кишечная палочка – 3000, а в человеческом организме более 5 млн. белков).
В количественном отношении они занимают первое место среди всех содержащихся в живой клетке макромолекул.
В организме человека белки составляют примерно 1/5 часть, или 20 % массы, а в пересчете на сухой вес — 45%.
Содержание белков в разных тканях различно: около 30% всех белков человеческого тела находится в мышцах, в печени содержится до 22 % белка, в мозге — 11 %, в жировой ткани – 6 %, около 20% — в костях и сухожилиях и около 10% — в коже.
Свое название белки получили от белого цвета куриного яйца, на примере которого изучались их свойства. В 1838 г. Н. Мульдер назвал белки протеинами (от греч. protos — первый, важный). Это же название принято в международной номенклатуре.
Видеофильм «Белки»
История открытия белков
Основные источники белка
Строение белков
Функции белков в организме
Классификация белков
Уровни организации белков
Физические свойства белков
Химические свойства белков
Превращение белков в организме
Проблема определения структуры белков. Синтез белков
Значение белков в организме человека
| 1. |
Формула аминокислоты
Сложность: лёгкое |
1 |
| 2. |
Функциональные группы аминокислот
Сложность: лёгкое |
1 |
| 3. |
Функции белков
|
1 |
| 4. |
Строение и химические свойства аминокислот
Сложность: среднее |
2 |
| 5. |
Строение и свойства белков
Сложность: среднее |
2 |
| 6. |
Термины по теме «Белки»
Сложность: среднее |
2 |
| 7. |
Реакции белков
Сложность: среднее |
2 |
| 8. |
Сравнение белков и жиров
Сложность: среднее |
2 |
| 9. |
Цветные реакции белков
Сложность: среднее |
2 |
Строение белков | Химия онлайн
Каждый белок имеет свое специфическое (индивидуальное и постоянное) строение.
Молекулы белков имеют большие размеры, поэтому их называют макромолекулами. Кроме углерода, кислорода, водорода и азота, в состав белков могут входить сера, фосфор и железо.
Белки отличаются друг от друга числом (от ста до нескольких тысяч), составом и последовательностью мономеров. Мономерами белков являются аминокислоты.
Бесконечное разнообразие белков создается за счет различного сочетания всего 20 α-аминокислот. Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде:
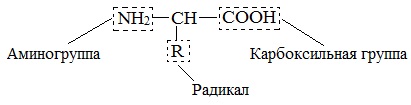
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (-NH2) с основными свойствами, другая — карбоксильной группой (-COOH) с кислотными свойствами. Часть молекулы, называемая радикалом (R ), у разных аминокислот имеет различное строение.
Наличие в одной молекуле аминокислоты основной и кислотной групп обусловливает их амфотерность и высокую реакционную способность. Через эти группы происходит соединение аминокислот в белки.
В белках α-аминокислоты соединены между собой пептидными (амидными) связями (-NH-CO-) в пептидные цепи. Образование пептидных связей происходит в результате взаимодействия карбоксила одной аминокислоты с аминогруппой другой.
Образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот. При взаимодействии двух молекул a-аминокислот образуется дипептид и выделяется молекула воды.

В искусственных условиях (вне организма) две различных аминокислоты могут образовать 4 изомерных дипептида. Например, из глицила и аланина можно получить дипептиды: глицилаланин, аланилглицин, аланилаланин, глицилглицин.
У образовавшегося дипептида на концах молекулы остаются те же функциональные группы, что и в каждой аминокислоте, — карбоксил и аминогруппа. Поэтому дипептид может реагировать с третьей аминокислотой, образуя трипептид.

Аналогично происходит образование тетра- , пента- и полипептидов.
Все белки являются полипептидами, но не всякий полипептид является белком. Некоторые белки состоят из нескольких полипептидных цепей.
В составе большинства белков находится в среднем 300-500 остатков аминокислот.
Условно считают, что к белкам относятся полипептиды, содержащие в полипептидной цепи более 100 аминокислотных остатков. Соединения с меньшим числом аминокислотных остатков называются пептидами.
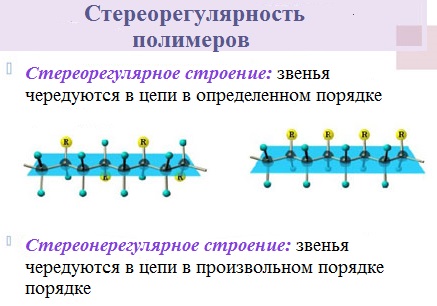
Макромолекулы белков имеют стеререгулярное строение, исключительно важное для проявления ими определенных биологических свойств.
 Белки
Белки


Добавить комментарий