Белки мембран
Если основная роль липидов в составе мембран заключается в стабилизации бислоя, то белки отвечают за функциональную активность мембран. Одни из них обеспечивают транспорт определённых молекул и ионов, другие являются ферментами, третьи участвуют в связывании цитоскелета с внеклеточным матриксом или служат рецепторами для гормонов, медиаторов,
эйкозаноидов, липопротеинов, оксида азота (N0). На долю белков приходится от 30 до 70% массы мембран. Белки определяют особенности функционирования каждой мембраны.
Особенности строения
и локализации белков в мембранах
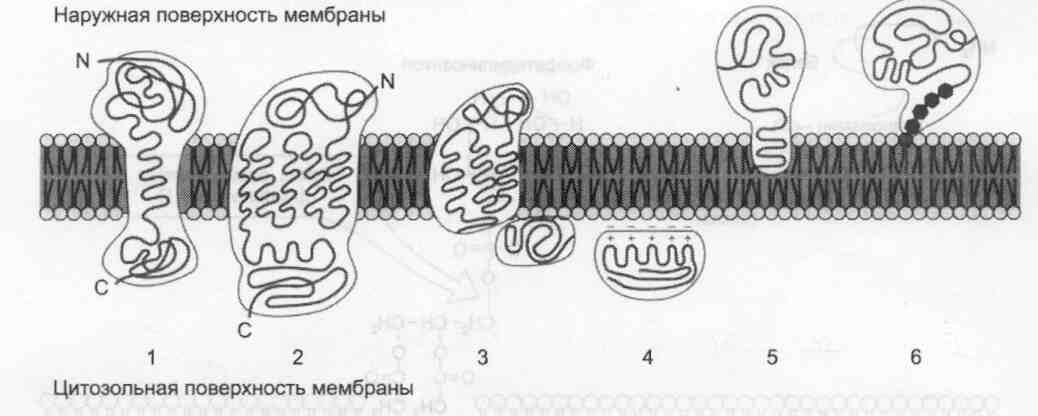
Локализация белков в мембранах. Трансмембранные белки, например: 1 — гликофорин А; 2 — рецептор адреналина. Поверхностные белки: 3 — белки, связанные с интегральными белками, например, фермент сукцинатдегидрогеназа; 4 — белки, присоединенные к полярным «головкам» липидного слоя, например, протеинкинаэа С; 5 — белки, -заякоренные» в мембране с помощью короткого гидрофобного концевого домена, например, цитохрои b5;6 — «заякоренные» белки, ковалентно соединённые с пипидом мембраны (например, фермент щелочная фосфатаза).
Белки мембран различаются по своему положению в мембране. Они могут глубоко проникать в липидный бислой или даже пронизывать его — интегральные белки, либо разными способами прикрепляться к мембране — поверхностные белки.Поверхностные белки
Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральными
белками или поверхностными участками липидного слоя.
Белки, образующие комплексы с интегральными белками мембраны
Ряд пищеварительных ферментов, участвующих в гидролизе крахмала и белков, прикрепляется к интегральным белкам мембран микроворсинок кишечника.
Примерами таких комплексов могут быть сахараза-изомальтаза и мальтаза-гликоамилаза.
Белки, связанные с полярными «головками» липидов мембран
Полярные или заряженные домены белковой молекулы могут взаимодействовать с полярными «головками» липидов, образуя ионные и водородные связи. Кроме того, множество растворимых в цитозоле белков при определённых условиях могут связываться с поверхностью мембраны на непродолжительное время. Иногда связывание белка — необходимое условие проявления ферментативной активности. К таким белкам, например, относят протеинкиназу С, факторы свёртывания крови.
Закрепление с помощью мембранного «якоря»
«Якорем» может быть неполярный домен белка, построенный из аминокислот с гидро-
фобными радикалами. Примером такого белка может служить цитохром b5 мембраны ЭР. Этот белок участвует в окислительно-восстановительных реакциях, как переносчик электронов.
Роль мембранного «якоря» может выполнять также ковалентно связанный с белком остаток жирной кислоты (миристиновой — С14 или пальмитиновой — С16). Белки, связанные с жирными кислотами, локализованы в основном на внутренней поверхности плазматической мембраны. Миристиновая кислота присоединяется к N-концевому глицину с образованием амидной связи. Пальмитиновая кислота образует тиоэфирную связь с цистеином или слож-ноэфирную с остатками серина и треонина.
Небольшая группа белков может взаимодействовать с наружной поверхностью клетки с помощью ковалентно присоединённого к С-концу белка фосфатидилинозитолгликана. Этот «якорь» — часто единственное связующее звено между белком и мембраной, поэтому при действии фосфолипазы С этот белок отделяется от мембраны.
Трансмембранные (интегральные) белки
Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофорин), другие имеют несколько участков (доменов), последовательно пересекающих бислой.
Трансмембранные домены, пронизывающие бислой, имеют конформацию α -спирали. Полярные остатки аминокислот обращены внутрь глобулы, а неполярные контактируют с мембранными липидами. Такие белки называют «вывернутыми» по сравнению с растворимыми в воде белками, в которых большинство гидрофобных остатков аминокислот спрятано внутрь, а гидрофильные располагаются на поверхности.
Радикалы заряженных аминокислот в составе этих доменов лишены заряда и протониро-ваны (-СООН) или депротонированы (-NH2).
Гликозилированные белки
Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гликози-лированы. Олигосахаридные Остатки могут быть присоединены через амидную группу аспараги-на или гидроксильные группы серина и треонина.
Олигосахаридные остатки защищают белок от протеолиза, участвуют в узнавании лигандов или адгезии.
Латеральная диффузия белков
Некоторые мембранные белки перемещаются вдоль бислоя (латеральная диффузия) или поворачиваются вокруг оси, перпендикулярно его поверхности.
Латеральная диффузия интегральных белков в мембране ограничена, это связано с их большими размерами, взаимодействием с другими мембранными белками, элементами цитоскелета или внеклеточного матрикса.
Белки мембран не совершают перемещений с одной стороны мембраны на другую («флип-флоп» перескоки), подобно фосфолипидам.
Интегральные белки мембраны, их функции
Клеточная мембрана — структурный элемент клетки, ограждающий ее от внешней среды. При помощи нее она взаимодействует с межклеточным пространством и является частью биологической системы. Ее мембрана имеет особую структуру, состоящую из липидного бислоя, интегральных и полуинтегральных белков. Последние являются крупными молекулами, выполняющими различные функции. Чаще всего они участвуют в транспортировке специальных веществ, концентрация которых по разные стороны мембраны тщательно регулируется.

Общий план строения клеточной мембраны
Плазматическая мембрана — это совокупность молекул жиров и сложных белков. Ее фосфолипиды своими гидрофильными остатками располагаются по разные стороны мембраны, образуя липидный бислой. Но их гидрофобные участки, состоящие из остатков жирных кислот, обращены внутрь. Это позволяет создать текучую жидко-кристаллическую структуру, которая постоянно может менять форму и находится в динамическом равновесии.

Такая особенность строения позволяет ограничить клетку от межклеточного пространства, потому мембрана в норме непроницаема для воды и всех растворенных в ней веществ. В толщу мембраны погружены некоторые сложные интегральные белки, полуинтегральные и поверхностные молекулы. Посредством их клетка взаимодействует с окружающим миром, поддерживая гомеостаз и образуя целостные биологические ткани.
Белки плазматической мембраны
Все белковые молекулы, которые расположены на поверхности или в толще плазматической мембраны, делятся на виды в зависимости от глубины их залегания. Выделяют интегральные белки, пронизывающие липидный бислой, полуинтегральные, которые берут свое начало в гидрофильном участке мембраны и выходят наружу, а также поверхностные — расположенные на внешней площади мембраны. Интегральные белковые молекулы особым образом пронизывают плазмолемму и могут быть соединены с рецепторными аппаратом. Многие такие молекулы пронизывают всю мембрану и носят название трансмембранных. Остальные заякорены в гидрофобном участке мембраны и выходят либо на внутреннюю, либо на внешнюю поверхность.

Ионные каналы клетки
Чаще всего в качестве интегральных сложных белков выступают ионные каналы. Эти структуры ответственны за активный транспорт некоторых веществ в клетку или из нее. Они состоят из нескольких белковых субъединиц и активного центра. При воздействии определенного лиганда на активный центр, представленный специфическим набором аминокислот, происходит смена конформации ионного канала. Такой процесс позволяет открыть или закрыть канал, тем самым запускать или прекращать активный транспорт веществ.

Некоторые ионные канала большую часть времени открыты, однако при поступлении сигнала от рецепторного белка или при присоединении специфического лиганда могут закрываться, прекращая ионный ток. Этот принцип работы сводится к тому, что пока не получен рецепторный или гуморальный сигнал на прекращение активного транспорта некого вещества, он будет осуществляться. Как только сигнал поступил, транспорт следует прекратить.
Большая часть интегральных белков, выполняющих функции ионных каналов, работают на запрет транспорта, пока к активному центру не присоединится специфический лиганд. Тогда произойдет активация транспорта ионов, что позволит перезарядить мембрану. Данный алгоритм работы ионных каналов характерен для клеток возбудимых тканей человека.
Типы встроенных белков
Все мембранные белки (интегральные, полуинтегральные и поверхностные) выполняют важные функции. Именно из-за особой роли в жизнедеятельности клетки они и имеют определенный тип встроенности в фосфолипидную мембрану. Некоторые белки, чаще это ионные каналы, для реализации своих функций должны полностью пресекать плазмолемму. Тогда их называют политопическими, то есть трансмембранными. Другие же локализованы своим якорным участком в гидрофобном участке фосфолипидного бислоя, а активным центром выходят только на внутреннюю или только на внешнюю поверхность клеточной мембраны. Тогда их называют монотопическими. Чаще они являются рецепторными молекулами, которые принимают сигнал с поверхности мембраны и передают его специальному «посреднику».

Обновление интегральных белков
Все интегральные молекулы полностью пронизывают гидрофобный участок и закрепляются в нем таким образом, что допускается их перемещение только вдоль мембраны. Однако западение белка внутрь клетки, ровно как и самопроизвольный отрыв белковой молекулы от цитолеммы, невозможны. Существует вариант, при котором интегральные белки мембраны попадут в цитоплазму. Он связан с пиноцитозом или фагоцитозом, то есть когда клетка захватывает твердое тело или жидкость и окружает его мембраной. Затем она втаскивается внутрь вместе с встроенными в нее белками.
Конечно, это не самый эффективный способ обмена энергией в клетке, потому как все белки, которые ранее выполняли функции рецепторов или ионных каналов, будут переварены лизосомой. Это потребует их нового синтеза, на что потратится значимая часть энергетических запасов макроэргов. Однако в ходе «эксплуатации» молекулы ионных каналов или рецепторы часто повреждаются, вплоть до отрыва участков молекулы. Это также требует их повторного синтеза. Потому фагоцитоз, пусть он и происходит с расщеплением собственных рецепторных молекул, является еще и способом их постоянного обновления.
Гидрофобное взаимодействие интегральных белков
Как было описано выше, интегральные белки мембраны являются сложными молекулами, которые будто застревают в цитоплазматической мембране. В то же время они могут свободно плавать в ней, перемещаясь вдоль плазмолеммы, но не могут оторваться от нее и попасть в межклеточное пространство. Реализуется это за счет особенностей гидрофобного взаимодействия интегральных белков с фосфолипидами мембраны.
Активные центры интегральных белков располагаются либо на внутренней, либо на внешней поверхности липидного бислоя. А тот фрагмент макромолекулы, который отвечает за плотную фиксацию, всегда располагается среди гидрофобных участков фосфолипидов. За счет взаимодействия с ними все трансмембранные белки всегда остаются в толще клеточной оболочки.
Функции интегральных макромолекул
Любой интегральный мембранный белок имеет якорный участок, расположенный среди гидрофобных остатков фосфолипидов, и активный центр. У некоторых молекул активный центр один и располагается на внутренней или наружной поверхности мембраны. Существуют также молекулы с несколькими активными центрами. Все это зависит от функций, которые выполняют интегральные и периферические белки. Первая их функция — это активный транспорт.
Белковые макромолекулы, которые отвечают за пропуск ионов, состоят из нескольких субъединиц и регулируют ионный ток. В норме плазматическая мембрана не может пропускать гидратированные ионы, так как по своей природе является липидом. Наличие ионных каналов, которыми являются интегральные белки, позволяет ионам проникать в цитоплазму и перезаряжать клеточную мембрану. Это является основным механизмом возникновения мембранного потенциала клеток возбудимых тканей.
Рецепторные молекулы
Вторая функция интегральных молекул — это рецепторная. Один липидный бислой мембраны реализует защитную функцию и полностью ограничивает клетку от внешней среды. Однако за счет наличия рецепторных молекул, которые представлены интегральными белками, клетка может получать сигналы от окружающей среды и взаимодействовать с ней. Примером является адреналовый рецептор кардиомиоцита, белок клеточной адгезии, инсулиновый рецептор. Особым примером рецепторного белка является бактериородопсин — особый мембранный белок, который имеется у некоторых бактерий, позволяя им реагировать на освещение.

Белки межклеточного взаимодействия
Третья группа функций интегральных белков — это реализация межклеточных контактов. Благодаря им одна клетка может присоединиться к другой, создавая этим цепь передачи информации. По такому механизму работают нексусы — щелевые контакты между кардиомиоцитами, по которым передается сердечный ритм. Такой же принцип работы наблюдается и у синапсов, по которым в нервных тканях передается импульс.
Посредством интегральных белков клетки могут создавать и механическую связь, что имеет важность при образовании целостной биологической ткани. Также интегральные белки могут играть роль мембранных ферментов и участвовать в передаче энергии, в том числе и нервных импульсов.
151. Белки мембран — интегральные, поверхностные, «заякоренные». Значение посттрансляционных модификаций в образовании функциональных мембранных белков.
Мембранные белки, контактирующие с гидрофобной частью липидного бислоя, должны быть амфифильными. Те участки белка, которые взаимодействуют с углеводородными цепями жирных кислот, содержат преимущественно неполярные аминокислоты. Участки белка, находящиеся в области полярных «головок», обогащены гидрофильными аминокислотными остатками. Белки мембран различаются по своему положению в мембране. Они могут глубоко проникать в липидный бислой или даже пронизывать его — интегральные белки, либо разными способами прикрепляться к мембране — поверхностные белки.Поверхностные белки. Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральными белками или поверхностными участками липидного слоя.
Белки, образующие комплексы с интегральными белками мембраны. Ряд пищеварительных ферментов, участвующих в гидролизе крахмала и белков, прикрепляется к интегральным белкам мембран микроворсинок кишечника. Примерами таких комплексов могут быть са-хараза-изомальтаза и мальтаза-гликоамилаза. Возможно, связь этих пищеварительных ферментов с мембраной позволяет с высокой скоростью гидролизовать субстраты и усваивать продукты гидролиза клеткой.
Белки, связанные с полярными «головками» липидов мембран. Полярные или заряженные домены белковой молекулы могут взаимодействовать с полярными «головками» липидов, образуя ионные и водородные связи. Кроме того, множество растворимых в цитозоле белков при определённых условиях могут связываться с поверхностью мембраны на непродолжительное время. Иногда связывание белка — необходимое условие проявления ферментативной активности. К таким белкам, например, относят протеинкиназу С, факторы свёртывания крови.
Закрепление с помощью мембранного «якоря». «Якорем» может быть неполярный домен белка, построенный из аминокислот с гидрофобными радикалами. Примером такого белка может служить цитохром b 5 мембраны ЭР. Этот белок участвует в окислительно-восстановительных реакциях, как переносчик электронов Роль мембранного «якоря» может выполнять также ковалентно связанный с белком остаток жирной кислоты (миристиновой — С14 или пальмитиновой — С16). Белки, связанные с жирными кислотами, локализованы в основном на внутренней поверхности плазматической мембраны. Миристиновая кислота присоединяется к N-концевому глицину с образованием амидной связи. Пальмитиновая кислота образует тиоэфирную связь с цистеином или сложноэфирную с остатками серина и треонина. Небольшая группа белков может взаимодействовать с наружной поверхностью клетки с помощью ковалентно присоединённого к С-концу белка фосфатидилинозитолгликана. Этот «якорь» — часто единственное связующее звено между белком и мембраной, поэтому при действии фосфолипазы С этот белок отделяется от мембраны.
Гликозилированные белки. Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гликозилированы. Олигосахаридные остатки могут быть присоединены через амидную группу аспарагина или гидроксильные группы серина и треонина. Олигосахаридные остатки защищают белок от протеолиза, участвуют в узнавании лигандов или адгезии.
152. Механизмы переноса веществ через мембраны: простая диффузия, первично-активный транспорт (Nа+-К+-АТФаза, Са2+-АТФаза), пассивный симпорт и антипорт, вторично-активный транспорт.
Любая молекула может пройти через липидный бислой, однако скорость пассивной диффузии веществ, т.е. перехода вещества из области с большей концентрацией в область с меньшей, может сильно отличаться. Для некоторых молекул это занимает столь длительное время, что можно говорить об их практической непроницаемости для липидного бислоя мембраны. Скорость диффузии веществ через мембрану зависит главным образом от размера молекул и их относительной растворимости в жирах. Легче всего проходят простой диффузией
Первично-активный транспорт. Перенос некоторых неорганических ионов идёт против градиента концентрации при участии транспортных АТФ-аз (ионных насосов). Все ионные насосы одновременно служат ферментами, способными к аутофосфорилированию и аутодефосфорилированию. АТФ-азы различаются по ионной специфичности, количеству переносимых ионов, направлению транспорта. В результате функционирования АТФ-азы переносимые ионы накапливаются с одной стороны мембраны. Наиболее распространены в плазматической мембране клеток человека Ма+,К+-АТФ-аза, Са2+-АТФ-аза и Н+,К+,-АТФ-аза слизистой оболочки желудка.
Na+, К+-АТФ-аза. Этот фермент-переносчик катализирует АТФ-зависимый транспорт ионов Na+ и K+ через плазматическую мембрану. Ка+,К+-АТФ-аза состоит из субъединиц α и β; α — каталитическая большая субъединица, a β — малая субъединица (гликопротеин). Активная форма транслоказы — тетрамер (αβ)2. Na+,К+-АТФ-аза отвечает за поддержание высокой концентрации К+ в клетке и низкой концентрации Na+. Так как Na+Д+-АТФ-аза выкачивает три положительно заряженных иона, а закачивает два, то на мембране возникает электрический потенциал с отрицательным значением на внутренней части клетки по отношению к её наружной поверхности.
Са2+-АТФ-аза. В цитозоле «покоящихся» клеток концентрация Са2+ составляет ~10-7 моль/л, тогда как вне клетки она равна ~2 10-3 моль/л. Поддерживает такую разницу в концентрации система активного транспорта ионов кальция; ее основные компоненты — кальциевые насосы — Са2+-АТФ-азы и Na+,Ca2+-обменники. Са2+-АТФ-аза локализована не только в плазматической мембране, но и в мембране ЭР. Фермент состоит из десяти трансмембранных доменов, пронизывающих клеточную мембрану. Между вторым и третьим доменами находятся несколько остатков аспарагиновой кислоты, участвующих в связывании кальция. Область между четвёртым и пятым доменами имеет центр для присоединения АТФ и аутофосфорилирования по остатку аспарагиновой кислоты. Са2+-АТФ-азы плазматических мембран некоторых клеток регулируются белком кальмодулином. Каждая из Са2+-АТФ-аз плазматической мембраны и ЭР представлена несколькими изоформами.
Вторично-активный транспорт. Перенос некоторых растворимых веществ против градиента концентрации зависит от одновременного или последовательного переноса другого вещества по градиенту концентрации в том же направлении (активный симпорт) или в противоположном (активный антипорт). В клетках человека ионом, перенос которого происходит по градиенту концентрации, чаще всего служит Na+. Примером такого типа транспорта может служить Na+,Са2+-обменник плазматической мембраны (активный антипорт), ионы натрия по градиенту концентрации переносятся в клетку, а ионы Са2+против градиента концентрации выходят из клетки. По механизму активного симпорта происходят всасывание глюкозы клетками кишечника и реабсорбция из первичной мочи глюкозы, аминокислот клетками почек.
интегральные, поверхностные, заякоренные. — КиберПедия
глубоко проникать в липидный бислой или даже пронизывать его — интегральные белки Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофорин), другие имеют несколько участков (доменов), последовательно пересекающих бислой
Трансмембранные домены, пронизывающие бислой, имеют конформацию α-спирали. Полярные остатки аминокислот обращены внутрь глобулы,а неполярные контактируют с мембранными липидами. Такие белки называют «вывернутыми» по сравнению с растворимыми в воде белками, в которых большинство гидрофобных остатков аминокислот спрятано внутрь, а гидрофильные располагаются на поверхности
Радикалы заряженных аминокислот в составе этих доменов лишены заряда и протонированы (-СООН) или депротонированы (-NH2).
прикрепляться к мембране — поверхностные белки.
Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральными белками или поверхностными участками липидного слоя. Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гликозилированы. Олигосахаридные остатки могут быть присоединены через амидную группу аспарагина или гидроксильные группы серина и треонина
Закрепление с помощью мембранного «якоря»
«Якорем» может быть неполярный домен белка, построенный из аминокислот с гидрофобными радикалами. Примером такого белка может служить цитохром b5 мембраны ЭР. Этот белок участвует в окислительно-восстановительных реакциях, как переносчик электронов
Роль мембранного «якоря» может выполнять также ковалентно связанный с белком остаток жирной кислоты). Белки, связанные с жирными кислотами, локализованы в основном на внутренней поверхности плазматической мембраны. Миристиновая кислота присоединяется к N-концевому глицину с образованием амидной связи. Пальмитиновая кислота образует тиоэфирную связь с цистеином или сложноэфирную с остатками серина и треонина.
Небольшая группа белков может взаимодействовать с наружной поверхностью клетки с помощью ковалентно присоединённого к С-концу белка фосфатидилинозитолгликана. Этот «якорь» — часто единственное связующее звено между белком и мембраной, поэтому при действии фосфолипазы С этот белок отделяется от мембраны.
44.Механизмы переноса веществ через мембраны: простая диффузия, первично-активный транспорт ( Na-K-АТФаза, Са-АТФаза), пассивный симпорт и антипорт. Вторично-активный транспорт, регулируемые каналы (Са-канал эндоплазматического ретикулума).
Простая диффузия осуществляется за счет теплового движения молекул из зоны с большей концентрацией в зону с меньшей концентрацией. Разность концентраций по обе стороны мембраны называется градиентом концентраций. При переносе заряженных частиц важную роль играет разница потенциалов. Обычно внутри клетки накапливаются отрицательно заряженные частицы. Таким путем транспортируются: Н2О, СО2, О2. Перенос веществ простой диффузией прекращается когда концентрация вещества с одной и с другой стороны мембраны выравнивается.
первично-активный транспорт-перенос в-в против градиента концентрации с затратой энергии
NA-К-Атфаза-ответственна за одновременный перенос натрия наружу(3), калия внутрь(2)
кальций-атфаза-ответствена за перенос кальция наружу
Вторично-активный транспорт. Активный перенос вещества через мембрану может осуществляться за счет энергии градиента концентрации другого вещества. Переносчик в этом случае имеет специфические центры связывания для обоих веществ (Присоединение и отделение переносимого вещества вызывает изменения конформации переносчика, и соответственно — изменения сродства к переносимым веществам. Если концентрация вещества X снаружи больше, чем внутри, оно может перемещаться путем облегченной диффузии. Переносчик имеет центр связывания и для вещества Y, которое транспортируется попутно с веществом X (симпорт), причем вещество Y может транспортироваться против градиента своей концентрации. Сходным образом происходит и антипорт — перемещение вещества против градиента своей концентрации в направлении, противоположном перемещению другого вещества по его градиенту концентрации
Симпорт и антипорт могут происходить за счет энергии градиента концентрации ионов Na+, создаваемого Na,K-AT-Фазой. Таким способом происходит, например, всасывание аминокислот из кишечника и глюкозы из первичной мочи и кишечника . Следовательно, в этих случаях первичным источником энергии служит АТФ: сначала энергия гидролиза АТФ трансформируется в энергию трансмембранного градиента концентрации Na+, а затем энергия этого градиента используется для переноса аминокислот или глюкозы.
Открытие или закрытие селективных каналов регулируется либо изменением концентрации специфических регуляторов, таких как медиаторы, гормоны, циклические нуклеотиды, NO, G-белки, либо изменением трансмембранного электрохимического потенциала (рис. 5-14). Воздействие регуляторного фактора вызывает конформационные изменения каналообразующих белков, канал открывается и ионы проходят по градиенту концентрации. Транспорт веществ через каналы не приводит к конформационным изменениям белков и зависит только от разности концентраций веществ по обе стороны мембраны. Поэтому скорость транспорта веществ через такие каналы может достигать 106-108 ионов в секунду.
Интегральный мембранный белок — Википедия
Материал из Википедии — свободной энциклопедии
Интегральный мембранный белок (ИМБ, IMP или просто интегральный белок) — один из типов мембранных белков, которые прочно связаны с цитоплазматической мембраной (интегрированы). Они составляют значительную часть белков, закодированных в геноме любого организма[1]. Интегральные белки могут быть погружены в мембрану полностью, а иногда даже пронизывают её насквозь[2]. В этом смысле, все трансмембранные белки являются интегральными белками, но не все интегральные — трансмембранными. Связь интегральных белков с мембранными липидами очень прочна и определяется главным образом гидрофобными взаимодействиями.
Особенность интегральных белков — наличие в их полипептидной цепи довольно протяжённых участков с преобладающим содержанием неполярных аминокислот. Как правило, эти участки имеют конформацию α-спирали, на наружной стороне которой расположены боковые углеводородные фрагменты аминокислотных остатков, в результате чего вся спираль, в целом, приобретает гидрофобный характер. Доля α-спиральных участков в мембранных белках довольно велика (составляет 30—50 %), остальная часть полипептидной цепи находится преимущественно в форме клубка. Участков с β-структурой, как правило, мало, но если они есть, то такой белок как правило имеет форму бета-бочонка.
Интегральные белки можно разделить на две группы:
Структурные исследования[править | править код]
Одним из главных препятствий при структурном изучении интегральных белков биологических мембран является их низкая растворимость. Мембранные белки практически нерастворимы в водных буферных системах, и это фактически исключает использование протеолитических ферментов в традиционной форме. Эта же проблема мешает получению их точных атомных структур методом рентгеноструктурного анализа: мембранные белки с трудом образуют кристаллы. По этой причине для выяснения их третичной и четвертичной структуры часто используется метод моделирования на основе пространственной структуры гомологичных белков.
Интегральные мембранные белки включают в себя белки-транспортёры, линкеры, ионные каналы, рецепторы, ферменты, структурные домены мембранных якорей, белки, участвующие в накоплении и передачи энергии и белки, ответственные за клеточную адгезию[3].
- ↑ Wallin E., von Heijne G. Genome-wide analysis of integral membrane proteins from eubacterial, archaean, and eukaryotic organisms (англ.) // Protein Science (англ.)русск. : journal. — 1998. — Vol. 7, no. 4. — P. 1029—1038. — DOI:10.1002/pro.5560070420. — PMID 9568909.
- ↑ Гусев М.В., Минеева Л.А. Микробиология. — М.: Моск.ун-та, 1985. — 376 с.
- ↑ Saier M.H., Yen M.R., Noto K., Tamang D.G., Elkan C. The Transporter Classification Database: recent advances (англ.) // Nucleic Acids Res. (англ.)русск. : journal. — 2009. — January (vol. 37, no. Database issue). — P. D274—8. — DOI:10.1093/nar/gkn862. — PMID 19022853.
Белки мембран
Если основная роль липидов в составе мембран заключается в стабилизации бислоя, то белки отвечают за функциональную активность мембран. Одни из них обеспечивают транспорт определённых молекул и ионов, другие являются ферментами, третьи участвуют в связывании цитоскелета с внеклеточным матриксом или служат рецепторами для гормонов, медиаторов,
эйкозаноидов, липопротеинов, оксида азота (N0). На долю белков приходится от 30 до 70% массы мембран. Белки определяют особенности функционирования каждой мембраны.
Особенности строения
и локализации белков в мембранах
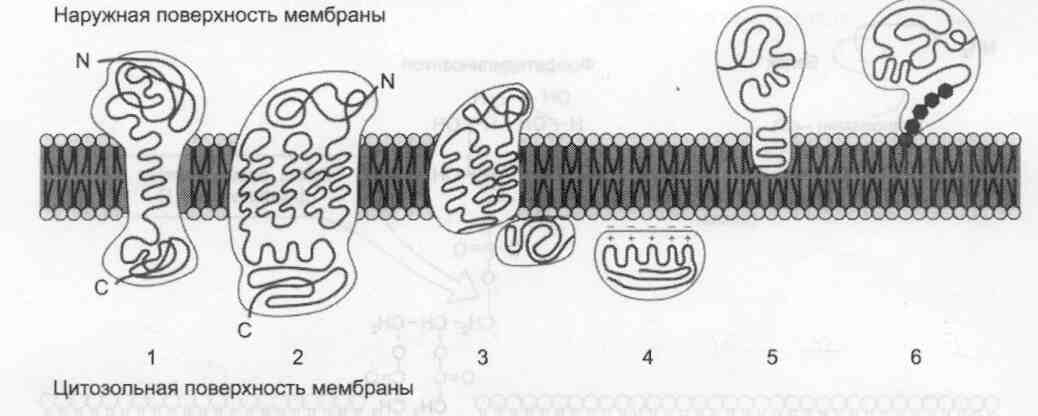
Локализация белков в мембранах. Трансмембранные белки, например: 1 — гликофорин А; 2 — рецептор адреналина. Поверхностные белки: 3 — белки, связанные с интегральными белками, например, фермент сукцинатдегидрогеназа; 4 — белки, присоединенные к полярным «головкам» липидного слоя, например, протеинкинаэа С; 5 — белки, -заякоренные» в мембране с помощью короткого гидрофобного концевого домена, например, цитохрои b5;6 — «заякоренные» белки, ковалентно соединённые с пипидом мембраны (например, фермент щелочная фосфатаза).
Белки мембран различаются по своему положению в мембране. Они могут глубоко проникать в липидный бислой или даже пронизывать его — интегральные белки, либо разными способами прикрепляться к мембране — поверхностные белки.Поверхностные белки
Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральными
белками или поверхностными участками липидного слоя.
Белки, образующие комплексы с интегральными белками мембраны
Ряд пищеварительных ферментов, участвующих в гидролизе крахмала и белков, прикрепляется к интегральным белкам мембран микроворсинок кишечника.
Примерами таких комплексов могут быть сахараза-изомальтаза и мальтаза-гликоамилаза.
Белки, связанные с полярными «головками» липидов мембран
Полярные или заряженные домены белковой молекулы могут взаимодействовать с полярными «головками» липидов, образуя ионные и водородные связи. Кроме того, множество растворимых в цитозоле белков при определённых условиях могут связываться с поверхностью мембраны на непродолжительное время. Иногда связывание белка — необходимое условие проявления ферментативной активности. К таким белкам, например, относят протеинкиназу С, факторы свёртывания крови.
Закрепление с помощью мембранного «якоря»
«Якорем» может быть неполярный домен белка, построенный из аминокислот с гидро-
фобными радикалами. Примером такого белка может служить цитохром b5 мембраны ЭР. Этот белок участвует в окислительно-восстановительных реакциях, как переносчик электронов.
Роль мембранного «якоря» может выполнять также ковалентно связанный с белком остаток жирной кислоты (миристиновой — С14 или пальмитиновой — С16). Белки, связанные с жирными кислотами, локализованы в основном на внутренней поверхности плазматической мембраны. Миристиновая кислота присоединяется к N-концевому глицину с образованием амидной связи. Пальмитиновая кислота образует тиоэфирную связь с цистеином или слож-ноэфирную с остатками серина и треонина.
Небольшая группа белков может взаимодействовать с наружной поверхностью клетки с помощью ковалентно присоединённого к С-концу белка фосфатидилинозитолгликана. Этот «якорь» — часто единственное связующее звено между белком и мембраной, поэтому при действии фосфолипазы С этот белок отделяется от мембраны.
Трансмембранные (интегральные) белки
Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофорин), другие имеют несколько участков (доменов), последовательно пересекающих бислой.
Трансмембранные домены, пронизывающие бислой, имеют конформацию α -спирали. Полярные остатки аминокислот обращены внутрь глобулы, а неполярные контактируют с мембранными липидами. Такие белки называют «вывернутыми» по сравнению с растворимыми в воде белками, в которых большинство гидрофобных остатков аминокислот спрятано внутрь, а гидрофильные располагаются на поверхности.
Радикалы заряженных аминокислот в составе этих доменов лишены заряда и протониро-ваны (-СООН) или депротонированы (-NH2).
Гликозилированные белки
Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гликози-лированы. Олигосахаридные Остатки могут быть присоединены через амидную группу аспараги-на или гидроксильные группы серина и треонина.
Олигосахаридные остатки защищают белок от протеолиза, участвуют в узнавании лигандов или адгезии.
Латеральная диффузия белков
Некоторые мембранные белки перемещаются вдоль бислоя (латеральная диффузия) или поворачиваются вокруг оси, перпендикулярно его поверхности.
Латеральная диффузия интегральных белков в мембране ограничена, это связано с их большими размерами, взаимодействием с другими мембранными белками, элементами цитоскелета или внеклеточного матрикса.
Белки мембран не совершают перемещений с одной стороны мембраны на другую («флип-флоп» перескоки), подобно фосфолипидам.
7.6.3.1. Мембранные белки
По расположению белков в мембране и способу ассоциации с липидным слоем их можно разделить на:
1) поверхностные или периферические мембранные белки, связанные с гидрофильной поверхностью липидного бислоя;
2) погружённые в гидрофобную область бислоя – интегральные мембранные белки.
Периферические белки связаны полярными радикалами с гидрофильной поверхностью бислоя за счёт ионных и водородных связей.
Интегральные белки, как и липиды, являются амфифильными молекулами:
а) у них есть гидрофобные области, взаимодействующие с гидрофобными радикалами липидных молекул внутри бислоя;
и гидрофильные области, обращённые с обеих сторон мембраны к воде.
7.6.3.1.1. Функции мембранных белков
На основании функций, которые выполняют мембранные белки их можно разделить на две группы:
— структурные белки – поддерживают структуру всей мембраны. Это, как правило, периферийные белки.
— динамические белки — непосредственно участвуют в процессах, происходящих на мембране.
Выделяют три класса таких белков:
— транспортные – участвуют в переносе веществ через мембрану;
— каталитические — это ферменты, интегрированные в мембрану и катализирующие происходящие там реакции;
— рецепторные – это мембранные рецепторы, специфически связывающие сигнальные молекулы (гормоны, токсины) на наружной стороне мембраны, что служит сигналом для изменения процессов обмена на мембране и внутри клетки.
7.6.3.2. Основные свойства биомембран
К наиболее важным свойствам мембран следует отнести:
— замкнутость мембран;
— ассиметричность мембран;
— динамичность мембран;
— избирательный транспорт веществ через мембрану.
Замкнутость мембран. В процессе самосборки липидные слои замыкаются сами на себя, что позволяет их гидрофобным хвостам полностью избегать контактов с водой. При этом образуются замкнутые области внутри клетки – органеллы.
Ассиметричность мембран. По химическому составу наружная поверхность мембран отличается от внутренней:
а) в состав наружного слоя мембраны входит больше холестерина и липидов, содержащих остатки придельных жирных кислот, такой состав обеспечивает жёсткость наружного слоя мембраны, защищая тем самым клетку от механических повреждений.
Липиды, входящие во внутренний слой мембраны, содержат большее количество остатков непредельных жирных кислот, что обусловливает текучесть внутреннего слоя.
б) наиболее ассиметрично распределены в мембране гликолипиды и гликопротеины: углеводные части гликопротеинов и гликолипидов выходят на наружную поверхность мембраны.
Динамичность мембран. Отдельные молекулы мембранных липидов и белков свободно перемещаются в мембране – участвуют в двух видах движения – продольном и вращательном:
продольное – меняются со своими соседями местами в приделах одного монослоя;
вращательное – вращаются вокруг собственной оси;
перепрыгивают из наружного слоя во внутренний и обратно.
Избирательный транспорт веществ через мембрану:
а) пассивный транспорт — осуществляется без затраты энергии, благодаря:
— градиенту концентраций по разные стороны мембраны для незаряженных частиц;
— направлением электрического поля для ионов металлов;
б) активный или энергозависимый транспорт – транспорт вещества против градиента концентрации, т. е. перенос вещества в область более высоких концентраций. Для активного транспорта используется энергия АТФ. Транспорт осуществляется с помощью мембранных белков.

Добавить комментарий