Регуляторная функция белков: описание, характеристики и особенности
Белки – это высокомолекулярные органические вещества, которые состоят из альфа-аминокислот, что соединены пептидной связью в единую цепочку. Их главная функция – регуляторная. И о том, в чем и как она проявляется, сейчас следует рассказать в подробностях.
Описание процесса
Белки обладают способностью принимать и передавать информацию. С этим и связано осуществление ими регуляции происходящих в клетках и во всем организме в целом процессов.
Это действие обратимо, и обычно требует присутствия лиганда . Так, в свою очередь, называется химическое соединение, образующее комплекс с биомолекулами, и в дальнейшем производящее определенные эффекты (фармакологические, физиологические или биохимические).
Интересно, что регулярно ученые открывают новые регуляторные белки. Предполагается, что на сегодняшний день известна лишь малая их часть.
Белки, выполняющие регуляторную функцию, делятся на разновидности. И о каждой из них стоит рассказать в отдельности.
Функциональная классификация
Она довольно-таки условная. Ведь один гормон может выполнять самые разные задачи. Но вообще регуляторная функция обеспечивает продвижение клетки по ее циклу, дальнейшую транскрипцию, трансляцию, сплайсинг и активность иных белковых соединений.
Происходит все благодаря связыванию с другими молекулами либо вследствие ферментативного воздействия. К слову, эти вещества играют очень важную роль. Ведь ферменты, являясь сложными молекулами, ускоряют химические реакции в живом организме. И некоторые из них подавляют активность других белков.
А вот теперь можно перейти к изучению видовой классификации.
Белки-гормоны
Они оказывают влияние на различные физиологические процессы и непосредственно на обмен веществ. Белки-гормоны формируются в железах внутренней секреции, после чего переносятся кровью с целью передать информационный сигнал.
Они распространяются хаотично. Однако действуют исключительно на те клетки, у которых есть специфические белки-рецепторы. Только с ними гормоны могут связаться.
Как правило, гормонами регулируются медленные процессы. К таковым можно отнести развитие организма и рост отдельных тканей. Но и тут есть исключения.
Таковым является адреналин – производное аминокислот, основной гормон мозгового вещества надпочечников. Его выделение провоцирует воздействие нервного импульса. Учащается сердцебиение, повышается кровяное давление, возникают другие ответные реакции. Влияет он и на печень – провоцирует расщепление гликогена. В результате в кровь выделяется глюкоза, и мозг с мышцами используют ее в качестве источника энергии.
Белки-рецепторы
Они также обладают регуляторной функцией. Организм человека – это, по сути, сложная система, постоянно получающая сигналы из внешней и внутренней среды. Этот принцип наблюдается и в работе составляющих его клеток.
Так, например, мембранные рецепторные белки передают сигнал с поверхности структурно-элементарной единицы внутрь, параллельно преобразовывая его. Они регулируют клеточные функции благодаря связыванию с лигандом, находящимся на рецепторе снаружи клетки. Что происходит в итоге? Другой белок внутри клетки активируется.
Стоит отметить один важный нюанс. Подавляющее большинство гормонов влияют на клетку лишь в том случае, если на ее мембране имеется определенный рецептор. Им может быть гликопротеид или другой белок.
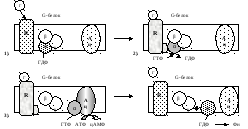
Можно привести пример – β2-адренорецептор. Он находится на мембране печеночных клеток. Если происходит стресс, то с ним связывается молекула адреналина, вследствие чего β2-адренорецептор активируется. Что происходит далее? Уже активированный рецептор задействует G-белок, который в дальнейшем присоединяет ГТФ. Спустя множество промежуточных этапов, происходит фосфоролиз гликогена.
Какой вывод? Рецептор осуществил первое действие по передаче сигнала, который привел к расщеплению гликогена. Выходит, без него последующие реакции, происходящие внутри клетки, не произошли бы.
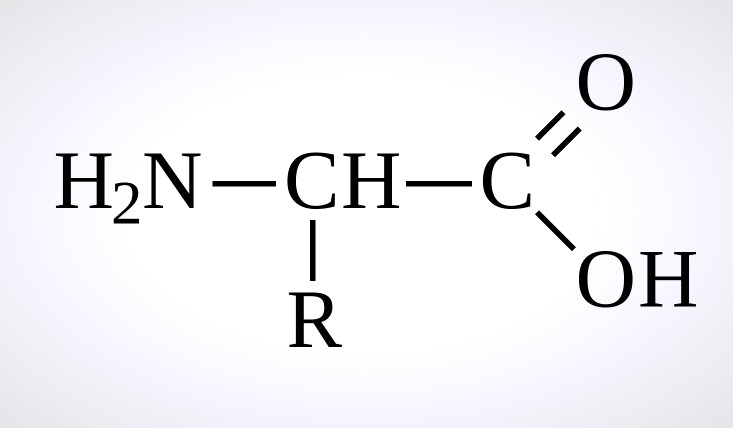
Белки-регуляторы транскрипции
Еще одна тема, которую необходимо затронуть вниманием. В биологии существует понятие транскрипционного фактора. Так называются белки, которым также присуща регуляторная функция. Она заключается в контроле процесса синтеза мРНК на ДНК-матрице. Это называется транскрипцией – переносом генетической информации.
Что можно сказать о данном факторе? Белок выполняет регуляторную функцию либо самостоятельно, либо совместно с другими элементами. Результатом становится снижение или повышение константы связывания РНК-полимеразы с последовательностями регулируемого гена.
У факторов транскрипции есть определяющая черта – наличие в составе одного или нескольких ДНК-доменов, взаимодействующих с конкретными ДНК-участками. Это важно знать. Ведь у других белков, также участвующих в регуляции экспрессии генов, отсутствуют ДНК-домены. Это значит, что их к транскрипционным факторам отнести нельзя.

Протекинкиназы
Рассказывая о том, какие элементы выполняют в клетках регуляторную функцию, необходимо отметить вниманием и эти вещества. Протекинкиназы являются ферментами, модифицирующими другие белки посредством фосфорилирования остатков аминокислот с гидроксильными группами в составе (это тирозин, треонин и серин).
Что представляет собой данный процесс? В ходе фосфорилирования обычно изменяется либо модифицируется функция субстрата. Активность фермента, к слову, также может изменяться, как и положение белка в самой клетке. Интересный факт! Предполагается, что порядка 30% белков могут модифицироваться с помощью протеинкиназ.
А их химическая активность прослеживается в отщеплении от АТФ фосфатной группы и в дальнейшем ковалентном присоединении к остатку какой-либо аминокислоты. Таким образом, протеинкиназы оказывают сильное влияние на клеточную жизнедеятельность. Если нарушится их работа, то могут развиться различные патологии, даже некоторые виды рака.

Протеинфосфатазы
Продолжая изучать особенности и примеры регуляторной функции, следует обратить внимание и на эти белки. Действие, осуществляемое протеинфосфатазами, заключается в отщеплении фосфатных групп.
Что это значит? Выражаясь простым языком, данные элементы выполняют дефосфорилирование – процесс, обратный тому, который происходит в результате воздействия протеинкиназ.
Регуляция сплайсинга
Ее также нельзя обойти вниманием. Сплайсинг – это процесс, в ходе которого из молекул РНК удаляются некоторые нуклеотидные последовательности, а затем соединяются последовательности, которые сохранились в «зрелой» молекуле.
Какое отношение он имеет к изучаемой теме? Внутри генов эукариот имеются участки, которые не кодируют аминокислоты. Называют их интронами. Сначала они переписываются при транскрипции на пре-мРНК, после чего особый фермент их «вырезает».
В сплайсинге участвуют только те белки, которые являются ферментативно активными. Только они способны придать нужную конформацию прем-РНК.
Кстати, еще существует понятие альтернативного сплайсинга. Это очень интересный процесс. Белки, участвующие в нем, препятствуют вырезанию одних нитронов, но при этом способствуют удалению других.
Углеводный обмен
Регуляторную функцию в организме выполняют многие органы, системы и ткани. Но, раз речь идет о белках, то и о роли углеводов, также являющихся важными органическими соединениями, тоже стоит рассказать.
Это очень подробная тема. Углеводный обмен в целом собой представляет огромное количество ферментативных реакций. И одна из возможностей его регуляции – преобразование активности ферментов. Достигается оно вследствие функционирующих молекул определенного фермента. Либо в результате биосинтеза новых.
Можно сказать, что регуляторная функция углеводов основывается на принципе обратной связи. Сначала избыток субстрата, который поступает в клетку, провоцирует синтез новых ферментных молекул, а затем происходит торможение их биосинтеза (ведь именно к этому приводит накопление метаболических продуктов).
Регуляция обмена жиров
Об этом напоследок. Раз уж было сказано о белках и углеводах, то и жиры нужно упомянуть.
Процесс их обмена тесно связан с углеводным. Если в крови повышается концентрация глюкозы, то распад триглицеридов (жиров) уменьшается, вследствие чего активизируется их синтез. Уменьшение ее количества, наоборот, оказывает тормозящее влияние. В результате расщепление жиров усиливается и ускоряется.
Из всего этого следует простой и логичный вывод. Взаимосвязь углеводного и жирового обмена направлена лишь на одно – на обеспечение испытываемых организмом энергетических потребностей.
Регуляторная функция белков — это… Что такое Регуляторная функция белков?
Регуляторная функция белков ― осуществление белками регуляции процессов в клетке или в организме, что связано с их способностью к приёму и передаче информации. Действие регуляторных белков обратимо и, как правило, требует присутствия лиганда. Постоянно открывают всё новые и новые регуляторные белки, в настоящее время известна, вероятно, только малая их часть.
Существует несколько разновидностей белков, выполняющих регуляторную функцию:
- белки — рецепторы, воспринимающие сигнал
- сигнальные белки — гормоны и другие вещества, осуществляющие межклеточную сигнализацию (многие, хотя и далеко не все, из них является белками или пептидами)
- регуляторные белки, которые регулируют многие процессы внутри клеток.
Белки, участвующие в межклеточной сигнализации
Белки-гормоны (и другие белки, участвующие в межклеточной сигнализации) оказывают влияние на обмен веществ и другие физиологические процессы.
Гормоны — вещества, которые образуются в железах внутренней секреции, переносятся кровью и несут информационный сигнал. Гормоны распространяются безадресно и действуют только на те клетки, которые имеют подходящие белки-рецепторы. Гормоны связываются со специфическими рецепторами. Обычно гормоны регулируют медленных процессы, например, рост отдельных тканей и развитие организма, однако есть и исключения: например, адреналин (см. статью адреналин) — гормон стресса, производное аминокислот. Он выделяется при воздействии нервного импульса на мозговой слой надпочечников.При этом начинает чаще биться сердце, повышается кровяное давление и наступают другие ответные реакции. Также он действует на печень(расщепляет гликоген). Глюкоза выделяется в кровь, и ее используют мозг и мышцы как источник энергии.
Белки-рецепторы
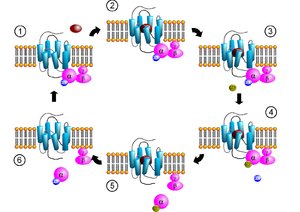
К белкам с регуляторной функцией можно отнести также белки-рецепторы. Мембранные белки — рецепторы передают сигнал с поверхности клетки внутрь, преобразовывая его. Они регулируют функции клеток за счет связывания с лигандом, который «сел» на этот рецептор снаружи клетки; в результате активируется другой белок внутри клетки.
Большинство гормонов действуют на клетку, только если на ее мембране есть определенный рецептор — другой белок или гликопротеид. Например, β2- адренорецептор находится на мембране клеток печени. При стрессе молекула адреналина связывается с β2- адренорецептором и активирует его. Далее активированный рецептор активирует G-белок, который присоединяет ГТФ. После многих промежуточных этапов передачи сигнала происходит фосфоролиз гликогена. Рецептор осуществил самую первую операцию по передаче сигнала, ведущего к расщеплению гликогена. Без него не было бы последующих реакций внутри клетки.
Внутриклеточные регуляторные белки
Белки регулируют процессы, происходящие внутри клеток, при помощи нескольких механизмов:
- взаимодействия с молекулами ДНК (транскрипционные факторы)
- при помощи фосфорилирования (протеинкиназы) или дефосфорилирования (протеинфосфатазы) других белков
- при помощи взаимодействия с рибосомой или молекулами РНК (факторы регуляции трансляции)
- воздействия на процесс удаления интронов (факторы регуляции сплайсинга)
- влияния на скорость распада других белков (убиквитины и др.)
Белки-регуляторы транскрипции
Транскрипционный фактор — это белок, который, попадая в ядро, регулирует транскрипцию ДНК, то есть считывание информации с ДНК на мРНК (синтез мРНК по матрице ДНК). Некоторые транскрипционные факторы изменяют структуру хроматина, делая его более доступным для РНК-полимераз. Существуют различные вспомогательные транскрипционные факторы, которые создают нужную конформацию ДНК для последующего действия других транскрипционных факторов. Еще одна группа транскрипционных факторов — это те факторы, которые не связываются непосредственно с молекулами ДНК, а объединяются в более сложные комплексы с помощью белок-белковых взаимодействий.
Факторы регуляции трансляции
Трансляция — синтез полипептидных цепей белков по матрице мРНК, выполняемый рибосомами. Регуляция трансляции может осуществляться несколькими способами, в том числе и с помощью белков-репрессоров, которые, связываются с мРНК. Известно много случаев, когда репрессором является белок, который кодируется этой мРНК. В этом случае происходит регуляция по типу обратной связи (примером этого может служить репрессия синтеза фермента треонил-тРНК-синтетазы).
Факторы регуляции сплайсинга
Внутри генов эукариот есть участки, не кодирующие аминокислот. Эти участки называются интронами. Они сначала переписываются на пре-мРНК при транскрипции, но затем вырезаются особым ферментом. Этот процесс удаления интронов, а затем последующее сшивание концов оставшихся участков называют сплайсингом (сшивание, сращивание). Сплайсинг осуществляется с помощью небольших РНК, обычно связанных с белками, которые называются факторами регуляции сплайсинга. В сплайсинге принимают участие белки, обладающие ферментативной активностью. Они придают пре-мРНК нужную конформацию. Для сборки комплекса(сплайсосомы) необходимо потребление энергии в виде расщепляемых молекул АТФ, поэтому в составе этого комплекса есть белки, обладающие АТФ-азной активностью.
Существует альтернативный сплайсинг. Особенности сплайсинга определяются белками, способными связываться с молекулой РНК в областях интронов или участках на границе экзон-интрон. Эти белки могут препятствовать удалению одних интронов и в то же время способствовать вырезанию других. Направленная регуляция сплайсинга может иметь значительные биологические последствия. Например, у плодовой мушки дрозофилы альтернативный сплайсинг лежит в основе механизма определения пола.
Протеинкиназы и протеинфосфатазы
Важнейшую роль в регуляции внутриклеточных процессов играют протеинкиназы — ферменты, которые активируют или подавляют активность других белков путем присоединения к ним фосфатных групп.
Протеинкиназы регулируют активность других белков путем фосфолирования — присоединения остатков фосфорной кислоты к остаткам аминокислот, имеющих гидроксильные группы. При фосфорилировании обычно изменяется функционирование данного белка, например, ферментативная активность, а также положение белка в клетке.
Существуют также протеинфосфатазы — белки, которые отщепляют фосфатные группы. Протеинкиназы и протеинфосфатазы регулируют обмен веществ, а также передачу сигналов внутри клетки. Фосфорилирование и дефосфорилирования белков — один из главным механизмов регуляции большинства внутриклеточных процессов.
См. также
Ссылки
- [1] Контроль транскрипции
- [2] Белки против РНК — кто первым придумал сплайсинг?
- [3] Протеинкиназы
- [4] Трансляция и её регуляция
Литература
- Д.Тейлор, Н.Грин, У.Стаут. Биология (в 3-х томах).
Регуляторные белки
В настоящее время известно более 50 G-белков:
Gs-белок активируетаденилатциклазу. Масса 80000-90000Да.
Gi-белок ингибируетаденилатциклазу. Масса 80000-90000Да. Через рецептор, активируется соматостатином.
Gq-белок активируетфосфолипазу С.
G-белки влияют на активность фосфодиэстеразы, фосфолипазы А2, некоторые типыСа2+— и K+-каналов.
G-белки также обеспечивают передачу сигнала в сенсорных клетках (фоторецепторных, обонятельных и вкусовых): Свет → родопсин → Gt→ ФДЭцГМФ→ (цГМФ→ГМФ)
G-белки олигомеры, состоят из 3 субъединиц α, β, γ.
β-субъединицы (35000 Да) у Gs- и Gi-белков одинаковы.
α- субъединицы (41000 Да у Gi, 45000 Да у Gs) кодируются разными генами и обеспечивают специфический ответ (“+” или “-”).
| 1). Гормон (Г), взаимодействуя с рецептором (R), изменяет его конформацию. 2). Гормон-рецепторный комплекс, взаимодействуя с G-белком, уменьшает у α-субъединицы (α) сродство к ГДФ и увеличивает сродство к ГТФ. 3). Присоединение ГТФ к α-субъединице (в присутствии Mg2+) вызывает в G-белке изменение конформации и диссоциацию его на субъединицы: α-субъединицу (α-ГТФ) и димер βγ. α-ГТФ имеет высокое сродство к аденилатциклазе (Ац), его присоединение приводит к активации последней. 4). α-субъединица катализирует распад ГТФ до ГДФ + Фн. α-ГДФ имеет низкое сродство к Ац и высокое к димеру βγ. Отделение α-ГДФ от Ац инактивирует последнюю. |
STAT белки.
Вторичные посредники (мессенджеры)
Мессенджеры– низкомолекулярные вещества, переносящие сигналы гормонов внутри клетки. Они обладают высокой скоростью перемещения, расщепления или удаления(Са2+, цАМФ, цГМФ, ДАГ, ИТФ).
Нарушения обмена мессенджеров приводят к тяжелым последствиям. Например, форболовые эфиры, которые являются аналогами ДАГ, но в отличие от которого в организме не расщепляются, способствуют развитию злокачественных опухолей.
цАМФоткрыта Сазерлендом в 50 годах прошлого века. За это открытие он получил Нобелевскую премию. цАМФ участвует в мобилизации энергетических запасов (распад углеводов в печени или триглицеридов в жировых клетках), в задержке воды почками, в нормализации кальциевого обмена, в увеличении силы и частоты сердечных сокращений, в образовании стероидных гормонов, в расслаблении гладких мышц и так далее.
цГМФактивирует ПКG, ФДЭ, Са2+-АТФазы, закрывает Са2+-каналы и снижает уровень Са2+в цитоплазме.
Ферменты
Ферменты каскадных систем катализируют:
образование вторичных посредников гормонального сигнала;
активацию и ингибирование других ферментов;
превращение субстратов в продукты;
Аденилатциклаза (АЦ)
Гликопротеин с массой от 120 до 150 кДа, имеет 8 изоформ, ключевой фермент аденилатциклазной системы, с Mg2+
АЦ содержит 2 –SHгруппы, одна для взаимодействия с G-белком, другая для катализа. АЦ содержит несколько аллостерических центров: для Mg2+, Mn2+,Ca2+, аденозина и форсколина.
Есть во всех клетках, располагается на внутренней стороне клеточной мембраны. Активность АЦ контролируется: 1) внеклеточными регуляторами — гормонами, эйкозаноидами, биогенными аминами через G-белки; 2) внутриклеточным регулятором Са2+(4 Са2+-зависимые изоформы АЦ активируются Са2+).
Протеинкиназа А (ПК А)
ПК А есть во всех клетках, катализируют реакцию фосфорилирования ОН- групп серина и треонина регуляторных белков и ферментов, участвует в аденилатциклазной системе, стимулируется цАМФ. ПК А состоит из 4 субъединиц: 2 регуляторных R(масса 38000 Да) и 2 каталитическихС(масса 49000 Да). Регуляторные субъединицы имеют по 2 участка связывания цАМФ. Тетрамер не обладает каталитической активностью. Присоединение 4 цАМФ к 2 субъединицамRприводит к изменению их конформации и диссоциации тетрамера. При этом высвобождаются 2 активные каталитические субъединицы С, которые катализируют реакцию фосфорилирования регуляторных белков и ферментов, что изменяет их активность.
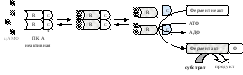
Протеинкиназа С (ПК С)
ПК С участвует в инозитолтрифосфатной системе, стимулируется Са2+, ДАГ и фосфатидилсерином. Имеет регуляторный и каталитический домен. ПК С катализирует реакцию фосфорилирования белков-ферментов.
Протеинкиназа G (ПК G) есть только в легких, мозжечке, гладких мышцах и тромбоцитах, участвует в гуанилатциклазной системе. ПКGсодержит 2 субъединицы, стимулируется цГМФ, катализирует реакцию фосфорилирования белков-ферментов.
Фосфолипаза С (ФЛ С)
Гидролизует фосфоэфирную связь в фосфатидилинозитолах с образованием ДАГ и ИФ3, имеет 10 изоформ. ФЛ С регулируется через G-белки и активируется Са2+.
Фосфодиэстеразы (ФДЭ)
ФДЭ превращает цАМФ и цГМФ в АМФ и ГМФ, инактивируя аденилатциклазную и гуанилатциклазную систему. ФДЭ активируется Са2+, 4Са2+-кальмодулином, цГМФ.
NO-синтаза– это сложный фермент, представляющий собой димер, к каждой из субъединиц которого присоединено несколько кофакторов. NO-синтаза имеет изоформы.
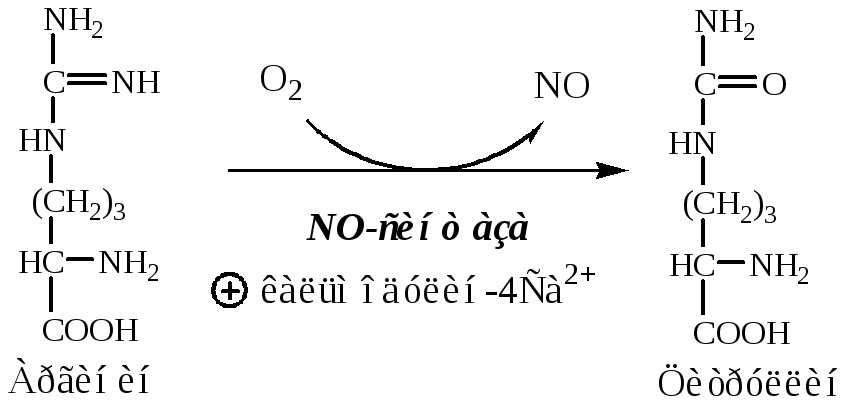
Синтезировать и выделять NO способно большинство клеток организма человека и животных, однако наиболее изучены три клеточные популяции: эндотелий кровеносных сосудов, нейроны и макрофаги. По типу синтезирующей ткани NO-синтаза имеет 3 основные изоформы: нейрональную, макрофагальную и эндотелиальную (обозначаются соответственно как NO-синтаза I, II и III).
Нейрональная и эндотелиальная изоформы NO-синтазы постоянно присутствуют в клетках в небольших количествах, и синтезируют NO в физиологических концентрациях. Их активирует комплекс кальмодулин-4Са2+.
NO-синтаза II в макрофагах в норме отсутствует. При воздействии на макрофаги липополисахаридов микробного происхождения или цитокинов они синтезируют огромное количество NO-синтазы II (в 100-1000 раз больше чем NO-синтазы I и III), которая производит NO в токсических концентрациях. Глюкокортикоиды (гидрокортизон, кортизол), известные своей противовоспалительной активностью, ингибируют экспрессию NO-синтазы в клетках.
Действие NO
NO — низкомолекулярный газ, легко проникает через клеточные мембраны и компоненты межклеточного вещества, обладает высокой реакционной способностью, время его полураспада в среднем не более 5 с, расстояние возможной диффузии небольшое, в среднем 30 мкм.
В физиологических концентрациях NO оказывает мощное сосудорасширяющее действие:
Эндотелий постоянно продуцирует небольшие количества NO.
При различных воздействиях – механических (например, при усилении тока или пульсации крови), химических (липополисахариды бактерий, цитокины лимфоцитов и кровяных пластинок и т.д.) – синтез NO в эндотелиальных клетках значительно повышается.
NO из эндотелия диффундирует к соседним гладкомышечным клеткам стенки сосуда, активирует в них гуанилатциклазу, которая синтезирует через 5с цГМФ.
цГМФ приводит к снижению уровня ионов кальция в цитозоле клеток и ослаблению связи между миозином и актином, что и позволяет клеткам через 10 с расслабляться.
На этом принципе действует препарат нитроглицерин. При расщеплении нитроглицерина образуется NO, приводящий к расширению сосудов сердца и снимающий в результате этого чувство боли.
NO регулирует просвет мозговых сосудов. Активация нейронов какой-либо области мозга приводит к возбуждению нейронов, содержащих NO-синтазу, и/или астроцитов, в которых также может индуцироваться синтез NO, и выделяющийся из клеток газ приводит к локальному расширению сосудов в области возбуждения.
NO участвует в развитии септического шока, когда большое количество микроорганизмов, циркулирующих в крови, резко активируют синтез NO в эндотелии, что приводит к длительному и сильному расширению мелких кровеносных сосудов и как следствие – значительному снижению артериального давления, с трудом поддающемуся терапевтическому воздействию.
В физиологических концентрациях NO улучшает реологические свойства крови:
NO, образующийся в эндотелии, препятствует прилипанию лейкоцитов и кровяных пластинок к эндотелию и также снижает агрегацию последних.
NO может выступать в роли антиростового фактора, препятствующего пролиферации гладкомышечных клеток стенки сосудов, важного звена в патогенезе атеросклероза.
В больших концентрациях NO оказывает на клетки (бактериальные, раковые и т.д) цитостатическое и цитолитическое действие следующим образом:
при взаимодействии NO с радикальным супероксид анионом образуется пероксинитрит (ONOO-), который является сильным токсичным окислителем;
NO прочно связывается с геминовой группой железосодержащих ферментов и ингибирует их (ингибирование митохондриальных ферментов окислительного фосфорилирования блокирует синтез АТФ, ингибирование ферментов репликации ДНК способствуют накоплению в ДНК повреждений).
NO и пероксинитрит могут непосредственно повреждать ДНК, это приводит к активации защитных механизмов, в частности стимуляции фермента поли(АДФ-рибоза) синтетазы, что еще больше снижает уровень АТФ и может приводить к клеточной гибели (через апоптоз).
Белки: функции, введение
Белки: функции, введение
Белки или протеины (что в переводе с греческого означает «первые» или «важнейшие» ), количественно преобладают над всеми другими макромолекулами, присутствующими в живой клетке, и составляют более половины сухого веса большинства организмов. Белки служат теми инструментами, посредством которых генетическая информация получает свое реальное воплощение. В соответствии с тем, что в клеточном ядре содержатся тысячи генов, каждый из которых определяет какой-то один характерный признак живого организма, в клетке существуют тысячи белков и каждый из них выполняет специфическую функцию.
Самый многообразный и наиболее высокоспециализированный класс белков, выполняющий важнейшую биологическую функцию — создание точно и гибко координированной системы целенаправленных взаимозависимых химических реакций, в результате совместного протекания которых возникает «жизнь» — это ферменты , функцией которых является управляемый катализ большого числа химических реакций, в которых участвуют как низко- , так и высокомолекулярные субстраты.
Транспортные белки — белки , выполняющие функцию транспорта, специфически связывают и переносят те или другие молекулы и ионы через мембраны клеток ( как внутрь клетки, так и во вне), а также от одного органа организма к другому. Гемоглобин , содержащийся в эритроцитах, при прохождении крови через легкие связывает кислород и доставляет его к периферическим тканям, где кислород высвобождается и используется для окисления компонентов пищи — процесса, в ходе которого производится энергия. Плазма крови содержит липопротеины , осуществляющие перенос липидов из печени в другие органы. В клеточных мембранах присутствует типы транспортных белков, способных связывать глюкозу , аминокислоты и переносить их как внутрь, так и из клеток.
Пищевые и запасные белки — белки, которые выполняют функцию обеспечения питанием зародышей растений и животных на первых стадиях их развития. Наиболее известными примерами таких белков служат белки семян пшеницы, кукурузы и риса. К пищевым белкам относятся яичный альбумин — основной компонент яичного белка, и казеин , главный белок молока. В ферритине , встречающимся в животных тканях, запасено железо.
Сократительные и двигательные белки — белки, которые обеспечивают клетку или организм двигательной функцией,- способностью сокращаться , изменять форму и передвигаться. Белками с такой функцией являются актин и миозин , представляющие собой нитевидные белки, функционирующие в сократительной системе скелетной мышцы, а также во многих немышечных тканях (микрофиламенты эукариотических клеток) . Другим примером таких белков служит тубулин — белок из которого построены микротрубочки , являющиеся важными элементами ресничек и жгутиков, при помощи которых клетки передвигаются. Длинные клетки нервной системы животных также содержат микротрубочки.
Структурные белки — белки образующие волокна, навитые друг на друга или уложенные плоским слоем, выполняют опорную или защитную функцию, скрепляют между собой биологические структуры организмов и придают им прочность. Главным компонентом хрящей и сухожилий является фибриллярный белок коллаген , имеющий очень высокую прочность на разрыв. Связки содержат эластин — структурный белок способный растягиваться в двух измерениях. Волосы, ногти и перья состоят почти исключительно из прочного нерастворимого белка кератина . Главным компонентом шелковых нитей и паутины служит белок фиброин .
Защитные белки защищают организм от вторжения других организмов или предохраняют его от повреждений. Эту функцию выполняют иммуноглобулины ( или антитела ), образующиеся у позвоночных и обладающие способностью распознавать чужеродные клетки, такие, как проникшие в организм бактерии или вирусы, клетки самого организма, переродившиеся в раковые, а также чужеродные для организма белки, и затем прочно связываться с ними. Аналогична защитная функция у фибриногена и тромбина — белков, участвующих в процессе свертывания крови; они предохраняют организм от потери крови при повреждении сосудистой системы. Белки змеиного яда , бактериальные токсины и токсичные белки растений , например, рицин , вероятно, также в определенном смысле можно отнести к белкам, выполняющим защитную функцию.
Регуляторные белки имеют функцию регуляции клеточной или физиологической активности. К регуляторным белкам относятся многие гормоны , такие как инсулин , регулирующий обмен глюкозы , гормон роста , синтезируемый в гипофизе, паратиреоидный гормон , регулирующий транспорт ионов кальция и фосфатов и др. Регуляторные белки , называемые репрессорами , функционируют как регуляторы биосинтеза ферментов в бактериальных клетках.
Имеется много других белков, функции которых уникальны, что затрудняет их классификацию. Так, например, монеллин — белок, содержащийся в одном из африканских растений, имеет очень сладкий вкус. Он стал предметом изучения как нетоксичное и не способствующее ожирению вещество, которое может быть использовано вместо сахара. Плазма крови некоторых антарктических рыб содержит белки со свойствами антифриза, предохраняющие кровь этих рыб от замерзания. Шарниры в местах прикрепления крыльев у ряда насекомых состоят из белка резилина , обладающего почти идеальной эластичностью.
Ссылки:
Сигнальная функция белка — Википедия
Материал из Википедии — свободной энциклопедии
Сигнальная функция белков — способность белков служить сигнальными веществами, передавая сигналы между тканями, клетками или организмами.
Регуляторную функцию выполняют белки-гормоны. Связывание гормона с рецептором является сигналом, запускающим в клетке физиологические процессы. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Например, инсулин снижает содержание сахара в крови, гормон роста регулирует рост скелета, лептин регулирует аппетит.
Клетки могут взаимодействовать друг с другом на расстоянии с помощью специальных белков, передаваемых через межклеточное вещество. К таким белкам относятся цитокины, факторы роста и др.
Цитокины — небольшие пептидные информационные молекулы. Они регулируют взаимодействия между клетками, определяют жизнедеятельность клеток, их выживаемость, стимулируют или подавляют рост, дифференциацию, функциональную активность и апоптоз (явление программируемой клеточной смерти), обеспечивают согласованность и упорядоченность действий иммунной, эндокринной и нервной систем. Примером цитокинов может служить фактор некроза опухолей, который передаёт сигналы воспаления между клетками организма[1].
Белковую природу имеют также некоторые феромоны. Так, половой феромон (sex-inducing pheromone) вольвокса — гликопротеид[2]. Пептидные феромоны встречаются у самых разных организмов — от бактерий [1] (недоступная ссылка) до млекопитающих[3]
- ↑ Повещенко АФ., Абрамов ВВ., Козлов ВВ. Цитокины — факторы нейроэндокринной регуляции. Успехи Физиологических Наук. 2007 — 38(3):40-6
- ↑ Armin Hallmann, Klaus Godl, Stephan Wenzl and Manfred Sumper. The highly efficient sex-inducing pheromone system of Volvox. Trends in Microbiology Volume 6, Issue 5, 1 May 1998, Pages 185—189
- ↑ Touhara K. Molecular biology of peptide pheromone production and reception in mice. Adv Genet. 2007;59:147-71.

Добавить комментарий