6 советов, как увеличить скорость реакции
Иногда от скорости реакции зависит жизнь, но и без экстремальных условий умение быстро отвечать на внешние события будет полезным. Работодатели предпочитают набирать в свои компании быстрых и энергичных сотрудников, а предприниматели, быстро реагирующие на изменения рынка всегда успешнее, чем медленные и неторопливые. Активизируйте реакции и ваши движения станут скоординированными и точными.
В жизни случаются разные ситуации, из которых порой нужно уметь очень быстро выбираться. Но только если кому-то с хорошей реакцией повезло, то этого нельзя сказать о каждом человеке. Но зато абсолютно любой обитатель Земли, не зависимо от возраста, социального положения и денежных средств, может самостоятельно узнать, как реагировать быстрее.
Что такое быстрая реакция и от чего она зависит
Реакция – это способность мозга быстро отвечать на внешние раздражители. Скорость реакции – это время, которое проходит от момента действия внешнего раздражителя до реакции организма на него.
Сначала наши органы чувств воспринимают какой-либо раздражитель и реагируют на него: нервные импульсы передаются от рецепторов (нервных окончаний) в кору головного мозга. Здесь происходит распознавание сигналов, их обработка, классификация и оценка. Затем подключается зона, контролирующая движения тела, и в работу включаются мышцы. Каждый такой этап требует времени.
У всех людей скорость реакции разная. Встречаются и крайности, когда поведение одних напоминает замедленную съемку, а реакция других молниеносна. Например, японская секретарша Миит за одну минуту ставит 100 печатей. Самый быстрый стрелок в мире Дж. Микулек за полсекунды делает 5 выстрелов из револьвера. 22-летний австралиец Феликс Земдегс собирает кубик Рубик за 4,22 секунды.
Любопытно, что самая быстрая мышечная реакция – у хладнокровных животных. Например, пальмовая саламандра, заметившая жертву, выбрасывает свой язык со скоростью 15 м в секунду. Быстрой реакцией обладают мангусты – благодаря ей они заслужили славу лучших охотников на змей. Молниеносная реакция и у наших любимых кошек.
Для человека быстрая реакция, казалось бы, утратила былое жизненно важное значение: ему уже не нужно быстро уворачиваться от лап диких животных, чтобы не быть съеденным, или же, наоборот, охотиться за ними, чтобы не остаться без обеда.
Однако думать, что быстрая реакция нам ни к чему, было бы ошибочно. Она необходима спортсменам – футболистам, хоккеистам, теннисистам, боксерам, дзюдоистам и др. И не только для того, чтобы ставить рекорды, но и во избежание травм. Быстрая реакция требуется представителям многих профессий – пилотам, водителям, капитанам, машинистам, хирургам и пр. Людям с быстрой реакцией отдают предпочтение и многие работодатели, например в сферах, где нужно быстро реагировать на изменения рынка.
По сути, быстрая реакция нужна всем, чтобы максимально обезопасить себя на улице и дома: правильно вести себя в критической ситуации, несущей угрозу для здоровья или жизни.
Скорость реакции измеряется в мс – миллисекундах. 1 секунда – это 1 000 мс. Чем меньше будет эта величина, тем выше будет скорость реакции. У большинства людей она составляет 230–270 мс. Показатели от 270 мс и выше говорят о замедленной реакции. Пилоты истребителей, спортивные звезды показывают результаты 150 – 170 мс.
Наиболее быстрая реакция у людей в возрасте примерно от 18 до 40 лет. Ее скорость повышается в середине дня – в период наивысшей работоспособности. У утомленного человека она снижается. Это может быть незаметно, если работа не требует быстрой реакции, но при совершении сложных действий возможность совершить ошибку возрастает.
Замедляется реакция и под воздействием алкоголя и наркотических средств. Кроме того, имеет значение психическое состояние человека: негативные эмоции угнетают нервную деятельность, что неблагоприятно сказывается на его реакциях, позитивные же их значительно ускоряют.
На скорость реакции влияет и вид раздражителя: быстрее всего люди реагируют на тактильные и звуковые раздражители, несколько медленнее – на зрительные.
Как стать быстрее
Есть несколько способов научиться реагировать быстрее:
1. Загружать мозг работой
У людей старшего возраста процесс обработки информации, поступающей в головной мозг от органов чувств, замедляется. Это происходит по разным причинам, в том числе и потому, что большинство из них перестают учиться, не стремятся к познанию нового и не хотят выходить из привычной им зоны комфорта. Безделье, просмотр бессмысленных передач, не заставляющих мозг напрягаться, запускают процесс деградации личности, влияющий и на скорость реакции.
Чтобы мозг со временем не атрофировался, его нужно постоянно загружать работой, ставить перед ним новые задачи, и тогда не придется сетовать на замедленную реакцию.
2. Исключаем вредные привычки
У человека создается ложное впечатление, что под влиянием выпитого он становится более раскованным, свободным и в состоянии сконцентрироваться и управлять своим поведением. Но практика показывает обратное: из-за отсутствия быстрой реакции пьяные очень часто становятся жертвами преступлений и участниками аварий.
3. Высыпаемся
Постоянно находиться в состоянии максимальной сосредоточенности и концентрации невозможно. Непременно наступит сбой, когда мы не сможем вовремя отреагировать на опасность. Поэтому периоды концентрации должны чередоваться с периодами расслабления. И полноценный сон – прекрасная возможность дать нервной системе «перезагрузиться», пополнить свои энергетические запасы. Кроме того, при недостатке сна снижается острота зрения, что также негативно сказывается на скорости реакций.
4. Контролируем эмоции
Прежде всего, нужно научиться, не поддаваться страху. С одной стороны, страх сигнализирует об опасности. С другой, — он не мобилизует человека, а тормозит процесс обработки информации в мозгу. Многим знакомо чувство, когда в минуты опасности человек ощущает себя словно парализованным и не в силах сдвинуться с места. Его реакции замедленны, и он не способен дать адекватный ответ. Правильно и быстро отреагировать на раздражитель можно лишь в состоянии отсутствия страха.
Благодаря специальным тренировкам, несущим смысловую нагрузку, то есть имитирующим опасность в реальной жизни, можно избавиться от некоторых страхов и приобрести навыки быстрого реагирования, которые пригодятся в сложной ситуации.
К примеру, звук щелчка, произведенного напарником, может имитировать выстрел и служить сигналом к тому, что надо быстро отскочить в сторону, пригнуться или упасть на землю. Эффект должен быть внезапным – мы не должны контролировать раздражитель, то есть действия напарника.
Избавиться от страха, в частности падения при гололеде, поможет заранее разработанный «план». Например, падая на спину, мы должны быстро прижать подбородок к груди, чтобы не травмировать голову. Свои действия в данном случае мы можем проигрывать мысленно. Это ускорит нашу реакцию, благодаря чему если все-таки упадем, то избежим травмы.
5. Играем
Игры в футбол, волейбол, настольный и большой теннис прекрасно развивают быструю реакцию, поэтому стоить выбрать ту, которая по душе, и начать играть. Можно заняться жонглированием.
Любопытно, что скорость реакции развивают и компьютерные игры – это доказали ученые одного из американских университетов. В ходе эксперимента игроки показали высокие результаты по быстрому принятию решений не только в самой игре, но и в тестах на определение скорости реакции.
6. Тренируемся
Упражнения будут целесообразны лишь в том случае, если проводить их ежедневно, а не время от времени.
Наши подсознательные, интуитивные реакции (за них отвечает правое полушарие мозга) быстрее сознательных, аналитических, которыми ведает левое полушарие. Огромная роль последнего несомненна, но в критические моменты первым реагирует подсознание. И поскольку на раздражитель в первую очередь отзывается именно оно, тренировать скорость реакции можно, многократно повторяя одни и те же движения – до 200 за раз.
Приступая к тренировкам, стоит определиться, на что именно мы будем увеличивать скорость реакции: на слух, прикосновение или зрительный раздражитель. Вначале их лучше разделить, а уж потом тренировать все вместе.
Тренируем скорость слуховой реакции. Например, двое сидят за столом, где лежит какой-нибудь предмет. Третий ходит вокруг них и внезапно хлопает в ладоши. По этому сигналу каждый должен стремиться первым схватить данный предмет.
Тренируем скорость реакции на прикосновение. Тот, кто тренируется, не должен видеть своего тренера (можно завязать ему глаза). Один человек сидит за столом, второй, которого он не видит, должен неожиданно дотронуться до его плеча. В ответ тот должен хлопнуть в ладоши, прыгнуть в сторону и т. п.
Тренируем скорость зрительной реакции. Это очень важно, потому что большая часть информации поступает в мозг благодаря зрению.
Игра в «хлопушки». Двое становятся друг против друга, у обоих руки согнуты в локтях и подняты, ладони развернуты в сторону напарника. Один бьет своей ладонью по ладони другого. Его задача – угадать и вовремя убрать руку, по которой хочет ударить напарник.
Как вариант: руки обоих лежат на столе перед собой. Каждый по очереди старается одной рукой накрыть руку другого, а тот должен успеть ее отдернуть.
Как улучшить реакцию: упражнение с теннисным мячиком
Следует начать с самого легкого упражнения, для реализации которого необходима ровная стенка и небольшой теннисный мячик. Изначально берем его в правую руку, кидаем об стену и ловим опять-таки правой рукой. Через десять минут принцип остается, вот только правая рука меняется на левую. И снова отрабатываем упражнение десять минут.
После этого задание немного усложняется: мяч кидается об стенку правой рукой, но ловится левой, после первой же попытки меняем руки.
Упражнение Мухаммеда Али
Следующее упражнение проделывается только в паре и им пользовался сам Мухаммед Али – знаменитый боксер, у которого была отличная реакция.
Для этого нужно встать у стенки, а второй человек должен кидать в лицо «испытуемого» по очереди четыре мяча, но небольшого размера. Но обязательно целиться в голову, чтобы был хороший стимул увернуться. Сложность предложенного упражнения оценивается расстоянием и силой удара, который должен с приближением к стенке увеличиваться.
Тренажер файт болл
Существует еще одно средство, которое избавит человека от мысли, как улучшить скорость реакции. Это тоже неплохое упражнение, но делается оно со специальным тренажером файт боллом. Но, поскольку данное приспособление есть не у каждого, то для начала будет достаточно и указанных выше упражнений.
Кстати, эти игры многим знакомы с детства.
Но, конечно же, самый результативный способ увеличить скорость реакции – это заняться командными видами спорта, теннисом или единоборствами.
Если заниматься регулярно, то через небольшой промежуток времени будут заметны улучшения в плане реакции, стойкости, силы воли, при необходимости удар станет более точным, лучше будет чувствоваться собственное тело, да и вообще подобный навык может пригодиться в обычный день повседневной жизни.
Кстати, многие утверждают, что после улучшения реакции стало намного легче замечать все происходящее вокруг, концентрироваться на необходимых вещах и не бояться показывать свои навыки и умения.
Понравилась статья? Поделитесь с друзьями!
При копировании материала ссылка на сайт sauap.org обязательна
Ссылки: https://bbf.ru/magazine/26/6953/, https://dgp5.ru/raznoe/kak-uluchshit-reakciyu-v-domashnix-usloviyax-sovety-trenerov-kak-uskorit-reakciyu-i-razvit-skorost-reagirovaniya-uprazhneniya-po-razvitiyu-reakcii-v-domashnix-usloviyax.html,
Главное фото: https://media.thequestion.ru/cards/question/100099/b4181b12912c339256b4dba3c17488bee3daf041?t=1461243264
Поделиться ссылкой:
Похожее
5 приемов, чтобы ее развить
Скорость реакции определяется тем, насколько быстро человек может рефлекторно отреагировать на раздражитель. Казалось бы, эта тема должна быть интересна только медикам и ученым-физиологам, а простым людям разбираться в этом вопросе ни к чему. Но на самом деле это не так. От скорости реакции зависит качество выполнения некоторых видов деятельности. А в экстремальной ситуации, если мы сможем отреагировать быстро, мы существенно повысим свои шансы спастись. Так что, чем быстрее реакция, тем лучше.

Происходит все следующим образом: раздражитель воздействует на рецепторы, посылающие соответствующие импульсы в мозг, который, в свою очередь, посылает ответные сигналы к мышцам, которые призваны сокращаться, выполняя заданное действие. Классическим примером безусловной реакции можно назвать отдергивание руки от горячего. Но есть и условные реакции, которые имеет смысл тренировать. Что же мы в силах сделать в этом отношении?
1. Эмоциональный контроль
Замедлению реакции мы часто можем быть обязаны сознательному или подсознательному страху, особенно если действие несет потенциальную опасность. К примеру, страх падения на скользкой или неровной поверхности. Оказавшись в условиях преодоления препятствия, мы просто тратим силы на страх, снижая концентрацию и скорость передвижения. Чтобы избавиться от страха подобного рода, рекомендуется в качестве тренинга мысленно проигрывать ситуацию, чтобы моделировать в мозгу последовательность действий. Например, представьте, что падение происходит. А теперь подумайте, как и в какой последовательности группироваться, чтобы смягчить удар. Такая тренировка придаст уверенности и ощущение контроля над ситуацией.

2. Медитативные техники
Замечали, что когда мы расслабляемся, то некоторые физические действия даются нам легче и быстрее, чем тогда, когда мы напряжены и все время думаем, получится у нас или нет. Это обстоятельство можно и нужно использовать, чтобы развивать скорость реакции. Но сочетание собранности и расслабленности достигается не сразу, а путем многократного повторения. В этом отношении хорошо помогает практика медитации. Сначала необходимо научиться расслабляться (в первую очередь физически), а затем концентрироваться на предмете или действии.
3. Тренинг реакции
Речь идет о комплексах упражнений, направленных на отработку той реакции, которая вам нужнее всего. Это может быть реакция на звук, на прикосновение, на визуальный раздражитель. Классическим примером тренировки тактильной реакции может быть парное упражнение, в ходе которого человек сидит с завязанными глазами, другой дотрагивается до его руки, а первый должен как можно быстрее отреагировать (например, вскочить и побежать к двери).

4. Комплексные тренировки
После достаточного освоения скорости реакции на разные чувства по отдельности для усовершенствования навыков можно и нужно усложнять упражнения, присовокупляя их друг к другу. Так появляется возможность тренировать одновременно слух и осязание или зрение и слух. Но повторим, что заниматься для достижения действительно устойчивого результата придется ежедневно.
5. Внесение в занятия соревновательного компонента
В зависимости от того, с какой целью вам нужно улучшить скорость реакции, тренировать ее можно как ответ на один раздражитель, так и на все сразу. Заниматься тоже можно как один на один с инструктором, так и в группе. Второе все же предпочтительнее, т. к. привносит дополнительную мотивацию – выполнить упражнение быстрее и лучше соперников. И, как показывает практика, это является действенным методом, способным существенно сократить время, требуемое на освоение того или иного навыка.
Текст: Flytothesky.ru
Читайте также:
8 приложений для тренировки мозга
Поделитесь постом с друзьями!
Способы увеличения скорости химических реакций. Гомогенные процессы.
Для достижения химического равновесия при протекании обратимых реакций требуется определенный период времени, зависящей от природы веществ, составляющих реакционную систему. Для характеристики используется величина — скорость химической реакции.
Скорость реакции — это величина, показывающая как изменяется концентрация одного из веществ в единицу времени.
Чтобы ускорить достижение состояния равновесия, требуется увеличить скорость реакции. Основными способами увеличения скорости реакции является повышение температуры, изменение концентрации, введение катализатора.
1.Влияние температуры. Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией — активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно,
| химические реакции при высоких температурах протекают быстрее, чем при низких температурах |
Возрастание химические реакции при высоких температурах протекают быстрее, чем при низких температурах скорости реакции при нагревании в первом приближении подчиняется следующему правилу:
| при повышении температуры на 10 0С скорость химической реакции возрастает в два — четыре раза. |
Зависимость скорости реакции от температуры определяется правилом Вант — Гоффа :
 |
Правило Вант — Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
2.Влияние катализатора. Катализаторы — это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождается в конце реакции.
Влияние, оказываемое катализаторами на химические реакции, называется катализом. По агрегатному состоянию, в котором находятся катализатор и реагирующие вещества, следует различать:
гомогенный катализ (катализатор образует с реагирующими веществами гомогенную систему, например, газовую смесь;
гетерогенный катализ (катализатор и реагирующие вещества находятся в разных фазах; катализ идет на поверхности раздела фаз).
3.Влияние концентрации реагирующих веществ.При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением.
Рассмотрим общее уравнение реакции: aA +bB = cC + dD. Для данной реакции кинетическое уравнение принимает вид:
 |
Из кинетического уравнения нетрудно установить смысл коэффициента пропорциональности k, называемый константой скорости реакции. Она численно равна скорости реакции, когда концентрация каждого из реагирующих веществ составляют 1 моль/л. Константа скорости зависит от природы реагирующих веществ, но не зависит от их концентраций.
Гомогенные процессы, т.е. процессы, протекающие в однородной среде (жидкие или газообразные смеси, не имеющие поверхностей раздела, отделяющих части системы друг от друга), сравнительно редко встречаются в промышленности. Чисто гомогенную систему получить трудно, так как любое вещество содержит примеси. Для многих промышленных процессов воздух считается гомогенной средой, а для процесса окисления аммиака тот же воздух из-за наличия в нем пыли, влаги считается гетерогенной средой. Исходное сырье всегда имеет примеси. Поэтому лишь условно можно принять за гомогенные те производственные процессы, которые протекают в газовой или жидкой фазе. В гомогенных системах реакции проходят быстрее, чем в гетерогенных. Осуществление и управление гомогенными процессами, протекающими в гомогенной среде, значительно облегчается. Аппаратура тоже проще. Поэтому многие промышленные гетерогенные процессы включают в качестве этапа гомогенный химический процесс в газовой или жидкой фазе. Для гомогенизации системы при проведении химической реакции в однородной среде в промышленности используют разные способы:
1) Поглощение газов, конденсация паров, растворение или плавление твердых материалов приводящей к получению жидкой среды, в которой быстрее протекают реакции.
2) Испарение жидкостей или выделение из них в газовую фазу нужных компонентов и проведение реакции в газовой фазе.
Гомогенные процессы в газовой фазе широко применяются в технологии органических веществ. Для осуществления этих процессов органическое вещество испаряется, и затем его пары обрабатываются тем или иным газообразным компонентом: хлором, окислами азота, сернистым ангидридом и т.п. Значительное применение получил парофазный пиролиз, в котором химические реакции разложения осуществляются в паровой фазе, хотя процесс в целом относится к гетерогенным, поскольку химическим реакциям в паровой фазе предшествует испарение углеводородов. Из большого числа процессов, идущих в жидкой фазе, можно отнести к гомогенным процессы нейтрализации щелочи в технологии минеральных солей без образования твердой соли.
Гомогенные процессы, как правило, идут в кинетической области, т.е. общая скорость процесса определяется скоростью химической реакции, поэтому закономерности, установленные для реакций, применимы и к процессам, идущим в газовой и жидкой среде. С точки зрения кинетики, химические реакции можно классифицировать по молекулярности, т. е по числу молекул, принимающих одновременное участие в элементарном акте химического превращения, и по порядку реакции. Порядок реакции равен сумме показателей степеней при концентрациях реагирующих веществ в кинетическом уравнении реакции. Чаще всего порядок реакции не совпадает с ее молекулярностью. По молекулярности реакции подразделяются на моно -, би и тримолекулярные и по порядку — первого, второго и дробного порядка.
1. Одномолекулярные (мономолекулярные) реакции. К ним относятся:
– реакции внутримолекулярных перегруппировок А→Д, например, изомеризация, инверсия;
– реакции разложения А →Д +Д′.
В виде примера можно указать крекинг этана
С2Н6 → С2Н4 +Н2
2. Двумолекулярные (бимолекулярные), в которых элементарный акт осуществляется в результате встречи двух одноименных (2А) или разноименных (А+В) молекул исходных веществ. Бимолекулярные реакции в свою очередь можно подразделить на:
– реакции присоединения А +А →АА, А +В → АВ и разложения 2А→Д +Д′
– реакции замещения или обмена А +ВВ′ → АВ + В′
– реакции двойного обмена АА′ +ВВ′ → АВ + А′В′
К бимолекулярным реакциям присоединения относятся присоединение атома или радикала к молекуле непредельного соединения и ассоциация насыщенных молекул. Например,
С2Н4 +Н2 →С2Н6,
Н2 +І2 →2НІ
К реакциям замещения или обмена принадлежит большое количество реакций атомов и радикалов с различными молекулами. Типичная реакция двойного обмена в растворе
КСl +NаNО3 →ΝаСl + КNО3
3.Трехмолекулярные, где встречаются и вступают в химическое взаимодействие три молекулы, могут быть реакции присоединения, обменного типа и реакции рекомбинации.
3А →Д, 2А +В →Д +Д′… А +А′ +В → Д +Д′….
Так протекает взаимодействие хлорного железа и хлористого олова в водном растворе
2FеСl3 +SnСl2 ↔2FеСl2 + SnСl4
Каждому из перечисленных типов реакций соответствует свое кинетическое уравнение, связывающее концентрации реагентов со временем. Влияние концентраций реагирующих веществ определяется законом действия масс, который является основным законом химической кинетики. Зависимость скорости химической реакции от температуры сильно изменяется при возрастании порядка реакции. С ростом концентрации исходных веществ скорость реакции до достижения равновесного выхода увеличивается тем сильнее, чем выше порядок реакции. Скорость реакции наиболее сильно зависит от концентраций тех реагирующих веществ, которые входят в наибольшем количестве в уравнения химических реакций. При этом скорость многомолекулярных реакций с повышением концентраций будет возрастать быстрее, чем скорость реакций более низших порядков. Для повышения концентраций реагентов в гомогенных системах применяются следующие методы:
– для газов: выделение из газовой смеси в более концентрированном виде, сжатие или сжижение, растворение газов для проведения реакции в растворе;
– для жидкостей: выпаривание, вымораживание, что позволяет получить раствор более насыщенный реагентами, или же дополнительный ввод реагента в раствор.
Давление влияет на увеличение скорости как прямой, так и обратной реакции пропорционально числу реагирующих молекул. Таким образом, давление влияет в основном через увеличение концентраций реагентов, что практически относится к реакциям, идущим в газовой среде, особенно с уменьшением объема. Давление на скорость реакций в растворах влияет очень мало. Перемешивание ускоряет процессы, протекающие в диффузионной области вследствие замены медленной молекулярной диффузии быстрым конвективным переносом реагентов в зону реакции.
Дата добавления: 2016-10-26; просмотров: 11349;
Похожие статьи:
Скорость химической реакции, подготовка к ЕГЭ по химии
Скорость химической реакции — основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
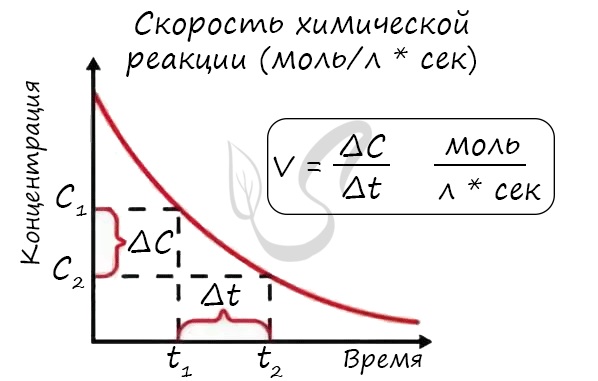
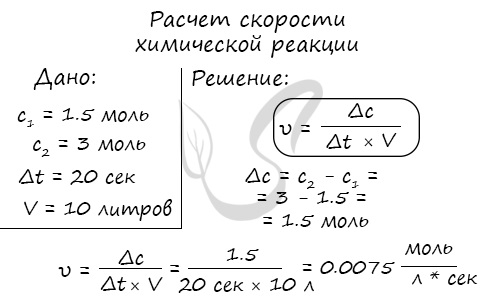
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции — 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд. Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.

Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное железо — железная стружка.

Химическая активность также играет важную роль. Например, отвечая на вопрос: какой из металлов Li или K быстрее прореагирует с водой? Мы отдадим предпочтение литию, так как в ряду активности металлов он стоит левее калия, а значит литий активнее калия.

Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации «прямо пропорционально» скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при уменьшении — понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.

Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
υ = k × СaA × СbB
Физический смысл константы скорости — k — в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени — a и b.
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?

По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?

В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет».
Очень часто в заданиях следующей темы — химическом равновесии, вас будут пытаться запутать и ввести в заблуждении, но вы не поддавайтесь и помните про постулат!
Итак, влияние температуры на скорость реакции «прямо пропорционально»: чем выше температура, тем выше скорость реакции — чем ниже температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая «пропорция».
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»

В формуле, написанной выше, используются следующие обозначение:
- υ1 — скорость реакции при температуре t1
- υ2 — скорость реакции при температуре t2
- γ — температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
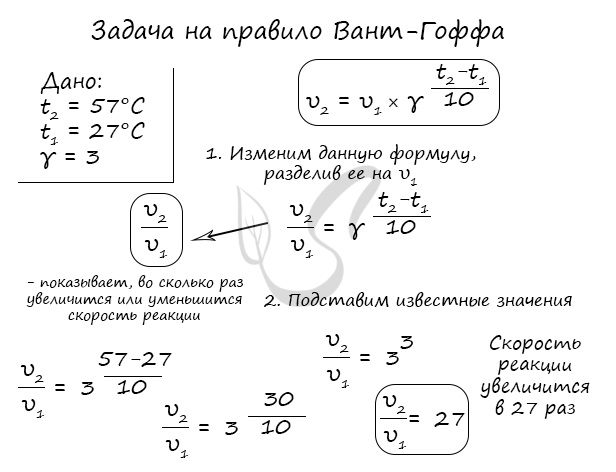
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».

Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) — вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов — белковых молекул, ферментов. Без катализаторов подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора — каталитическими.

Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
Так при лечении гастрита — воспаления желудка (греч. gaster — желудок) или язв часто назначаются ингибиторы протонной помпы — химические вещества, которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка, воспаление стихает.

©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Развитие реакции в домашних условиях: эффективные упражнения
Здравствуйте, дорогие друзья!
В наше время скорость имеет глобальное значение. Человек, который анализирует происходящее со скоростью черепахи — рискует попросту не успеть на личный праздник жизни.
Задумайтесь, все управляющие желают видеть в отрядах своих бойцов универсальных солдат, которые быстры, энергичны и умеют качественно реагировать на возникшие ситуации, не впадая в ступор.
Развитие реакции в домашних условиях — это шанс прокачать свой скилл до немыслимых уровней! Зачем это нужно, просите вы? Даже если особь оказалась ночью в темной улочке, обладая хорошей реакцией, она получает априори больше шансов сохранить свое здоровье и жизнь, в отличии от более медлительных сородичей.
Работа, личные отношения, собственная безопасность и скорость принятия решений тесно связанны с реакцией личности на происходящее. Но как развить этот навык быстро и эффективно?
Для сегодняшнего материала я подготовила ТОП-7 упражнений, помогающих повысить степень ловкости, постановки мышления и кончено же уровень осмысления.
СОДЕРЖАНИЕ:
Немного фактов
Именно психика среднестатистического индивидуума отвечает за быстроту реакции на раздражители. Но перед тем, как ее прокачивать, нужно усмирить свои эмоции. Ведь они — основа правильно предпринятых действий.
Какая эмоция считается самой сильной и влиятельной? Конечно же страх. Его нельзя полностью искоренить из своего подсознания, но вот приручить и научиться контролировать — запросто!
Все мы знаем, что наиболее лучшее упражнение для его усмирения — это личная встреча с объектом страха. При этом, бывают триггеры, которые появляются перед нами внезапно и пугают до ухода души в пятки! Это происходит за доли секунды и понять что-либо или предпринять правильное решение, попросту не выдается возможности.
Как перестать бояться звуков и развить отменную реакцию? Для этого вам понадобится ежедневная работа над собой и упорство. Вы можете попросить своих близких поучаствовать в подобных тренировочных играх.
Например, неожиданный хлопок отлично тренирует реакцию. Для детей подобного рода занятие перерастет в упражнение «доведи маму до полуобморочного состояния», но со временем вы перестанете на него реагировать, снизив психологический барьер.
Как развить молниеносную реакцию при стрессе? Да, это, пожалуй, один из самых волнительных и важных вопросов. Поскольку на принятие решения у человека есть пара-тройка осмысленных минут, действия должны быть заранее выверенными и логичными.
В развитии подобного навыка отлично себя рекомендуют компьютерные игры, особенно командные. В пример я могу поставить футбол, волейбол. Подобного рода игры, по-взрослому тренируют мгновенную оценку ситуации, ее анализ и вынуждают принимать решения за считанные мгновения. А все потому, что от них, зависит общий результат.
Как развить навык, находясь дома?
1. Счет
Сольные упражнения, идеально подходят для проработки собственного ощущения «включенности». Часто психологи рекомендуют прибегать к методике просчета в уме. Допустим, совершая или планируя любую покупку, подсчитайте, какую сумму вы должны отдать продавцу?
Такой метод не только повышает уровень концентрации и реакции, но и прокачивает память.
2. Слуховые сигналы
Упражнение 1
Реакция чувств неоспоримо важна в подобной тренировке. Я советую вам привлечь семью для совместных занятий. Вам потребуется на определенные слуховые сигналы, отвечать характерным образом.
Например, выработайте рефлекс приседания при слове «стой», при посвистывании — прыгните вверх, при команде «оп» — поднимите левую ногу вверх.
Чем разнообразней будут задания — тем эффективней. Начинайте с базовых и простых комбинаций, постепенно увеличивая нагрузку. Постарайтесь использовать максимальное количество групп мышц в процессе занятий.
Это позволит вам наладить и осознать прямой сигнал мозга в привязке с координацией движений, а также выработать определенный рефлекс, что может вам спасти жизнь.
Упражнение 2
Например, при звуке выстрела логичней всего отпрыгивать в сторону или прикрывать голову руками, одновременно приседая. Это повышает развитие ловкости тела и готовности к неожиданностям. Работа со слуховыми раздражителями очень продуктивны. Сам звуковой посыл непременно должен быть понятным и знакомым.
Но обязательным условием выступает факт того, что источник должен быть для вас скрытым. Можно попробовать расположиться к нему спиной или находиться с повязкой на глаза.
Практикуя подобные методики вы научитесь здраво реагировать на поступающие звуковые уловки и заранее вырабатывать правильную поведенческую реакцию.
3. Осязание
Упражнение 3
В вопросе увеличения скорости реакции, прекрасно себя рекомендуют задачи на осязание. Работать нужно с закрытыми глазами или повязкой.
Предлагаю вам эффективное упражнение на развитие быстрой реакции с помощью тактильных ощущений.
Сядьте на стул. Ваши руки должны быть перед собой и на ширине плеч. Для проработки вам потребуется партнер, который будет неожиданно и точечно прикасаться к вашему туловищу сзади.
После того, как вы ощутили прикосновение, вам нужно, как можно скорее хлопнуть в ладоши (на уровне солнечного сплетения). Ваша цель — уменьшить интервал между прикосновением и произведенным хлопком.
Упражнение 4
Еще одно отменное упражнение базируется на ловкости рук. Попросите ребенка прижать обычную, ученическую линейку с стенке. Ваш личный тренер должен держать ее по средине большим пальцем и внезапно отпускать.
Как только она начнет свободно падать, ваша основная миссия — перехватить ее большим пальцем до того времени, как она свалится на пол. Хорошее настроение и азарт вам гарантированны, поэтому смело беритесь за выполнение.
4. Зрение
Упражнение 5
Все мы знаем, что 90% информации, поступающей в наш мозг — заслуга зрения. Поэтому, очень важно тренировать зрительную реакцию на раздражители, научившись отсеивать лишние, мешающие факторы.
Для выполнения следующего задания вам понадобится импровизированная ширма или стойка, а также партнер. Его задача — показывать вам из-за укрытия разнообразного рода предметы с медленной скоростью.
Ваше условие — демонстрировать реакцию только на оговорены ранее предметы. Со временем увеличивайте частоту демонстрируемых атрибутов и добавляйте звуковые триггеры. Благодаря этому вы сможете тренировать одновременно несколько важных реакций.
Упражнение 6
Обязательно практикуйте игры с поиском различных отличий между предметами. Для этого могут подойти игры на компьютере или «живая» игра. Ее суть заключается в том, чтобы один человек одел на себя максимальное количество элементов одежды или аксессуаров. Задача тренера — замереть в определенной позе, а после того, как участник запомнил расположение элементов гардероба, изменить их положение.
Подумайте на досуге, где именно вам сможет понадобиться приобретенный навык? Обратная связь с вашей стороны на внешний фактор воздействия, должна быть логична, удобна и понятна.
Практикуя вышеупомянутые упражнения, вы сможете заметить, что ваша реакция на окружающую Вселенную увеличилась, аналогично включенности в происходящее «здесь и сейчас». Я думаю, уверенность в личных силах также возрастет и будет положительно отмечена вами.
Друзья, на этом точка.
Обязательно подписывайтесь на обновление блога и рекомендуйте его для прочтения в социальных сетях. В комментариях расскажите о том, как вы тренируете навык правильной реакции на случившееся?
До встречи на блоге, пока-пока!
Как улучшить реакцию: ТОП-4 простых способа
Ученые утверждают, что улучшить реакцию можно на целых 20%. Для этого нужно правильно питаться, или вовремя разогреваться.
ЧИТАЙ ТАКЖЕ: Бодрость за 20 минут: научись дремать
Моряк Папай
Британский журнал Нейропсихология доказал: тирозин (аминокислота, содержащаяся в яйцах и шпинате) ускоряет рефлекторные функции организма. Такое меню — здоровый мужской завтрак, с которым можешь быстро похудеть.

Источник: iocs.hu
Кофеиновый спортсмен
Ученые из журнала Полезные Вещества делятся опытом:
“Кофеин не только помогает просыпаться по утрам, но и на целых 0,05 секунды улучшает реакцию. А еще он учащает сердцебиение, чем способствует похудению“.
Так что не стесняйся пить по утрам здоровый энергетик.

Источник: afxdivision.com
ЧИТАЙ ТАКЖЕ: Мужчины на кофеине: как проснуться без кофе
Виртуальная реальность
Исследователи Университета Рочестера провели хитрый эксперимент: они сравнивали скорость реакции обычных ребят и геймеров, которые не могут жить без Call Of Duty и The Sims. Результат шокировал: последние на 25% оказались шустрее.
“Это не означает, что игроки быстрее или лучше. Они просто натренированны постоянной войной, происходящей в их виртуальной реальности“ — утверждает Дафи Бэвелиер, психолог и руководитель теста.

Источник: igronews.com
Разогрев
Перед соревнованиями спортсмены не просто так постоянно разминаются. Таким образом они адаптируют мышцы к предстоящей нагрузке и улучшают реакцию. Британский журнал Спорт твердит: это сделает тебя быстрее на 0,08 секунд. Но не переусердствуй, чтобы энергия осталась и для соревнований.
ЧИТАЙ ТАКЖЕ: Урок 6: скорость реакции и фантомный конус
Химическая кинетика.Скорость химических реакций | CHEMEGE.RU
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt.
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt).
Как заставить частицы чаще сталкиваться, т.е. как увеличить скорость химической реакции?
1. Самый простой способ – повысить температуру. Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетичекий барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что большинство реакций примерно одинаково увеличивают скорость (примерно в 2-4 раза) при повышении температуры на 10оС. Правило Вант-Гоффа звучит так: повышение температуры на 10оС приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ). Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2, v1 — скорость реакции при температуре T1, γ — температурный коэффициент скорости реакции, коэффинциент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или арстворители испаряются при повышенной температуре и т.д., т.е. нарушаются условия проведения процесса.
2. Концентрация. Также повысить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например, для реакции образования аммиака:
N2 + 3H2 ↔ 2NH3
закон действующих масс выглядит так:
Константа скорости реакции показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция осстоит из несольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление. Для газов концентрация напрямую зависит от давления. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается.
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
CaCO3 + SiO2 ↔ CaSiO3 + CO2
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор. Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором.
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно изобрать так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
N2 + 3H2 ↔ 2NH3
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют высокоэффективно и избирательно, с избарительностю 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами. Например, для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоброт. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ. Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности. Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод кипящего слоя. Например, при производстве серной кислоты методом кипящег ослоя производят обжиг колчедана.
6. Природа реагирующих веществ. На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ. Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества. Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.

Добавить комментарий