Нативное состояние белка
Нативное состояние (от латинского nativus – «врожденный»), native state — это термин, использующийся в биохимии, характеризирующий состояние биомолекулы, обычно белка [1], когда эта молекула сохраняет структуру, необходимую для функционирования в живой клетке. Потеря нативного состояния называется денатурацией.
Несмотря на то, что молекулы белков состоят из неразветвленных цепей аминокислот [2], тем не менее, они требуют определенной трехмерной структуры для выполнения своей биологической функции. Собственно, структура, может быть нарушена химической модификаций белка либо взаимодействием с другими молекулами.
Изменения формы белков могут приводить к отдельным нейродегенеративным заболеваниям, в частности болезням, вызванным амилоидами [3] и прионами [4].
Многие ферменты белков могут иметь более одного нативного состояния, и, между этими состояниями переходить в процессе нормального функционирования. Однако, как правило, термин «нативное состояние» используется в отношении свернутых должным образом белки, для того, чтобы отличать их от тех, которые либо еще не свернулись либо подверглись денатурации.
При описании нескольких возможных структур активного белка обычно используется термин «конформация» либо «структура».
Свертывание белков – спонтанный физический процесс, в котором полипептидная молекула сворачивается в характерную для данного белка третичную структуру.
Свернутые или не свернувшиеся (денатурированные) белки легко различить благодаря их растворимости в воде, поскольку многие белки перестают быть растворимыми при денатурации. Белки в нативном состоянии имеют характерную вторичную структуру, выявляемую спектроскопически, с помощью ЯМР-спектроскопии.
Примечания
Примечания и пояснения к статье «Нативное состояние белка».
При написании статьи о нативном состоянии белка, в качестве источников, использовались материалы информационных и медицинских интернет-порталов, сайта новостей ScienceDaily.com, EnglandLab.com, Википедия, а также следующие печатные издания:
- Медина Ф. (составитель) «Большая медицинская энциклопедия». Издательство «АСТ», 2002 год, Москва,
- Лабинская А. С., Костюкова Н. Н., Иванова С. М. «Руководство по медицинской микробиологии. Частная медицинская микробиология и этнологическая диагностика инфекций». Издательство «Бином. Лаборатория знаний», 2010 год, Москва,
- Цыган В. Н., Камилова Т. А., Скальный А. В., Цыган Н. В., Долго-Собуров В. Б. «Патофизиология клетки». Издательство «Элби-СПб», 2014 год, Санкт-Петербург,
- Коржевский Д. Э., Григорьев И. П., Колос Е. А., Сухорукова Е. Г., Кирик О. В., Алексеева О. С., Гусельникова В. В. «Молекулярная нейроморфология. Нейродегенерация и оценка реакции нервных клеток на повреждение». Издательство «Спецлит», 2015 год, Санкт-Петербург.
Третичная структура
водородные связи
гидрофобные взаимодействия (нужны для структуры и биологических функций белка)
дисульфидные и солевые мостики
ионные и ван-дер-ваальсовы связи.
В большинстве белков на поверхности молекул находятся остатки аминокислотных радикалов, обладающих гидрофильными свойствами. УВ — радикалы, которые являются гидрофобными расположены внутри молекул. Такое распределение имеет важное значение в формировании нативной структуры и свойств белка.
В результате белки имеют гидрарную оболочку, а стабилизация третичной структуры во многом обусловлена гидрофобными взаимодействиями. Например, 25-30% аминокислотных остатков в молекулах глобулина имеют выраженные гидрофобные радикалы, 45-50% содержат ионные и полярные радикальные группы.
Боковые цепи аминокислотных остатков, которые отвечают за структуру белков различают по размеру, форме, заряду и способности образовывать водородные связи, также по химической реактивности:
алифатические боковые цепи, например, у валина, аланина. Именно эти остатки формируют гидрофобные взаимодействия.
гидроксилированные алифатические (серии, треонин). Эти аминокислотные остатки принимают участие в формировании водородных связей, а также сложных эфиров, например, с серной кислотой.
ароматические — это остатки фенилаланина, тирозина, триптофана.
аминокислотные остатки с основными свойствами (лизин, аргинин, гистидин). Преобладание в полипептидной цепи таких аминокислот придает белкам основные свойства.
остатки, обладающие кислотными свойствами (аспарагиновая и глутаминовая кислоты)
амидные (аспарагин, глутамин)
содержащие серу (метионин, цистеин)
Белки, содержащие несколько полипептидных цепей, обладают четвертичной структурой. Здесь подразумевается способ укладки цепей относительно друг друга. Такие ферменты называют субъединицами. В настоящее время принято использовать термин «домен», которым обозначают компактную глобулярную единицу белковой молекулы. Многие белки состоят из нескольких таких единиц с массой от 10 до 20кДа. В белках большой молекулярной массы отдельные домены соединяются относительно гибкими участками ППЦ. В организме животных и человека присутствуют ещё более сложные структурные организации белков, примером которых могут быть мультиферментные системы, в частности пируватдекарбоксилазный комплекс.
Понятие о нативном белке
При определенных значениях рН и температуры ППЦ обладает, как правило, только одной конформацией, которая называется нативной и при которой белок в организме выполняет свою специфическую функцию. Почти всегда эта единственная конформация в энергетическом отношении преобладает над десятками и сотнями вариантов других конформаций.
Классификация. Биологические и химические свойства белков
Удовлетворительной классификации белков не существует, они условно классифицируются по пространственному строению, растворимости, биологическим функциям, физико — химическим свойствам и другим признакам.
1. по строению и форме молекул белки подразделяют на:
2. по химическому составу делятся на:
— простые, которые состоят только из аминокислотных остатков
— сложные, имеют в составе молекулы соединения небелковой природы. Классификация сложных белков основана на химической природе небелковых компонентов.
Один из главных типов классификации:
З.по выполняемым биологическим функциям:
— ферментативный катализ. В биологических системах все химические реакции катализируются специфическими белками-ферментами. Известно более 2000
ферментов. Ферменты — мощные биокатализаторы, которые ускоряют реакцию как минимум в 1 млн. раз.
— транспорт и накопление
Перенос многих молекул небольшого размера и различных ионов часто осуществляется специфическими белками, например гемоглобином, миоглобином, которые переносят кислород. Пример накопления: ферритин накапливается в печени.
координированное движение. Белки являются основным компонентом сократительных мышц ( актиновые и миозиновые волокна). Движение на микроскопическом уровне — это расхождение хромосом во время митоза, движение сперматозоидов за счёт жгутиков.
механическая опора. Высокая упругость кожи и костей обусловлена наличием фибриллярного белка — коллагена.
иммунная защита. Антитела — это высокоспецифические белки, способные узнавать и связывать вирусы, бактерии, клетки других организмов.
— генерирование и передача импульсов. Ответ нервных клеток на импульсы опосредован рецепторными белками
регуляция роста и дифференцировки. Строгая регуляция последовательности экспрессии генетической информации необходима для роста дифференцировки клеток. В любой отрезок времени жизни организма экспрессируется только небольшая часть генома клетки. Например, под действием специфического белкового комплекса формируется сеть нейронов у высших организмов.
К другим функциям пептидов и белков относят гормональные. После того как человек научился осуществлять синтез гормональных пептидов, они стали иметь исключительно важное биомедицинское значение. Пептидами являются различные антибиотики, например, валиномицин, противоопухолевые препараты. Кроме того белки выполняют функции механической защиты (кератин волос или слизистые образования, выстилающие ЖКТ или полость рта).
Молекулярная масса белков измеряется в дальтонах (Да) — это единица массы, практически равная массе водорода (-1,000). Термин дальтон и молекулярная масса вводятся как взаимозаменяемые. Mr большинства белков находится в пределах от 10 до 100000.
Фолдинг белка — Википедия
Материал из Википедии — свободной энциклопедии
В биохимии и молекулярной биологии фо́лдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура).
 Переход первичной структуры полипептида (слева) в третичную структуру (справа).
Переход первичной структуры полипептида (слева) в третичную структуру (справа).Каждая молекула белка начинает формироваться как полипептид, транслируемый из последовательности мРНК в виде линейной цепочки аминокислот. У полипептида нет устойчивой трёхмерной структуры (пример в левой части изображения). Однако все аминокислоты в цепочке имеют определённые химические свойства: гидрофобность, гидрофильность, электрический заряд. При взаимодействии аминокислот друг с другом и клеточным окружением получается хорошо определённая трёхмерная структура — конформация. В результате на внешней поверхности белковой глобулы формируются полости активных центров, а также места контактов субъединиц мультимерных белков друг с другом и с биологическими мембранами.
В редких случаях нативными могут быть сразу две конформации белка (т. н. конформеры). Они могут сильно различаться, и даже выполнять различные функции. Для этого необходимо, чтобы в разных областях фазового пространства белковой молекулы существовали два примерно равных по энергии состояния, каждое из которых будет встречаться в нативной форме с соответствующей вероятностью.
Для стабилизации третичной структуры многие белки в клетке подвергаются посттрансляционной модификации. Весьма часто встречаются дисульфидные мостики между пространственно близкими участками полипептидной цепи.
Для корректной работы белков весьма важна правильная трёхмерная структура. Ошибки сворачивания обычно приводят к образованию неактивного белка с отличающимися свойствами. Считается, что некоторые болезни происходят от накопления в клетках неправильно свёрнутых белков (более подробно это описано в статье Прионы).[1]
В фолдинге участвуют белки-шапероны. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
Механизм сворачивания белков до конца не изучен. Экспериментальное определение трёхмерной структуры белка часто очень сложно и дорого. Однако аминокислотная последовательность белка обычно известна. Поэтому учёные пытаются использовать различные биофизические методы, чтобы предсказать пространственную структуру белка из его аминокислотной последовательности.[2]
Недоупорядоченные белки
Одна из основных догм структурной биофизики гласит, что строение молекулы определяет её функцию, подразумевая тем самым наличие чётко заданной пространственной структуры. Для большинства белков, организация и функции которых хорошо изучены, — таких, как «классические» ферменты, — хорошо известно, как именно должны быть расположены те или иные фрагменты белковой молекулы, чтобы она выполняла свою функцию. Однако в последнее время было открыто довольно много белков, структура которых не столь чётко задана, — которые, выражаясь в терминах физики белка, пребывают в состоянии расплавленной глобулы, вообще не имея «плотно упакованного» состояния и обладая аномально высокой подвижностью. И, что самое интересное, такие белки, тем не менее, выполняют важные функции, и некоторые особенности такой их «несовершенной» организации, возможно, играют особенную роль в таких биологических процессах как регуляция транскрипции и передача сигналов.
В течение уже, по крайней мере, века, умы биохимиков и молекулярных биологов заняты загадкой ферментативного катализа, а в особенности самой главной его чертой — способностью к невероятному ускорению практически любой биологически важной химической реакции. Современное представление о механизме ферментативного катализа основывается на идее Лайнуса Полинга о том, что фермент имеет сродство к переходному состоянию реакции (существующему очень короткое время), снижая тем самым энергетический барьер для данного превращения. Обычно, говоря о белковом катализе, исходят из представления о практически статичном активном сайте фермента, «вылепленном» эволюцией для идеального соответствия (пространственного и электростатического) структуре переходного состояния. Впрочем, недавно в экспериментах по ЯМР-спектроскопии было наглядно продемонстрировано, что активные сайты обладают динамической подвижностью, и что характерные времена этих движений тесно связаны с временами соответствующей ферментативной реакции [1]. И хоть само по себе открытие динамической подвижности не сотрясает основ структурной биологии (центральная догма — «структура определяет функцию»), в качестве такого «сотрясения» можно выделить открытие того, что от 1/6 до 1/3 эукариотических белков не имеют чётко заданной структуры — они либо слабо упорядочены, либо содержат довольно большие неупорядоченные области [2]. Классификация слабо упорядоченных белков показала, что они принимают участие во многих регуляторных процессах, связанных с транскрипцией и передачей сигналов.
(Кстати, открытие «не до конца свёрнутых» белков — уже не первое событие, претендующее на то, чтобы расширить традиционные представления о фолдинге: недавно показано, что белок лимфотактин имеет сразу две нативные структуры, выполняющие каждая свою функцию [3], а путём введения мутаций в изначально негомологичные белки можно добиться идентичности последовательностей 90–95%, сохранив, тем не менее, первоначальные упаковку и биохимические свойства [4].)
Эксперименты по определению строения «не до конца свёрнутых» белков показали, что они находятся в состоянии «расплавленной глобулы» [5], — то есть в форме, традиционно считающейся промежуточной на пути к нативной, «плотно упакованной», структуре. И, тем не менее, такие белки, для которых характерна аномально высокая подвижность главной цепи, обладают ферментативной активностью [6] (!), что было довольно-таки непросто объяснить, учитывая, что чётко заданной структуры у них просто-напросто нет. Фермент, для которого были проведены эти исследования, называется хоризматмутазой — это катализатор превращения хоризмовой кислоты (важного метаболита растений и микроорганизмов) в префеновою кислоту (промежуточное соединение в биосинтезе ароматических аминокислот). Фермент выделен из бактерии Methanococcus jannaschii. Точнее, свойствами расплавленной глобулы обладает не сама хоризматмутаза (существующая в виде стабильного димера), а её генно-инженерный мономерный вариант (mMjCM), сохраняющий те же биохимические свойства, что и димер, но обладающий при этом очень высокой подвижностью главной цепи молекулы [6] (рис. 1а, б). Нужно добавить, что в несвязанном с лигандом состоянии определить структуру mMjCM вообще не удаётся из-за очень высокой подвижности. Но если в раствор добавить специальную молекулу — аналог переходного состояния реакции, — с которой фермент связывается, но не может расщепить, это приводит к некоторой стабилизации молекулы и позволяет изучить её структуру и подвижность с помощью методики ЯМР-спектроскопии [6].
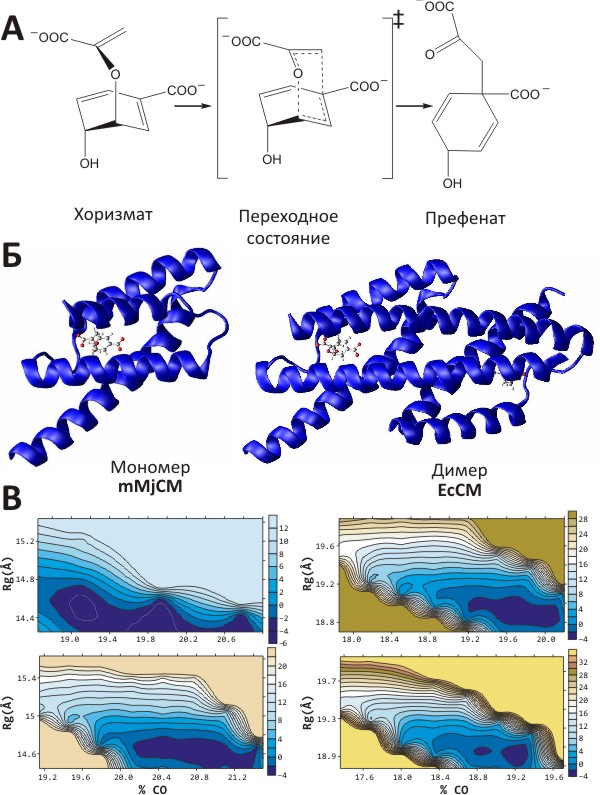
Рисунок 1. Исследование энергетического ландшафта мономерного варианта хоризматмутазы. А. Химическая реакция, катализируемая харизматмутазой Methanococcus jannaschii. Согласно представлению о ферментативном катализе, переходное состояние реакции обладает сродством к ферменту, её катализирующему. Б. Нативная форма хоризматмутазы представляет слитый димер (справа; структура фермента E. coli), однако с помощью генно-инженерных модификаций его можно превратить в мономер, функционирующий в состоянии расплавленной глобулы [6] (слева; структура фермента M. jannaschii). В обоих случаях в активном сайте находится молекула аналога переходного состояния (АПС). В. Упрощённый энергетический ландшафт, рассчитанный для обоих ферментов в присутствии (снизу) или отсутствии АПС (сверху) с помощью метода молекулярной динамики [7]. Хорошо заметна бóльшая протяжённость области низкой энергии (показана тёмно-синим) для мономера (mMjCM) по сравнению с димером (EcCM), что согласуется с данными о высокой конформационной подвижности mMjCM (вверху слева). При связывании с АПС (снизу) размер низкоэнергетических областей сокращается для обоих ферментов, но в случае mMjCM — особенно выраженно (внизу слева).
Объяснить (пока, видимо, только предварительно) наличие ферментативной активности у белкá, не обладающего фиксированной трёхмерной структурой, удалось с помощью компьютерных расчётов, позволяющих получить упрощённый вариант гиперповерхности потенциальной энергии молекулы и понять некоторые особенности её функционирования [7]. Получавшиеся в таких расчетах энергетические поверхности были уже не «гипер», а «обычными», то есть описывались всего тремя измерениями — по сравнению с астрономическим числом координат, необходимых для характеристики «честной» гиперповерхности (рис. 1в). На основании анализа молекулярной динамики димерной и мономерной (mMjCM) форм хоризматмутазы в присутствии и отсутствии аналога переходного состояния (АПС), учёные построили характерные для этих систем упрощённые энергетические карты и сделали интересные наблюдения:
- во-первых, низкоэнергетическая область для мономера значительно более обширна (вытянута вдоль оси абсцисс на рисунке 1в), что хорошо согласуется с тем фактом, что mMjCM существует в виде расплавленной глобулы и, следовательно, может в широких пределах варьировать свою структуру. Для нативной же формы такой возможности нет: «колодец» потенциальной энергии, определяющий характеристики нативного состояния, имеет достаточно крутые «стенки» и небольшую площадь, — что обозначает чётко определённую и стабильную трёхмерную структуру;
- во-вторых, при связывании лиганда — АПС катализируемой реакции — в случае обоих ферментов низкоэнергетический «колодец» сужается, свидетельствуя о стабилизации молекулы. И, опять же, в соответствии с экспериментом, этот эффект намного более выражен в случае мономера: если в отсутствие лиганда он не обладает вообще никакой стабильной структурой, то при связывании АПС достигается определённая стабилизация.
Каким же образом хаотически свёрнутому белку, не обладающему чётко заданной трёхмерной структурой, удаётся выполнять вполне конкретные биологические функции? Одним из возможных объяснений является стабилизация неупорядоченной белковой цепи при взаимодействии со специфической мишенью или лигандом [8], — то есть, мы имеем дело с фолдингом, происходящим одновременно со связыванием с другой молекулой. Расчёты подтверждают, что такое специфическое взаимодействие способно вызвать образование устойчивых структурных элементов в практически хаотической (до связывания) структуре (рис. 1в).
В отличие от «классического» примера глобулярных белков, на которых были выработаны современные представления о фолдинге биополимеров (сильно изрезанная энергетическая гиперповерхность с одним чётко выраженным глубоким «колодцем», соответствующим нативному состоянию (рис. 2, слева)), энергетический ландшафт слабо упорядоченных белков выглядит по-другому. Для таких белков «колодец» не очень «глубокий», но зато достаточно «широкий», что и определяет динамические свойства молекулы (рис. 2, в центре). «Углубить» этот «колодец» (и вызвать образование стабильной нативной структуры) могут специфические межмолекулярные взаимодействия, такие как взаимодействие с лигандом в случае мономерной формы хоризматмутазы. Однако остаётся ещё одна проблема: такой процесс неизбежно будет связан с уменьшением энтропии по мере того, как хаотически устроенная цепь белка будет сворачиваться в нативную форму с участием другой молекулы, — а это невыгодно с термодинамической точки зрения. Так что же привело к появлению таких невыгодных форм существования белковых молекул?
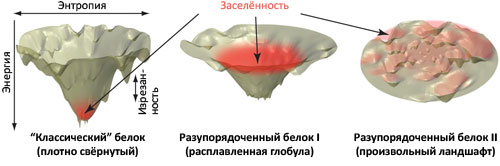
Рисунок 2. Взаимосвязь между фолдингом белкá и профилем поверхности свободной энергии. Слева: схема энергетического ландшафта «классического» глобулярного белкá, имеющего один ярко выраженный «колодец» на энергетической поверхности, где находится нативная конформация, соответствующая в данном случае глобальному термодинамическому минимуму свободной энергии и доступная с позиций кинетики фолдинга. Подобные схемы подразумевают разделение свободной энергии системы на структурную энтропию белкá (по горизонтальной оси) и эффективную энергию (или просто энергию). Последняя, впрочем, тоже содержит энтропийное слагаемое, но оно относится уже не к белку, а к растворителю. В центре: энергетические ландшафты слабо упорядоченных белков характеризуются меньшей изрезанностью, малой «глубиной» и большей «шириной» энергетического «колодца» [2]. Возникающая при этом сила, управляющая сворачиванием молекулы, достаточно слаба, и белок может оставаться разупорядоченным. Однако специфические взаимодействия с другими молекулами (белкáми, лигандами) могут способствовать образованию дополнительных контактов, углубляющих энергетический «колодец» и вызывающих одновременное со связыванием сворачивание [2], [6]. Справа: произвольно организованный энергетический ландшафт, для которого «поиск» каталитической конформации занял бы неопределённо большое время. Красным цветом на всех трёх схемах показана «заселённость» различных областей конфигурационного пространства.
На этот счёт существует несколько гипотез относительно преимуществ, которыми обладают слабо упорядоченные белки, например — более быстрая или специфическая кинетика реакции или разнообразие выполняемых функций [8] — способность взаимодействовать более чем с одной мишенью и/или связывать более одного лиганда. Однако предсказать или экспериментально определить, какой же именно функцией обладает слабо упорядоченный белок, очень сложно: динамика расплавленной глобулы, фактически, «размазывает» функциональную конформацию белка среди обширного ансамбля произвольных структур.
Может ли расплавленная глобула катализировать ферментативную реакцию? Ответ на этот вопрос положителен ([6] и рисунок 1). Однако может ли белок с произвольным образом организованным энергетическим ландшафтом также осуществлять катализ? Это уже вряд ли: в этом случае белку потребовалось бы астрономически большое время, чтобы случайно принять конформацию, способную катализировать превращение (см. рис. 2, справа). Тут возникает аналогия с парадоксом Левинталя (см. «Торжество компьютерных методов: предсказание строения белков» [10]), но этот парадокс уже не кажущийся: ведь в этом случае отсутствуют выделенные направления на поверхности потенциальной энергии, которые как раз и обеспечивают выход из парадокса Левинталя.
Из этих рассуждений следует, что в слабо упорядоченных белкáх всё-таки важна именно упорядоченность, а точнее — профиль энергетического ландшафта, отличающийся от поверхности произвольного рельефа наличием области низкой энергии, пусть и значительно менее выраженной, чем в случае плотно упакованных белков. Достижение каталитической конформации будет дополнительно «стоить» «не до конца свёрнутым» белкáм сопутствующего этому снижения энтропии, и катализ с участием таких ферментов, при прочих равных, будет менее эффективным. Среди возможных преимуществ слабо упорядоченных белков в качестве ферментов или регуляторов можно в дополнение к уже названному добавить их меньшую стабильность (т. е., более быструю деградацию на протеасомах), что может быть плюсом, если требуется очень короткий «всплеск» определённой активности.
Похоже, что эти странные, слабо упорядоченные белковые молекулы могут играть важную роль в регуляции клеточных процессов. И чтобы более пóлно понять их функции и механизмы, по которым они осуществляют катализ и другие процессы, потребуется ещё много лабораторных и компьютерных экспериментов.
Статья написана по материалам журнала PNAS [9].
- Katherine A. Henzler-Wildman, Ming Lei, Vu Thai, S. Jordan Kerns, Martin Karplus, Dorothee Kern. (2007). A hierarchy of timescales in protein dynamics is linked to enzyme catalysis. Nature. 450, 913-916;
- Garegin A. Papoian, Peter G. Wolynes. (2003). The physics and bioinformatics of binding and folding?an energy landscape perspective. Biopolymers. 68, 333-349;
- Одна последовательность — одна структура: был ли Анфинсен неправ?;
- Непохожие «гомологичные» белки;
- Финкельштейн А.В. Введение в физику белкá. Лекция 17;
- Konstantin Pervushin, Katherina Vamvaca, Beat Vögeli, Donald Hilvert. (2007). Structure and dynamics of a molten globular enzyme. Nat Struct Mol Biol. 14, 1202-1206;
- M. Roca, B. Messer, D. Hilvert, A. Warshel. (2008). On the relationship between folding and chemical landscapes in enzyme catalysis. Proceedings of the National Academy of Sciences. 105, 13877-13882;
- H.Jane Dyson, Peter E Wright. (2002). Coupling of folding and binding for unstructured proteins. Current Opinion in Structural Biology. 12, 54-60;
- G. A. Papoian. (2008). Proteins with weakly funneled energy landscapes challenge the classical structure-function paradigm. Proceedings of the National Academy of Sciences. 105, 14237-14238;
- Торжество компьютерных методов: предсказание строения белков.
Главная страница / рассылка / Белок дает силу :: Выпуск 22 Здравствуйте. Наступила осень, и это значит, что пора готовится к Новому году. Ведь все хотят выглядеть красиво, но если вы вспомните об этом в декабре, то боюсь, что получится «как в прошлый раз». Для того, чтобы было легче худеть ваш рацион должен быть сбалансирован, поэтому наш сегодняшний выпуск посвящен белку. — Значение белка для снижения веса — Удовлетворение от еды — Запасы энергии — Практические пищевые рекомендации Белок — источник энергии и многого другого В нашем мире быстрого и удобного питания нелегко получить высококачественный
белок. Но без него у вас могут начать выпадать волосы, крошиться ногти,
а мышцы начнут деградировать и превращаться в кисель. Вам вряд ли удастся
достичь идеального размера и при этом сохранить энергию без постоянного
поступления в организм высококачественного белка. Белки снабжают энергией и многим другим Они являются источником энергии, из них строятся гормоны, антитела,
ферменты и ткани организма. Организм не может существовать без определенных
незаменимых аминокислот, получаемых из белка. К тому же вырабатывать их
самостоятельно он не способен. Нужен постоянный приток аминокислот в рацион.
Существуют заменимые аминокислоты, необходимые организму, которые он синтезирует
сам. Заменимые и незаменимые аминокислоты Аминокислоты, получаемые из потребляемого нами белка, влияют на многие
процессы, происходящие в организме. Например, витамины, и минералы, находящиеся
в организме, не могут быть задействованы в отсутствие аминокислот. Для
человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Нативные и ненативные белки
Белок бывает двух типов: — Нативные белки содержат все незаменимые аминокислоты. Указанные белки
есть в мясе, рыбе, морепродуктах, птице, яйцах и сыре. Они богаты также
витаминами группы В и микроэлементами, необходимыми организму. Соевые
продукты, такие как тофу, темпе и соевый порошок, не содержат нативных
белков, так как в них нет метионина. Сочетание нативных и ненативных белков Ненативные белки полезно есть в сочетании с другими продуктами. Употребляя
в пищу сочетания определенных ненативных белков, можно получить за один
прием все незаменимые аминокислоты. Для этого можно сочетать такие бобовые,
как, например, фасоль и чечевица, с каким-либо из следующих продуктов:
Раньше считалось, что для получения полноценного белка необходимо одновременно
употреблять в пищу разные продукты. Новые исследования предполагают, что
можно употреблять растительные белки и другие продукты в течение 24 часов,
а не обязательно при одном приеме пищи. Белок помогает худетьПолучая белок регулярно, вы обеспечиваете себя достаточной поддержкой, чтобы продержаться до следующего приема пищи. Белок поставляет все необходимые для сжигания жира компоненты. Если его не потреблять в пищу, мы будем быстро уставать. Часто те, кто не употребляет белка за завтраком, днем переживают упадок. Они стараются наверстать упущенное за счет крахмалов с высоким индексом гликемии и сахаров. Это путь к накоплению веса, а не к его снижению. Не восполняйте упущенное вечером. Рассмотрим типичную женщину, решившую похудеть. Утро она начинает с
чашки кофе или небольшого количества каши и молока. Иногда она ест мюсли
и йогурт. На работе она не обедает и, вот несчастье, во второй половине
дня начинается упадок. Очень неприятное чувство, тем более что ей еще
надо закончить свою работу. Инстинктивно она ищет, чем бы подкрепиться.
Если найдется крахмалосодержащая еда с высоким гликемическим индексом
(скажем, булочка или шоколадка), она быстренько сжует ее. Это чувство
усталости и упадка знакомо всем, кто не поддерживает свой обмен веществ
высококачественным белком. Вы можете спросить: «А как же тот белок, что
в молоке или йогурте, разве он не считается?» Этого недостаточно. Полчашки
молока содержит около 4 граммов белка. Полчашки фруктового йогурта — столько
же. И того и другого недостаточно, чтобы продержаться до обеда. Около
15 — 20 граммов высококачественного белка на завтрак или на обед дали
бы возможность продержаться до вечера. Тогда не пришлось бы во второй
половине дня подкрепляться продуктами с высоким гликемическим индексом,
и вечером человек бы чувствовал себя полным энергии, а не измученным и
истощенным. Потребность в белке Каждый день в идеале нужно съедать от 50 до 100 граммов белка. Так рекомендуют
различные специалисты. Потребность в белке зависит от пола, телослосложения,
мышечной массы и уровня активности. Нетрудно подсчитать, что при трехразовом
питании на каждый прием пищи выпадает по 16 — 33 грамма белка. Если между
приемами пищи вы перекусываете белком, на основной прием будет приходиться
меньше этого питательного вещества.
Контроль уровня сахара в крови Если получать при каждом приеме пищи рекомендованное количество белка,
хроническое понижение уровня сахара в крови останется в прошлом. И не
будет больше угрожать вам, похудевшему. Это очень важно. Слишком много
людей придерживаются ограничительных диет, сначала моря себя голодом,
а затем, когда почувствуют упадок энергии, наедаясь продуктами с высоким
гликемическим индексом.
Я чувствую себя вполне сытым после такой едыПолучив достаточное количество белка, вы встаете из-за стола с чувством
сытого удовлетворения, и это чувство надолго остается при вас. Знаете
старую шутку о китайской еде, — «не важно, сколько съел, через час все
равно голодный»? Вы догадываетесь, почему — в китайской еде очень мало
белка, плюс ненатуральное вещество моноглутамат натрия, не являющееся
питательным. Белок — вот что нужно есть на завтракСнова и снова приходится слышать, что для того, чтобы похудеть, нужно хорошо завтракать. Это верно. Необходимо получать на завтрак белок, чтобы обеспечить себя энергией на весь день и не быть к вечеру вялым. Белок поддерживает нормальный уровень обмена веществ в течение дня и ночи. Он также повышает уровень внимания, стимулируя выработку мозгом допамина.
Так что съедайте каждое утро по 15 — 20 граммов белка. — творог зерненый ( низкокалорийный и содержит много белка) Следующие продукты, содержащие белок, пригодны для того, чтобы съесть их в машине по пути на работу. Конечно, мы не рекомендуем делать этого, но жизнь есть жизнь и приходится с ней считаться. Белок на завтрак, который можно съесть в машине: Белок дает здоровьеКак мы уже сказали, белок — ваш друг. Из него в буквальном смысле строятся красивое тело, густые волосы, здоровые ногти и упругие мышцы. Белок стимулирует выработку сжигающего жир гормона, глюкогона, обеспечивает аминокислотами организм для обновления тканей и повышает уровень обмена веществ (даже тогда, когда вы спите!). Белки должны занимать одно из главных мест в рационе. Ешьте их не меньше трех раз в день, предпочтительнее при каждом приеме еды.
Ведущий рассылки Владимир Мардинский. E-mail: [email protected] На сегодня все. Заходите на сайт Худеем Вместе.Ру и становитесь участниками клуба. Заходите на мои сайты: Открылся новый массажный кабинет на Исаакиевской площади д.4 Скульптурирующий массаж в массажных кабинетах «Массаж для здоровья». По материалам книги: Люси Билл «Как сбросить лишний вес». | Рассылка сайта Худеем Вместе.Ру Выпуск 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35 , 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55 |
Денатурация белка
Для обозначения процесса, при котором нативные свойства белка теряются, используют термин ДЕНАТУРАЦИЯ.
ДЕНАТУРАЦИЯ — это лишение белка его природных, нативных свойств, сопровождающееся разрушением четвертичной (если она была), третичной, а иногда и вторичной структуры белковой молекулы, которое возникает при разрушении дисульфидных и слабых типов связей, участвующих в образовании этих структур. Первичная структура при этом сохраняется, потому что она сформирована прочными ковалентными связями. Разрушение первичной структуры может произойти только в результате гидролиза белковой молекулы длительным кипячением в растворе кислоты или щелочи.
Факторы, вызывающие денатурацию белков
Факторы, которые вызывают денатурацию белков, можно разделить на физические и химические.
Физические факторы
1. Высокие температуры. Для разных белков характерна различная чувствительность к тепловому воздействию. Часть белков подвергается денатурации уже при 40-500С. Такие белки называют термолабильными. Другие белки денатурируют при гораздо более высоких температурах, они являются термостабильными.
2. Ультрафиолетовое облучение
3. Рентгеновское и радиоактивное облучение
4. Ультразвук
5. Механическое воздействие (например, вибрация).
Химические факторы
1. Концентрированные кислоты и щелочи. Например, трихлоруксусная кислота (органическая), азотная кислота (неорганическая).
2. Соли тяжелых металлов (например, CuSO4).
3. Органические растворители (этиловый спирт, ацетон)
4. Растительные алкалоиды.
5. Мочевина в высоких концентрациях
Воздействие факторами денатурации применяют для стерилизации оборудования и инструментов, а также как антисептики.
Обратимость денатурации
В пробирке (in vitro) чаще всего это – необратимый процесс. Если же денатурированный белок поместить в условия, близкие к нативным, то он может ренатурировать, но очень медленно, и такое явление характерно не для всех белков.
In vivo, в организме, возможна быстрая ренатурация. Это связано с выработкой в живом организме специфических белков, которые «узнают» структуру денатурированного белка, присоединяются к нему с помощью слабых типов связи и создают оптимальные условия для ренатурации. Такие специфические белки известны как «белки теплового шока» или «белки стресса».
Белки стресса
Существует несколько семейств этих белков, они отличаются по молекулярной массе.
Например, известен белок hsp 70 – heatshock protein массой 70 kDa.
Такие белки есть во всех клетках организма. Они выполняют также функцию траспорта полипептидных цепей через биологические мембраны и участвуют в формировании третичной и четвертичной структур белковых молекул. Перечисленные функции белков стресса называются шаперонными. При различных видах стресса происходит индукция синтеза таких белков: при перегреве организма (40-440С), при вирусных заболеваниях, отравлениях солями тяжелых металлов, этанолом и др.
В организме южных народов установлено повышенное содержание белков стресса, по сравнению с северной расой.
Молекула белка теплового шока состоит из двух компактных глобул, соединенных свободной цепью:
 Разные
белки теплового шока имеют общий план
построения. Все они содержат контактные
домены.
Разные
белки теплового шока имеют общий план
построения. Все они содержат контактные
домены.
Разные белки с различными функциями могут содержать одинаковые домены. Например, различные кальций-связывающие белки имеют одинаковый для всех них домен, отвечающий за связывание Ca+2.
Роль доменной структуры заключается в том, что она предоставляет белку большие возможности для выполнения своей функции благодаря перемещениям одного домена по отношению к другому. Участки соединения двух доменов – самое слабое в структурном отношении место в молекуле таких белков. Именно здесь чаще всего происходит гидролиз связей, и белок разрушается.
Нативный белок — Справочник химика 21
Нативный белок -—=—> Денатурированный белок [c.245]Нативный белок -> Денатурированный [c.245]
Нативный белок Развернутый белок——. Обмен (4.8) [c.70]
Наиболее специфичная реакция на нативный белок основана на явлении белковой ошибки индикатора . [c.509]
Безошибочность свертывания цепи in vitro [94] проверяют путем сопоставления свойств нативного и ренатурированного белков в отношении биологической активности и специфичности [441]. Например, денатурированный различными способами переносчик кислорода — гемоглобин может быть вновь переведен в нативный белок, который а) имеет ту же растворимость, что и исходный белок, б) способен кристаллизоваться, в) имеет спектр поглощения, харак- [c.182]
В противоположность далеко идущему гидролизу окисленной рибонуклеазы при действии пепсина в определенных условиях на нативный белок гидролизуется только одна пептидная связь с отщеплением от С-концевого участка тетрапептида и образованием вещества, лишенного ферментной активности [8]. [c.210]
Нативный белок с н,о Денатурированный в воде белок в воде [c.119]
Нативный белок в растворе мочевины [c.119]
Недавно для фракционирования белков плазмы крови начали применять также соли тяжелых металлов, в частности соли цинка [35]. Осаждение белков большими количествами солей тяжелых металлов приводит к необратимой их денатурации, прибавление же небольших количеств солей вызывает обратимое связывание катионов белками (по всей вероятности, сульфгидрильными группами белка) с образованием осадков, из которых можно выделить нативный белок [35]. [c.177]
Принципы культивирования микроорганизмов. С момента внесения микробов (засева) в питательную среду имеет место индукция их физиологической активности, особенно — в логарифмическую и/или стационарную фазы размножения. При этом одновременно сопряженно протекают многие реакции, катализируемые иммобилизованными или свободными ферментами. В реакции, особенно — на первых этапах, нередко вовлекаются высокомолекулярные вещества с определенной конфигурацией молекул (сравнить такие источники углерода как глюкоза и крахмал или источники азота—аммония сульфат, какая-либо аминокислота и нативный белок). Поэтому следует учитывать специфику выращивания микроорганизмов. [c.378]
Хорошо известно, что именно эти взаимодействия в основном и определяют пространственную структуру белков [81]. Нативный белок существует в водной среде, и природа как бы решает оптимальную задачу — полярные аминокислоты располагаются на поверхности глобулы и взаимодействуют с водой, а неполярные — спрятаны внутрь глобулы и контактируют между собой. Аналогичная ситуация может возникнуть и в полипептидах если растворитель полярный (вода), то полярные аминокислоты стремятся оказаться снаружи в неполярных растворителях следует ожидать противоположного — неполярные аминокислоты будут стремиться оказаться на поверхности. [c.111]
Нативный белок Реактив участвует в реакции в качестве рН-индикатора 509 [c.625]
ВЫХ, размер кристалла хотя бы в одном из направлений дол кен быть не меньше 1 мм, а это значительно превышает размеры большинства белковых кристаллов, полученных обычными методами. Во-вторых, для установления структуры белка на основе данных но дифракции рентгеновских лучей необходимо исследовать не только нативный белок, но и ряд его изоморфных производных. Такие производные могут быть получены введением в белковые- [c.105]
Как уже отмечалось выше, при облучении белков в сухом состоянии (стр. 251) часть радиационного повреждения, состоящая в деструкции белковой цепи, не обязательно проявляется сразу же вследствие упорядоченной структуры молекулы. Однако при нагревании поврежденный белок коагулирует намного легче, чем нативный белок [F8], Поврежденный белок также более чувствителен к денатурации мочевиной [М28]. При дальнейшем изучении физической химии процесса тепловой коагуляции оказалось, что после облучения белок существует в различных состояниях денатурации [F36, F37]. Возможно вследствие этих обстоятельств, действие излучения зависит от физического состояния белка. Например, предварительная обработка азотным аналогом иприта увеличивает действие излучения [К41], [c.258]
Нативный белок-f-КОН — денатурированный щелочной протеинах (А) [c.158]
Таким образом, новый синтез белка в растениях сопровождается значительным расходованием сахаров, в первую очередь дисахаридов. Это дает основания считать, что сахара играют большую роль в процессе синтеза белка в растениях. При современном состоянии вопроса эта роль еще недостаточно ясна. Можно строить лишь те или иные предположения. Можно сделать допущение, что нативный белок в растениях находится в какой-то, может быть, весьма лабильной связи с сахарами. С другой стороны, можно допустить, что процесс синтеза белка сопровождается интенсивным окислением сахаров, в результате которого освобождается энергия, необходимая для активации молекул, вступающих в реакцию синтеза белка, как это было высказано в свое время А. В. Благовещенским (1936). [c.171]
Последнее дает основания считать, что сахара играют большую роль в процессе синтеза белка в растениях. Можно сделать допущение, что нативный белок в растениях находится в [c.183]
Б растениях также мало изменилось. В последующие сроки — через 48 и 96 часов — произошло значительное увеличение белкового азота, сопровождающееся параллельным уменьшением количества сахаров, в первую очередь дисахаридов. Последнее дает основание считать, что сахаря играют большую роль в процессе синтеза белка в растениях. При современном состоянии вопроса эта роль еще недостаточно ясна. Можно сделать предположение о том, что нативный белок в растениях находится в какой-то связи с сахарами. С другой стороны, можно допустить, что процесс синтеза белка в растениях сопровождается интенсивным окислением сахаров, в результате чего освобождается энергия, необходимая для активности молекул аминокислот, вовлекающихся в реакции синтеза белка. [c.56]
Известно, что метгемоглобин — нативный белок — хромопротеид, содержащий трехвалентное железо (РеЗ+), способный к обратимому восстановлению в гемоглобин (Ре2+). [c.70]
На рис. 61 представлены графики селективности сефакрилов для двух вариантов фракционирования белков нативных (глобулярных) и денатурированных, имеющих

Добавить комментарий