Виды протеина по происхождению — SportWiki энциклопедия
Скорость усвоения различных видов белковХарактеристика различных типов, цели применения
Цельный яичный белок имеет наивысшую усвояемость и считается эталонным, относительно которого оцениваются все остальные белки. Как известно куриное яйцо состоит из белка, который практически на 100% состоит из альбумина (овоальбумина) и желтка, который содержит 7 различных белков — альбумин, овоглобулин, коальбумин, овомукоид, овомуцин, лизоцин, авидин.
Также необходимо отметить, что употреблять в пищу большого количества сырых куриных яиц не рекомендуется, так как они содержат ингибитор (вещество значительно замедляющее процесс переваривания) пищеварительного фермента трипсина. Более того, белок авидин, содержащийся в желтке, жадно присоединяет к себе жизненно важный биотин (витамин Н), образуя прочный комплекс, который не переваривается и не усваивается организмом. Поэтому рекомендуют употреблять куриные яйца только после термической обработки (при 70°С разрушается ингибитор трипсина, а при 80° С высвобождается активный биотин из биотин-авидинового комплекса).
Японские и тайваньские учёные решили выяснить влияние яичного белка на организм человека. В эксперименте участвовали три группы женщин — добровольцев. Все они были практически здоровы, но с повышенным уровнем холестерина в крови. Испытуемые ели диетически приготовленную пищу из расчёта 1750 калорий в день с ежедневным потреблением 70 грамм белка. Жир в рационе испытуемых составлял 20 процентов белка от общего числа калорий. Тридцать процентов белка первая группа получала из яичного белка, вторая группа — из сыра, и третья — из соевого сыра. Вес тела и ежедневные физические упражнения оставались неизменными в продолжение всего исследования.
Как выяснилось в результате эксперимента, у групп, получавших протеин из яичного белка и соевого сыра, общий уровень холестерина понизился, причём, у первой группы, кроме того, увеличился уровень «хороших» липопротеинов. У второй группы, получавшей сыр, уровень холестерина в крови возрос.
Эти данные раскрывают полезные качества яичного белка, но как относиться к яйцу в целом?
Ещё одно исследование, опубликованное в «Annals of Nutrition and Metabolism» в 1996г, показало, что употребление яиц в течение дня понижало уровень липопротеинов высокой плотности (полезного холестерина). Считается, что последний препятствует развитию атеросклероза. Хотя на первый взгляд это указывает на то, что яйца не такие уж полезные, более пристальный взгляд помогает найти простое решение. Вызываемый употреблением яиц отрицательный эффект связан с повышенным окислением, которому благоприятствует употребление целых яиц благодаря высокому содержанию в них полиненасыщенного жира. Полиненасыщенные жиры особенно склонны к окислению, включая широко расхваленные омега-3 жиры, содержащиеся в рыбе и льняном масле. Тем не менее, вы можете легко предотвратить повышенное окисление жира просто путём употребления антиоксидантов. Они включают в себя витамины С, Е, РР, селен и бета-каротин. Такие натуральные антиоксиданты стабилизируют полиненасыщенные жиры, предотвращая окисление.
Всё это теория, а как же дело обстоит на практике?
90% бодибилдеров имеют возраст меньше 30 лет и лишены проблем с повышенным уровнем холестерина в крови, эти факторы практически полностью устраняют возможность возникновения патологических изменений в жировом метаболизме выражающихся в гиперхолестеринемии. Кроме того, холестерин — это неотъемлемая часть клеточных мембран, и в растущем организме недостаток холестерина чреват торможением физического развития и другими проблемами. А поскольку бодибилдинг подразумевает, прежде всего, рост мышечной массы, то элементарная логика подсказывает, что расходы холестерина будут выше, чем в популяции. И главное, каждый культурист должен включать в свой рацион дополнительно витамины. Как уже говорилось выше, витамин А, С и Е, обладают выраженными антиоксидантными свойствами, которые обеспечивают практически полную безопасность употребления цельных яиц. Что касается жиров, то при наборе массы тела их количество не повлияет на общие результаты, так как относительное их содержание не так велико. Не надо забывать, что в желтках содержится большое количество витаминов, микроэлементы и биоактивные вещества.
Таким образом, становится понятно, что употребление яиц в пищу целиком не только не опасно, но и полезно, особенно при наборе массы. Если вы снижаете массу тела, то следует отказаться от желтка, но непременно включайте в диету белок.
Для производства пищевых добавок используется как цельный яичный белок, так и отдельно яичный альбумин. Спортивное питание, изготовленное на основе яичного белка, лишено всех недостатков цельных яиц, при полной сохранности полезных качеств, поэтому последний считается одним из самых качественных и эффективных во всех отношениях. Относительно медленное усвоение даёт возможность употреблять яичный белок при снижении массы тела, без страха замедлить процесс похудения.
Читайте также: яйца
Белки молочной сыворотки (лактальбумин, лактоглобулин и иммуноглобулин) имеют наивысшую скорость расщепления среди цельных белков. Концентрация аминокислот и пептидов в крови резко возрастает уже в течение первого часа после приёма питания на основе белков молочной сыворотки. При этом не меняется кислотообразующая функция желудка, что исключает нарушение его работы и образование газов. Усваиваемость белков молочной сыворотки исключительно высока.
Аминокислотный состав сывороточных белков наиболее близок к аминокислотному составу мышечной ткани человека, а по содержанию незаменимых аминокислот и аминокислот с разветвлённой цепью (ВСАА): валина, лейцина и изолейцина, они превосходят все остальные белки животного и растительного происхождения. Кроме того, примерно 14% белков молочной сыворотки находится в виде продуктов гидролиза (аминокислот, ди-, три- и полипептидов), которые являются инициаторами пищеварения и участвуют в синтезе большинства жизненно важных ферментов и гормонов. Также белки молочной сыворотки заметно снижают уровень холестерина в крови.
Учёный по имени Bounous и его коллеги из университета McGill (Канада) провели серию экспериментов, которые показали, что сывороточный протеин значительно превосходит яичный белок, сою, говядину и рыбу в плане улучшения реакций на клеточном и гормональном уровнях. Тщательные анализы показали, что иммуностимулирующее действие сыворотки связано с её аминокислотным составом — сыворотка содержит нужные аминокислоты в нужном количестве. Кроме того, было показано, что сывороточный протеин повышает уровень глутатиона — одного из важнейших антиоксидантов в организме. Богатый опыт практического применения также показывает, что сывороточный протеин — лучший поставщик протеина для атлетов.
Экспериментальным путём установлено, что содержание белка в пищевых добавках на основе белков молочной сыворотки оптимально на уровне 60-65%. Дальнейшее повышение содержания белка требует введения в смесь витаминно-минеральных формул.
Основным источником получения сывороточных белков является сладкая молочная сыворотка, образующаяся при производстве сычужных сыров. Сама по себе сладкая молочная сыворотка не находит применения при производстве пищевых добавок, что связано с низким содержанием белка (около 5 %) и наличием большого количества лактозы (молочного сахара) — основного вещества вызывающего непереносимость молочных продуктов некоторыми людьми.
Концентрат сывороточного протеина[править | править код]
Это первая из полученных форм сывороточного протеина. Сыворотка пропускается через керамические мембраны с невообразимо малыми отверстиями. Они свободно пропускают молекулы жиров и углевода лактозы, но задерживают более крупные белковые фракции. Проблема в том, что получить отверстия одинакового диаметра технически невозможно, поэтому фильтрация не отличается высокой чистотой. На мембране оседает смешанная масса, содержание протеина в которой 35–85%. Таким образом, сывороточный концентрат – не самый чистый протеин на свете. Он может содержать довольно значительное количество жиров и лактозы, которая стимулирует газообразование. Именно поэтому концентрат – самая дешёвая форма сывороточного протеина на рынке спортивного питания, и его можно считать хорошим выходом только при ограниченных финансовых средствах.
Читайте основную статью: Концентрат сывороточного протеина
Изолят сывороточного протеина[править | править код]
Изолят – куда более чистый продукт, чем концентрат. Его получают методом продолжительной фильтрации или ионного обмена. В итоге производитель получает сухую массу, содержащую более 95% белковых фракций. Лактозы и жиров в изоляте почти нет, а это означает, что изолят идеален для приёма с целью восполнения аминокислотного дефицита до и после тренировок. Плюс изолят гораздо дешевле гидролизата, поэтому его могут себе позволить широкие слои населения. Многие производители хитрят и под видом сывороточного протеина продают смесь всех трёх видов белка: изолята, концентрата и гидролизата. Естественно, дешёвого концентрата в таких продуктах больше всего – 60–70%. Следует останавливаться на добавках, в которых изолят является главным или единственным компонентом.
Читайте основную статью: Изолят сывороточного протеина
Гидролизат сывороточного белка[править | править код]
Гидролизат получают методом гидролиза, в процессе которого большие белковые молекулы рассекаются на отдельные фрагменты. Организм получает протеин, готовый к немедленному усвоению, поэтому гидролизат довольно быстро проникает в мышцу. Однако данный вид сывороточного протеина имеет один существенный недостаток – дороговизна. Его могут позволить себе лишь люди со средствами, поскольку гидролизат – самая дорогая разновидность протеина. Кроме того, если Вы видите на этикетке надпись «гидролизат сывороточного белка», не спешите. Современное оборудование позволяет по-разному настраивать гидролиз и за счёт этого экономить. Согласно докладу контролирующих организаций существует немало гидролизатов, которые содержат не более 50% мелких белковых фрагментов.
Сегодня рынок спортивно-медицинского питания предлагает огромное разнообразие форм протеинсодержащих продуктов: это коктейли, причём как в порошках, так и в готовом виде, с множеством разных вкусов, супы, энергетические батончики, белковое печенье, шоколад, белковые пасты, ореховую халву, и всё это можно купить в аптеках. Помимо цельных белков предлагаются смеси всех необходимых аминокислот – в виде порошков, жидких смесей и даже ампулированные формы. Причём предлагаются не только смеси всех аминокислот, но и продукты, содержащие отдельные аминокислоты или комплекс из нескольких компонентов: L-глутамин, предохраняющий мышечную ткань во время интенсивных нагрузок, аминокислоты ВСАА, составляющие основу всего мышечного метаболизма; смесь L-орнитина, L-аргинина и L-лизина для стимуляции секреции соматотропного гормона и др. Аминокислотные комплексы – это уже практически переваренный белок. Поэтому усваиваются они наиболее быстро.
Читайте основную статью: Гидролизат протеина
Как правило, казеин вводится в смеси для детского питания, что по современным представлениям считается биологически оправданным. Так при попадании в желудок казеин створаживается, превращаясь в сгусток, который переваривается продолжительное время, обеспечивая сравнительно низкий темп расщепления белка. Это приводит к стабильному и равномерному поступлению аминокислот в организм интенсивно растущего ребёнка. При нарушении этого ритма усваивания (применение смесей на основе белков молочной сыворотки) приводит к тому, что организм ребёнка на этом этапе развития не успевает усваивать интенсивный поток аминокислот, что может приводить к различного рода отклонениям в развитии ребёнка. Поэтому диетологи рекомендуют для детей, лишённых материнской груди, применять смеси на основе казеина. Что же касается взрослого человека, то низкая усваиваемость, а также медленное прохождение сгустков казеина по желудочно-кишечному тракту неприемлемы, особенно при повышенных физических нагрузках. Поэтому пищевые добавки созданные на основе одного казеина (казеинатов), по всей вероятности, малоэффективны.
Однако выход из положения может быть найден за счёт использования белковых композиций на основе казеина и сывороточных белков. После соответствующих исследований был определён максимальный коэффициент эффективности белка и соответствующие ему пропорции сывороточных белков и казеина. Этой пропорцией оказалось соотношение 63:37 при коэффициенте эффективности белка 3,49. Полученное значение биологической ценности для данного соотношения белков оказалось очень высоким и, судя по данным литературы, не уступающим таковым для других высокоценных белков животного происхождения.
Что касается усваиваемости, то по мере увеличения содержания сывороточных белков она постепенно возрастала. Полученные данные подтвердили известный факт лучшей перевариваемости сывороточных белков пищеварительными ферментами по сравнению с казеином.
Белки в растительности, хотя зачастую и неполноценны, в комбинации друг с другом составляют полноценный белок. Наиболее велико содержание полноценного белка в комбинации бобовые + зерновые. Белки бобовых — соевый и гороховый, богаты незаменимыми аминокислотами и имеют ценность близкую к сывороточным и яичным белками, выраженную в PDCAAS [1].
Как правило в спортивном питании используют высокоочищенные изоляты растительных белков. Плохое усвоение неочищенного растительного белка вызвано несколькими причинами:
- толстые оболочки клеток растений, часто не поддающиеся действию пищеварительных соков
- наличие ингибиторов пищеварительных ферментов в некоторых растениях, например, в бобовых
- трудности расщепления растительных белков до аминокислот
Соевые белки[править | править код]
Соевый белок хорошо сбалансирован по аминокислотам, в том числе и по незаменимым. После потребления соевых белков появляется чёткое снижение уровня холестерина в крови, поэтому их целесообразно использовать в рационе людей с избыточным весом, а также людей страдающих непереносимостью молочных продуктов. Соя содержит необходимые для жизнедеятельности организма витамины и минералы: витамин Е, весь комплекс витаминов В, калий, цинк, железо, фосфор. Соя оказывается очень полезной для здоровья как женщин – она помогает бороться с остеопорозом в пожилом возрасте, снижает риск возникновения рака груди, так и мужчин – здесь она помогает решать проблемы с увеличенной простатой.
Для производства пищевых добавок используются соевая мука (содержит 40-50% белка), соевый концентрат (65-75%) и соевый изолят (свыше 85%).
Однако, в казалось на первый взгляд идеальном продукте есть и недостатки. Одним из таких несовершенств соевого белка является наличие ингибитора пищеварительного фермента трипсина. Его количество зависит от технологии переработки соевых бобов. Для избавления от ингибитора нужна дополнительная обработка белка с помощью ферментативного гидролиза (пятидесятиминутный электрофорез панкреатином).
Также вы, наверняка, слышали, что соевый протеин в больших дозах не рекомендуется принимать мужчинам. Это не совсем так. Соя богата так называемыми фитоэстрогенами. Фитоэстрогены (Phytoestrogens)— это разнородная группа природных не стероидных растительных соединений, которые благодаря своей структуре, сходной с эстрадиолом, женским половым гормоном человека, могут вызывать эстрогенный и (или) антиэстрогенный эффект.
РАСТЕНИЯ, СОДЕРЖАЩИЕ ФИТОЭСТРОГЕНЫ: красный клевер, люцерна, лён, солодка, красный виноград, хмель.
ЗЛАКОВЫЕ и БОБОВЫЕ КУЛЬТУРЫ: пшеница, соя, семена льна, овёс, ячмень, рис, люцерна, чечевица.
Овощи и фрукты: яблоки, морковь, капуста, гранаты и др.
Напитки: бурбон и пиво.
К настоящему времени больше всего известно об фитоэстрогенах, содержащихся в сое. Это в первую очередь изофлавоны генистеин и дайдзеин. Ещё один соевый фитоэстроген — глицитеин накапливается преимущественно в проростках сои. Изофлавоны присутствуют в растениях в основном в виде гликозидов — соединений с сахарами. В кишечнике под действием кишечной микрофлоры гликозиды гидролизуются и распадаются на сахаристую часть и несахаристый компонент, так называемый агликон (то есть «лишённый сахара»). Однако эквол, продукт дальнейшего превращения дайдзеина, по структуре больше всего напоминает эстрадиол.
Эксперименты показали, что фитоэстрогены действительно способны связываться с теми же рецепторами, что и эстрогены, только действуют они гораздо слабее. Если принять эффект эстрадиола за 100, то действие фитоэстрогенов будет оцениваться как 0,001—0,2 (в зависимости от вида фитоэстрогена).
Классическим примером гормонального влияния фитоэстрогенов на млекопитающих стала «клеверная болезнь», встречающаяся у овец и других пастбищных животных. Впервые эту болезнь описали в 40-х годах XX века в Австралии. Фермеры заметили, что у овец, питающихся преимущественно клевером вида Trifolium subterraneum, часто возникают бесплодие и другие нарушения репродуктивной функции. Выяснилось, что виноваты в этом изофлавоны группы биоханин-А и формоно-нетин и куместанов (куместрол) которые оказывают на овец гормоноподобное действие. По-видимому, репродуктивные расстройства у овец, описанные в научной литературе, объясняются, во-первых, огромными дозами поглощённых изофлавонов (человеку ни за что не съесть столько сои), а во-вторых, тем, что в кишечнике травоядных животных эквол (и, возможно, другие активные метаболиты) образуются с большей эффективностью, чем в кишечнике человека. В добавок, в отличие от сои, клевер не является пищевым продуктом и относится к лекарственным растениям и в настоящий момент нет данных о его влиянии на организм человека при длительном и регулярном применении. Экспериментальных данных для обоснования использования экстракта красного клевера вместо настоящих эстрогенов в гормонозаместительной терапии также пока недостаточно.
Читайте основную статью: Соевый протеин
Соевый белок и тестостерон[править | править код]
На просторах интернета часто можно встретить информацию о якобы негативном влиянии сои на уровень тестостерона у мужчин. Только два исследования – среди большого количества исследований, проведённых на эту тему, – нашли связь между снижением уровня тестостерона и потреблением сои. В одном из них потребление изофлавонов среди участников исследования было особенно высоким, в четыре раза превышающим количество, обычно потребляемое мужчинами в Японии.[2] Исследователи также не делали сравнений с контрольной группой, то есть мужчинами, которые не употребляли сою. Поэтому невозможно утверждать, что разница между этими двумя группами существует.
С другой стороны, существуют исследования, показывающие отсутствие каких-либо эффектов на уровень тестостерона, вызванных употреблением сои. Недавний анализ 32 научных исследований показал, что ни соевый белок, ни изофлавоны не оказывают каких-либо эффектов на уровень тестостерона.[3] Учёные проанализировали данные, используя несколько разных статистических моделей. Во всех случаях были получены схожие результаты. Кроме того, исследования, которые были изданы слишком поздно, чтобы быть включёнными в этот анализ, показали то же самое – что соя не влияет на уровень тестостерона. Среди множества исследований, доказывающих, что изофлавоны сои не влияют на уровень тестостерона есть ещё одно, которое, чуть не поставило под сомнение этот факт.
Исследование было проведено в Университете медицины и стоматологии Нью-Джерси и опубликовано в 2007 году: http://www.ncbi.nlm.nih.gov/pubmed/17416779 В этом проекте, 13 мужчин в возрасте от 25 до 47, употребляли 56 граммов соевого протеина в день в течение четырёх недель. Уровень тестостерона измерялся три раза в течение четырёх недель — до начала исследования, после первых двух недель и в конце исследования. В конце исследования, после окончательного измерения, учёные сообщили о 19% снижении уровня тестостерона для испытуемых. Позднее выяснилось, что при публикации результатов была допущена опечатка и имело место подтасовка фактов. Авторы исследования умолчали, что среди испытуемых был мужчина, с уровнем тестостерона вдвое больше нормы. Именно за счёт снижения его уровня тестостерона получились такие данные. Причём концентрация тестостерона у него продолжала падать после прекращения исследования и употребления соевого протеина. Позднее авторы исследования признали, что если бы не падение уровня тестостерона у этого мужчины, то им нечего было бы публиковать.
Таким образом, на сегодняшний день мета-анализ научных данных[4] подтверждает, что соя не подавляет секрецию тестостерона у мужчин. Соевый белок может служить альтернативой животному для мужчин и женщин, является эффективным средством понижения уровня вредного холестерина, профилактики рака и остеопороза, однако менее эффективен для набора мышечной массы, по сравнению с сывороточным.[5] К тому же, отсутствие влияния на уровень тестостерона не свидетельствует об отсутствии эстрогенной активности, которая может приводить к гипогонадизму и даже импотенции.[6]
Гороховый белок[править | править код]
Гороховый протеин, используемый в спортивном питании представляет собой высокоочищенный изолят с содержанием белка 88-90%, обладающий высокой усовяемостью, равной 98% [7]. Гороховый протеин содержит большое количество заменимых и незаменимых аминокислот. В частности, он является рекордсменом по аминокислоте аргинин и содержит её 8,7% на грамм белка, что выше, чем в любом другом источнике белка, в том числе в сое (7,6%), яичном белке (5,1%), казеине (3,8%) и сывороточном белке (2,3%)[8]. Аргинин играет важную роль в реализации потенциала мышц, поскольку помогает высвободить гормон роста, участвует в синтезе креатина, в процессе образования окиси азота, и даже улучшает эректильную функцию[9].
Гороховый белок также богат незаменимой аминокислотой лизином и важной аминокислотой глутамином. Преимущества горохового белка могут быть усилены при сочетании с другими растительными белками, такими как, например, рисовый протеин, так как эти продукты имеют дополняющие аминокислотные профили[10]. Гороховый протеин содержит около 18% ВСАА, что ненамного меньше чем в казеине, который, как правило, содержит 20% ВСАА[11].
Гороховый протеин часто используется в питании спортсменов вегетарианцев или веганов. Горох, содержит в 1000 раз меньше изофлавонов – фитоэстрогенов, чем соя, что позволяет исключить риски влияния потребления протеина на уровень тестостерона и делает гороховый протеин предпочтительным для спортсменов-мужчин[12]. Горох не входит в список основных аллергенов и продуктов, имеющих какие-либо противопоказания [13], что позволяет людям, плохо переносящим те или иные продукты (напр. лактозу/молоко, глютен/злаки, сою, орехи и т.д.), использовать гороховый протеин в своём питании в качестве безаллергенного источника белка.
Читайте основную статью: Гороховый протеин
Мясной протеин крайне богат белком (до 85%), при этом почти половина такого протеина представлена незаменимыми аминокислотами (~35%). У продукта хорошая скорость всасывания, крайне высокий уровень усвоения, практически нулевое содержание жира. Такой комплекс подойдет любому спортсмену и не только, без исключений.
Предполагалось использование изолятов рыбного белка в питании спортсменов. Исследования проводились в НИИ Гигиены Питания Киева. Сравнивалась перевариваемость рыбного изолята, свежей рыбы и казеина. Было установлено, что изолят рыбного белка ещё значительно медленнее, чем казеин расщепляется до аминокислот. Расщепление изолята до пептидов не прекращалось даже через 3 часа с момента введения белка.
Приобретение
- ↑ http://www.hammernutrition.com/hnt/2897/
- ↑ Gardner-Thorpe D, O’Hagen C, Young I, Lewis SJ. Dietary supplements of soya flour lower serum testosterone concentrations and improve markers of oxidative stress in men. Eur J Clin Nutr 2003;57:100-6.
- ↑ Hamilton-Reeves JM, Vazquez G, Duval SJ, Phipps WR, Kurzer MS, Messina MJ. Clinical studies show no effects of soy protein or isoflavones on reproductive hormones in men: Results of a meta-analysis. J Am Dietetic Assoc (in press))
- ↑ Hamilton-Reeves JM, Vazquez G. Clinical studies show no effects of soy protein or isoflavones on reproductive hormones in men: results of a meta-analysis. Fertil Steril. 2010 Aug;94(3):997-1007. Epub 2009 Jun 12.
- ↑ Phillips SM, Tang JE, Moore DR. The role of milk- and soy-based protein in support of muscle protein synthesis and muscle protein accretion in young and elderly persons. J Am Coll Nutr. 2009 Aug;28(4):343-54.
- ↑ Siepmann T, Roofeh J. Hypogonadism and erectile dysfunction associated with soy product consumption.Nutrition. 2011 Jul-Aug;27(7-8):859-62. Epub 2011 Feb 25.
- ↑ http://www.pisane-cosucra.com/what-is-pisane/
- ↑ Pea Protein. The new power veggie. Журнал Muscle&Fitness, August, 2012
- ↑ https://ru.wikipedia.org/wiki/%D0%90%D1%80%D0%B3%D0%B8%D0%BD%D0%B8%D0%BD
- ↑ http://www.bodybuilding.com/fun/wheys-vegan-alternatives-combining-pea-and-rice-protein.html
- ↑ http://www.biprousa.com/blog/view/2-28-2014-plant-protein-versus-dairy-protein-for-muscle-building
- ↑ http://en.wikipedia.org/wiki/Bodybuilding_supplement
- ↑ http://www.tsouz.ru/db/techreglam/Documents/TR%20TS%20PishevayaProd.pdf
какие бывают и чем отличаются?

© nadianb — stock.adobe.com
Выбор протеинового коктейля — дело непростое. На рынке представлено широчайший ассортимент разнообразных товаров. Каждый производитель подчеркивает преимущества своего белка и умело скрывает недостатки. В итоге атлеты неправильно подбирают сырье для своего плана питания, а их результативность снижается.
Какие виды протеина сейчас популярны на рынке, и какой источник белка нужен именно вам? Подробные ответы на эти вопросы вы найдете в статье.
Общие сведения
Базовые сведения о протеинах известны каждому атлету. Однако далеко не все спортсмены могут определить, какой вид белка подойдет именно им для решения той или иной задачи.
Условно разделим цели атлетов:
- набор грязной массы;
- набор чистой массы;
- увеличение силовых показателей;
- увеличение функциональной силы;
- похудение и сушка.
Однако помните, что это не все цели, ради которых люди идут в зал, и уж тем-более – в кроссфит центры. На деле мотивы и задачи более разнообразны.
Чтобы определить, какой протеин подходит для той или иной цели, их разделяют в соответствии с основными параметрами:
- Срок всасывания. Определяет, насколько быстро тот или иной вид белка расщепиться на простейшие аминокислоты, и следовательно, быстрее запустит анаболические восстановительные процессы. Самые быстрые протеины способны заменить аминокислотные. Медленные же наоборот предназначены, чтобы питать организм на протяжении всего дня и уменьшать общий катаболизм.
Примечание: последнее возможно, только в том случае, если у организма достаточно энергии для синтеза аминокислот. В противном случае даже медленный белок будет расщеплен до простейшей энергии и выполнит функцию длинносоставных углеводов, да еще и с выделением ненужных кислот, которые ускорят метаболизм и вызовут острое чувство голода.
- Аминокислотный профиль. Аминокислотный профиль бывает полным и неполным. В случае, если аминокислотный профиль полный – белок называют комплексным. Такой вид протеина позволяет полностью питать организм всеми необходимыми веществами для прогресса, однако он имеет свои минусы. В тоже время, если аминокислотный профиль неполный, уделяют особое внимание внутреннему составу и балансу аминокислот. Это позволяет понять, чего не хватает организму и добавить это из натуральной пищи.
- Нагрузка на ЖКТ. Как ни странно, но гидролизованный белок, который создан для почти мгновенного усваивания, тоже не идеален. В зависимости от вида входящего сырья он может раздражать желудочно-кишечный тракт, что заставит вас дополнительно питать его гейнерами и натуральной пищей либо вовсе не участвовать в общих процессах пищеварения, моментально всасываясь в кровь через печень и почки.
Вот и все, чем обычно руководствуются при выборе протеина.
Какой выбрать


Рассмотрим основные виды протеина в современной фитнес-культуре. Для этого рекомендуем ознакомиться с таблицей. По ней вы быстро выделите нужные исключительно для вас белковые группы и узнаете, как работает тот или иной вид сырьевого белка.
Вид протеиновой смеси | Что собой представляет |
| Казеин | Пролонгированный белок, питающий организм на протяжении всех суток. Имеет неполный аминокислотный профиль. |
| Молочный протеин | Для тех, кто спокойно переносит лактозу. Низкокачественное сырье, неполный аминокислотный профиль. |
| Соевый изолят | Лишен недостатков сои – дешев, но имеет неполный аминокислотный профиль. |
| Комплексный яичный | Обладает полным аминокислотным составом, но очень тяжело переваривается. |
| Гидроизолят | Самый дешевый белок, используемый в классическом питании в качестве добавок к молочным продуктам низкого качества. Неполный аминокислотный профиль. |
| Многокомпонентные смеси | Дает возможность комбинировать из разных дешевых сырьевых протеинов, создавая идеальный комплексный белок. |
На самом деле на рынке присутствует огромное количество гибридов и других источников белка. В последнее время все большую популярность набирает грибной протеин, который продается исключительно в США.
Есть еще и различные сырьевые белки, которые не носят название «протеин», например, пивные дрожжи, которые активно использовались бодибилдерами еще на заре золотой эпохи. Однако рядовому посетителю фитнес-центра приобрести их будет непросто. Кроме того, существует огромное количество факторов, которые мешают полноценному усваиванию белка из этих сырьевых источников.
Подробнее о сывороточном белке
Профайл белка:
- Источник: высушенная сыворотка.
- Аминокислотный профиль: присутствуют основные незаменимые аминокислоты.
- Основная задача: закрытие белкового окна после тренировки.
- Скорость всасывания: предельно высокая.
- Стоимость: относительно невысокая.
- Нагрузка на ЖКТ: относительно невысокая.
- Эффективность: одна из лучших.
Сывороточный протеин – это классика бодибилдинга. Его предельная скорость всасывания сделала его многопрофильным. Он позволяет закрыть катаболические процессы и стимулировать анаболические процессы практически сразу после окончания тренировки. Но самое главное – это его стоимость. Это один из самых дешевых источников качественного белка.


© thaiprayboy — stock.adobe.com
Подробнее о казеине
Профайл белка:
- Источник: гидролизованный белок из творожной массы.
- Аминокислотный профиль: присутствуют основные незаменимые аминокислоты.
- Основная задача: комплексное питание пролонгированного действия основными незаменимыми аминокислотами.
- Скорость всасывания: предельно низкая.
- Стоимость: один из самых дорогих видов протеинов для набора массы.
- Нагрузка на ЖКТ: достаточно сильно загружает желудочно-кишечный тракт. Возможны запоры и другие дисфункции пищеварительной системы.
- Эффективность: при неправильном применении нулевая. При правильном применении полностью останавливает катаболические процессы в комбинировании с другими средствами спортивного питания.
Как и сывороточный белок, считается одним из классических методов поддержания постоянного синтеза нового мышечного белка. По причине своих особенностей его принимают в основном в ночное время, когда пищеварительная система не способна работать на полную катушку — казеин постепенно растворяясь питает все на протяжении всей ночи.
Молоко must-have
Профайл белка:
- Источник: молочное сырье
- Аминокислотный профиль: присутствуют основные незаменимые аминокислоты.
- Основная задача: закрытие белкового окна после тренировки.
- Скорость всасывания: предельно низкая.
- Стоимость: относительно невысокая.
- Нагрузка на ЖКТ: высокая. Возможны запоры и прочие дисфункции пищеварительной системы.
- Эффективность: довольно низкая.
Более дешевая версия сывороточного белка. Не получила широкого распространения из-за большей нагрузки на ЖКТ и наличия лактозы, которая ограничивает прием белка до 60 г в сутки. Имеет более широкий аминокислотный профиль.
Соевый изолят
Профайл белка:
- Источник: сложно гидролизованный соевый субстрат.
- Аминокислотный профиль: неполный. Требует дополнительного питания со стороны основной пищи.
- Основная задача: питание аминокислотами атлетов, не употребляющих мясные и молочные продукты. Генерация фитоэстрогенов для женщин, позволяющая избежать проблем, связанных с изменением гормонального цикла.
- Скорость всасывания: предельно низкая.
- Стоимость: относительно невысокая.
- Нагрузка на ЖКТ: серьезная. Возможны запоры и другие дисфункции пищеварительной системы.
- Эффективность: довольно низкая.
Первые попытки создать идеальный растительный белок. При правильной закупке обойдется в десятки раз дешевле, чем сывороточный протеин. В отличие от классического соевого протеина, соевый изолят почти полностью лишен фитоэстрогенов, однако его ценность для атлетов силового профиля все еще находиться под большим вопросом.
Комплексный яичный
Профайл белка:
- Источник: яичный порошок.
- Аминокислотный профиль: полный аминокислотный профиль. Присутствуют все необходимые и незаменимые аминокислоты для роста атлета.
- Основная задача: комплексное питание пролонгированного действия основными незаменимыми аминокислотами.
- Скорость всасывания: предельно низкая.
- Стоимость: один из самых дорогих протеинов.
- Нагрузка на ЖКТ: высокая. Возможны запоры и другие дисфункции пищеварительной системы
- Эффективность: наивысшая.
Практически идеальный белок, созданный из яичного порошка. Имеет в своем составе все необходимые для роста аминокислоты. Единственный недостаток — побочный эффект в виде запоров, который практически не минуем при постоянном употреблении
Гидролизат – куда уж дешевле
Профайл белка:
- Источник: неизвестен.
- Аминокислотный профиль: неполный. Требует дополнительного питания со стороны основной пищи.
- Основная задача: питание аминокислотами атлетов, не употребляющих мясные и молочные продукты. Генерация фитоэстрогенов для женщин, чтобы избежать проблем связанных с изменением гормонального цикла.
- Скорость всасывания: варьируется в зависимости от качества изначального сырья
- Стоимость: относительно невысокая.
- Нагрузка на ЖКТ: высокая. Вероятны запоры и другие дисфункции пищеварительной системы.
- Эффективность: довольно низкая.
Гидролизат протеина был популярным разрекламированным средством несколько лет назад. В это время он был одним из самых дорогих источников белка. Однако в дальнейшем выяснилось, что из-за полной гидратации белка невозможно определить его изначальное сырье, при этом некоторые аминокислоты под воздействием такой гидратации утрачивали свои изначальные части, что практически полностью нивелировало их ценность для атлета.


Многокомпонентный белок
Профайл белка:
- Источник: варьируется в зависимости от входящих компонентов.
- Аминокислотный профиль: присутствуют основные незаменимые аминокислоты.
- Основная задача: закрытие белкового окна после тренировки
- Скорость всасывания: варьируется в зависимости от входящих компонентов.
- Стоимость: варьируется в зависимости от входящих компонентов.
- Нагрузка на ЖКТ: зависит от состава.
- Эффективность: зависит от входящих компонентов.
Обычно это комплексный субстрат, который должен включать в себя преимущества каждого из белков, нивелируя недостатки. Стоит покупать только у проверенных производителей.
Итоги
Теперь вы знаете, какие виды протеина бывают и для чего они подходят. А самое главное – как использовать преимущества того или иного вида белка, чтобы достичь поставленной вами цели.
Однако не стоит забывать главную премудрость силового спорта. Как бы сильно вы не увлекались белковыми коктейлями:
- Сделайте так, чтобы большая часть вашего белка поступала из натуральной пищи.
- Не употребляйте белок сверх меры. Даже лучший протеин все равно может посадить вашу мочевую систему и почки, что значительно снизит радость от достижения показателей.
И не забывайте про энергетический баланс, который достигается избытком калорийности.
Оцените материал
Научный консультант проекта. Физиолог (биологический факультет СПБГУ, бакалавриат). Биохимик (биологический факультет СПБГУ, магистратура). Инструктор по хатха-йоге (Институт управления развитием человеческих ресурсов, проект GENERATION YOGA). Научный сотрудник (2013-2015 НИИ акушерства, гинекологии и репродуктологии им. Отта, работа с маркерами женского бесплодия, анализ биологических образцов; 2015-2017 НИИ особо чистых биопрепаратов, разработка лекарственных средств) Автор и научный консультант сайтов по тематике ЗОЖ и науке (в области продления жизни) C 2019 года научный консультант проекта Cross.Expert.
Редакция Cross.Expert
Белок-белковые взаимодействия — Википедия
 Белок-белковое взаимодействие подковообразного ингибитора рибонуклеазы (показана каркасная модель) с рибонуклеазой. Контакты между двумя белками показаны цветными пятнами
Белок-белковое взаимодействие подковообразного ингибитора рибонуклеазы (показана каркасная модель) с рибонуклеазой. Контакты между двумя белками показаны цветными пятнамиБелок-белковые взаимодействия (ББВ) — обладающие высокой специфичностью физические контакты между двумя и более белками. Эти контакты образуются в результате биохимических событий с помощью электростатических взаимодействий, в том числе гидрофобного эффекта[en][1].
Белки — важные макромолекулы как для внутриклеточных, так и для внешних процессов. Белки редко действуют в одиночку: для участия в различных жизненно важных процессах внутри клетки эти макромолекулы с помощью белок-белковых взаимодействий собираются в мультибелковые комплексы. Белок-белковые взаимодействия составляют основу интерактома любой живой клетки[1]. Они участвуют в таких важных клеточных процессах, как передача сигнала, клеточное общение, транскрипция, репликация, мембранный транспорт и другие. Поэтому неудивительно, что нарушения этих взаимодействий приводят ко многим заболеваниям, таким как болезнь Крейтцфельдта — Якоба, болезнь Альцгеймера и рак[2].
Не все белок-белковые взаимодействия образуются раз и навсегда. Часть белков входит в состав стабильных комплексов, которые являются молекулярными машинами (например, АТФ-синтаза или цитохромоксидаза). Другие же белки собираются обратимо для осуществления какой-либо временной функции (например, для активации экспрессии генов в случае с транскрипционными факторами и активаторами)[1].
Белок-белковые взаимодействия рассматриваются со стороны биохимии, квантовой химии, молекулярной динамики, передачи сигналов в клетке[3]. Полученная информация позволяет создавать обширные сети белковых взаимодействий, похожих на метаболические или генетические/эпигенетические связи. Это расширяет текущие знания о биохимических каскадах и патогенезе заболеваний, а также открывает новые возможности для поиска новых терапевтических мишеней.
Белки могут «временно» связываться друг с другом или же образовывать «стабильные» мультибелковые комплексы. При этом белковые комплексы могут быть как гетеро-, так и гомоолигомерными. Классическими примерами ББВ являются взаимодействия фермент-ингибитор и антитело-антиген, но помимо них ББВ могут возникать между двумя доменами или же доменом и пептидом[1].
Гомо- и гетероолигомеры[править | править код]
Гомоолигомеры — макромолекулярные комплексы, состоящие только из одного типа белковых субъединиц. Если же связь образуется между неидентичными белковыми цепями, то образуется гетероолигомер. Гетероолигомеры разнятся по своей стабильности, а для большинства гомоолигомерных комплексов характерна симметричность и стабильность. Разборка гомоолигомеров зачастую требует денатурации[4]. Некоторые ферменты, транспортные белки, факторы транскрипции выполняют свою функцию будучи гомоолигомерами. Взаимодействия между разными белками играют большую роль в клеточной передаче сигналов.
Обязательные и необязательные взаимодействия[править | править код]
Для разделения ББВ на обязательные и необязательные нужна информация о стабильности участвующих во взаимодействии белков (мономеров) в свободном состоянии и в составе белкового комплекса. Если мономеры стабильны in vivo только в составе комплекса, то взаимодействие между ними является обязательным. В результате обязательных взаимодействий формируются обязательные или облигатные комплексы. Если же белки могут существовать независимо, то они участвуют в необязательных ББВ. Большинство макромолекулярных машин в клетке являются примерами обязательных взаимодействий[2]. К обязательным комплексам относятся человеческий катепсин D и димер ДНК связывающего белка P22 Arc repressor, а необязательных взаимодействий — взаимодействие RhoA с RhoGAP и тромбина со своим ингибитором родниином[5].
Постоянные и временные взаимодействия[править | править код]
ББВ можно разделить по времени жизни комплекса. Постоянные взаимодействия обычно очень стабильны: белки, взаимодействуя, образуют постоянныей комплекс. Они часто присутствуют в гомоолигомерах (например, Цитохром с) и в некоторых гетероолигомерах (например, субъединицы АТРазы). Временные взаимодействия постоянно образуются и разрушаются. Они могут возникать при взаимодействии гормона с рецептором, передаче клеточного сигнала. Такой тип взаимодействия широко распространён в сигнальных и регуляторных путях[2].
Ковалентные и нековалентные взаимодействия[править | править код]
Ковалентные связи — наиболее прочные и образуются в случае обмена электронами (например, дисульфидные связи). Хотя эти связи редко встречаются при белок-белковых взаимодействиях, в некоторых посттрансляционных модификациях они являются определяющими (например, убиквитирование и навешивание SUMO белков). Нековалентные связи обычно образуются во временных взаимодействиях за счет комбинаций слабых связей: водородных, ионных, ван-дер-ваальсовых или гидрофобных[6].
Переход из неструктурированного в структурированное состояние[править | править код]
Отдельно можно выделить ББВ, которые образуются частично неструктурированными белками[en]. В таких белках есть участки, аминокислотная последовательность которых не позволяет образовать стабильной третичной структуры. Эти белки могут взаимодействать с другими, подбирая подходящую конформацию для образования связи с партнёром[2].
Трёхмерная структура белковых комплексов[править | править код]
Молекулярные структуры многих белковых комплексов были разрешены с помощью рентгеноструктурного анализа[7][8]. Первой такой структурой был миоглобин кашалота[9]. Позднее для определения трёхмерной структуры белковых комплексов также стали применять ЯМР. Так, например, одной из первых была получена структура кальмодулин-связанных доменов, взаимодействующих с кальмодулином[8][10]. Этот метод хорошо подходит для определения слабых белок-белковых взаимодействий[11].
Домены[править | править код]
Благодаря развитию методов разрешения трёхмерной структуры белков удалось выделить структурные домены, которые участвуют в образовании ББВ. Такими, например, являются:
- Sh3-домен, связывающий фосфорилированные белки;
- Sh4-домен, специфичный к пролин-богатым последовательностям;
- PTB-домен, взаимодействующий с последовательностями, содержащими фосфотирозиновую группу;
- LIM-домен, содержащий цистеин-богатый мотив цинкового пальца и способный связываться с PDZ-доменом и себе подобными;
- SAM-домен, связывающий белки, не содержащие данный домен;
- PDZ-домен, узнающий мотив S/TXV на C-конце белка, а также LIM-домены или себе подобные;
- FERM-домен, способный связывать PI(4,5)P2 (фосфоинозитол-4,5-бисфосфат)[12].
Биологические эффекты белок-белковых взаимодействий[править | править код]
Белок-белковые взаимодействия играют важную роль во многих биологических процессах. Функция и активность белка в большинстве случаев изменяются при связывании с белками-партнёрами. Они могут оказывать значительное влияние на кинетические параметры фермента за счёт аллостерического эффекта, приводить к его инактивации (например, при связывании фермента с ингибитором) или к изменению специфичности фермента к своему субстрату[13].
Помимо этого, взаимодействие белков друг с другом может приводить к формированию нового центра связывания для субстрата на поверхности взаимодействия двух молекул. За счёт взаимодействия двух или более ферментов друг с другом становится возможным туннелирования субстрата[en], что увеличивает эффективность ферментативных реакций за счёт стабилизации интермедиатов и повышения их локальной концентрации[13].
Методы изучения белок-белковых взаимодействий[править | править код]
Существует множество методов изучения белок-белковых взаимодействий[13]. Некоторые из них позволяют экспериментально определять белки-партнёры для изучаемого белка, другие — лишь верифицировать возможное взаимодействие двух белков. Для подтверждения партнёрства двух белков используется бимолекулярная флуоресцентная комплементация (BiFC), FRET-методы, Far-Western, дрожжевая двугибридная система. Для решения задачи обнаружения белков-партнёров используется коиммунопреципитация с последующей аффинной хроматографией и масс-спектрометрией, система AviTag с промискуитетной BirA-лигазой. Основной проблемой в применении данных методов является возможная неспецифичность белка, который определился как входящий в состав белкового комплекса.
Дрожжевой двугибридный анализ[править | править код]
 Принципы в основе двугибридных систем для дрожжей и млекопитающих
Принципы в основе двугибридных систем для дрожжей и млекопитающихДвугибридные дрожжи позволяют in vivo выявлять парные ББВ (бинарный метод), а также неспецифичные липкие взаимодействия (sticky interactions)[14].
Клетки дрожжей трансфецируются двумя плазмидами: наживкой — интересующим нас белком с прилинкованным ДНК-связывающим доменом дрожжевого фактора транскрипции, например Gal4, и добычей — библиотекой кДНК (cDNA) фрагментов, прикреплённых к активирующему домену транскрипционного фактора. Если добыча и наживка взаимодействуют, два домена транскрипционного фактора соединяются и становятся функциональными. Таким образом, по присутствию результатов продукции репортерного гена можно судить о наличии взаимодействия между белками[6][15].
Несмотря на всю полезность, у дрожжевой двугибридной системы имеется ряд ограничений: относительно низкая специфичность; использование дрожжей в качестве основного хозяйского организма, что может приводить к проблемам при исследовании других биологических систем; относительно низкое количество обнаруживаемых ББВ, поскольку некоторые белки со слабыми связями теряются в процессе выделения[16] (к примеру, плохо обнаруживаются мембранные белки[17][18]). Ограничения преодолеваются использованием различных вариантов двугибридной системы, например мембранным дрожжевым двугибридом (membrane yeast two-hybrid)[18], сплит-убиквитиновыми системами[15], которые не ограничены взаимодействиями только внутри ядра; и бактериальными двугибридными системами (с использованием бактерий, соответственно)[19].
Афинная хроматография с последующей масс-спектрометрией[править | править код]
 Принцип тандемной аффиной хроматографии
Принцип тандемной аффиной хроматографииАффинная хроматография с последующей масс-спектрометрией позволяет обнаруживать, в основном, стабильные взаимодействия, тем самым лучше отражая функциональные ББВ, существующие в живой клетке (in vivo)[14][15]. При использовании этого метода сначала выделяют помеченный белок, экспрессируемый в клетке обычно в in vivo концентрациях, и взаимодействующие с ним белки (афинная хроматография). Один из наиболее выигрышных и широко используемых методов для выделения протеинов в случае сильного фонового загрязнения — это метод тандемной афинной хроматографии[en]. ББВ могут быть качественно и количественно проанализированы различными масс-спектрометрическими методами: химическим слиянием, биологическим или метаболическими слиянием (SILAC), или методами без использования меток[4].
Вычислительные способы предсказания ББВ[править | править код]
Так как до сих пор нет полных данных интерактома и не все ББВ обнаружены, при реконструкции сигнальных или метаболических карт взаимодействий используют различные вычислительные методы. Они позволяют устранить пробелы, предсказывая наличие тех или иных взаимодействий между узлами сети. С помощью вычислительных методов можно предсказать не только возможность ББВ, но также и их силу[2].
Ниже приведено несколько вычислительных подходов предсказания ББВ:
- Поиск событий слияния генов или доменов белков: слияния генов[en], что часто также означает слияние доменов, можно использовать для поиска функциональной связи между белками. При этом используется предположение, что слиянию этих генов в течение эволюции способствовал отбор[20].
- Методы сравнительной геномики и кластеризации генов: часто гены, которые кодируют белки со схожей функцией или взаимодействующие друг с другом белки, находятся в одном опероне (в случае бактерий) или совместно регулируются (корегуляция) (в случае эукариот). Такие гены обычно близко расположены в геноме. Методы кластеризации генов оценивают вероятность совместной встречаемости ортологов белков, которые кодируют гены из одного кластера. Такие подходы помогают выявлять скорее функциональное взаимодействие между белками, чем их физический контакт[2].
- Методы, основанные на филогенетических профилях: в таких методах предполагают, что если негомологичные белки функционально связаны, то существует вероятность того, что они могут вступать в ББВ и коэволюционировать. Для того чтобы найти функциональную связь между белками, используют кластеризацию по филогенетическим профилям[en] этих белков или же оценивают вероятность совместной встречаемости белков в различных протеомах[2]. Идея того, что у взаимодействующих друг с другом белков часто схожие по топологии филогенетические деревья, используется в методе «mirror tree»[21].
- Способы предсказания на основе гомологии: данный подход предполагает, что исследуемые белки будут взаимодействовать друг с другом, если известно, что их гомологи вступают во взаимодействие. Такие пары белков из разных организмов, которые сохранили в течение эволюции способность взаимодействовать друг с другом, называются интерологами[en]. Примерами сервисов, использующих данный метод, являются PPISearch и BIPS[2].
- Предсказание, основанное на данных коэкспрессии генов: если исследуемые белки кодируют гены с похожими паттернами экспрессии (схожий профиль и уровень экспрессии) в разные временные промежутки, то можно предположить, что эти белки функционально связаны и, возможно, как-то взаимодействуют друг с другом[22].
- Методы на основе сетевой топологии: сети ББВ можно представить в виде графа, где узлами являются белки, а каждое ребро обозначает взаимодействие между белками. С помощью математической интерпретации сети ББВ (например, в виде матрицы смежности) можно определить, как белки функционально связаны между собой, а также предсказать новые ББВ. Если у двух белков очень много общих партнёров в сети, то скорее всего они принимают участие в одном биологическом процессе и потенциально могут взаимодействовать друг с другом[2].
- In-Silico Two-Hybrid подход: главное предположение данного метода — взаимодействующие друг с другом белки коэволюционируют, чтобы сохранить функциональность. Данный метод анализирует множественные выравнивания белкового семейства и ищет скоррелированные мутации для предсказания ББВ и поиска оснований, входящих в участок связывания[23].
- Предсказание ББВ, основанное на структуре белков: такой подход позволяет не только выяснить, могут ли белки взаимодействовать, но и охарактеризовать это взаимодействие (например, его физические характеристики или аминокислоты, входящие в состав поверхности взаимодействия двух белков). Одним из методов, использующих трёхмерную структуру белков, является докинг. Сюда же относят методы, которые предполагают эволюционную консервативность оснований, входящих в состав поверхности взаимодействия. Таким образом, на основе уже известных структур можно предсказать, как будет выглядеть мультимолекулярный комплекс исследуемых белков[2].
- Методы, основанные на машинном обучении или интеллектуальном анализе текста: на основе машинного обучения был разработан метод предсказания ББВ, который использует только последовательности исследуемых белков[24]. Это позволяет проанализировать, хотя и менее точно, бóльшее число возможных взаимодействий, так как для работы используются только аминокислотные последовательности. Интеллектуальный анализ текста ищет связь между белками, рассматривая их взаимное упоминание в предложениях или параграфах различных текстовых блоков[25].
Крупномасштабные поиски ББВ позволили выявить сотни тысяч взаимодействий, информация о которых была собрана в специализированных биологических базах данных (БД). Эти базы постоянно обновляются с целью предоставить полный интерактом. Первой такой базой стала База Данных Взаимодействующих Белков(DIP)[en][26]. С момента её появления число публичных баз данных продолжает расти. Эти БД можно разделить на три класса: первичные, мета-БД и БД предсказаний[1].
- Первичные БД собирают информацию об опубликованных ББВ, чье существование доказано в мелко- или крупномасштабных экспериментах. Например, к ним можно отнести DIP, Biomolecular Interaction Network Database (BIND), Biological General Repository for Interaction Datasets (BioGRID), Human Protein Reference Database (HPRD), IntAct Molecular Interaction Database, Molecular Interactions Database (MINT), MIPS Protein Interaction Resource on Yeast (MIPS-MPact) и MIPS Mammalian Protein-Protein Interaction Database (MIPS-MPPI)[1].
- Мета-БД обычно являются результатом объединения данных из первичных баз, но могут и впоследствии пополняться оригинальной информацией. Примеры: Agile Protein Interaction DataAnalyzer (APID), The Microbial Protein Interaction Database (MPID8) и Protein Interaction Network Analysis (PINA) platform[1].
- БД предсказанных ББВ заполняются результатами, полученными с использованием различных техник. Примеры: Michigan Molecular Interactions (MiMI), Human Protein-Protein Interaction Prediction Database (PIPs), Online Predicted Human Interaction Database (OPHID), Known and Predicted Protein-Protein Interactions (STRING), а также Unified Human Interactome (UniHI)[1].
 Визуализация интерактома человека, где точки обозначают белки, а соединяющие их синие линии — взаимодействия между белками
Визуализация интерактома человека, где точки обозначают белки, а соединяющие их синие линии — взаимодействия между белкамиИнформация, содержащаяся в базах ББВ, позволяет строить сети белковых взаимодействий. Сеть ББВ для одного конкретного белка вполне возможно описать, например, с помощью текста. Но задача создания диаграммы всевозможных внутриклеточных ББВ поистине сложна и трудноизобразима. Одним из примеров вручную созданной молекулярной карты взаимодействий является карта контроля клеточного цикла, созданная Куртом Коном (Kurt Kohn) в 1999 году[27]. Базируясь на карте Кона, Швиковски (Schwikowski) и др. в 2000 году опубликовали карту ББВ в дрожжах, объединившую 1548 взаимодействующих протеина, информация о которых была получена методом двугибридного анализа. При визуализации для первоначального расположения вершин использовался метод послойного изображения графа, а затем полученное изображение было улучшено за счет применения силового (force based) алгоритма[28][29].
Чтобы упростить сложную задачу визуализации, были разработаны различные биоинформатические инструменты, которые также позволяют сочетать информацию о ББВ с другими типами данных. К примеру, широко используется пакет с открытым исходным кодом Cytoscape, к которому доступна масса плагинов[1][30]. Для визуализации и анализа очень больших сетей подходит пакет Pajek[31].
Важная роль ББВ в физиологических и патологических процессах является хорошей мотивацией для расширения интерактома. В качестве примеров уже опубликованных интерактомов можно привести thyroid-специфичный интерактом DREAM[32] и PP1α-интеракто в человеческом мозге[33].
- ↑ 1 2 3 4 5 6 7 8 9 De Las Rivas, J.; Fontanillo, C. Protein-protein interactions essentials: key concepts to building and analyzing interactome networks (англ.) // PLoS computational biology : journal. — 2010. — Vol. 6, no. 6. — P. e1000807. — PMID 20589078.
- ↑ 1 2 3 4 5 6 7 8 9 10 Keskin, O.; Tuncbag, N; Gursoy, A. Predicting Protein–Protein Interactions from the Molecular to the Proteome Level (англ.) // Chemical Reviews (англ.)русск. : journal. — 2016. — Vol. 116, no. 8. — P. 4884—4909. — PMID 27074302.
- ↑ Herce, H.D.; Deng, W.; Helma, J.; Leonhardt, H.; Cardoso, M.C. Visualization and targeted disruption of protein interactions in living cells (англ.) // Nature Communications (англ.)русск. : journal. — Nature Publishing Group, 2013. — Vol. 4. — P. 2660. — PMID 24154492.
- ↑ 1 2 Jones, S.; Thornton, J.M. Principles of protein-protein interactions (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1996. — Vol. 93, no. 1. — P. 13—20. — PMID 8552589.
- ↑ Nooren, I.M.; Thornton, J.M. Diversity of protein-protein interactions (англ.) // EMBO J. (англ.)русск. : journal. — 2003. — Vol. 22, no. 14. — P. 3486—3492. — PMID 12853464.
- ↑ 1 2 Westermarck, J.; Ivaska, J.; Corthals, G.L. Identification of protein interactions involved in cellular signaling (англ.) // Molecular & cellular proteomics : MCP : journal. — 2013. — Vol. 12, no. 7. — P. 1752—1763. — PMID 23481661.
- ↑ Janin J., Chothia C. The structure of protein-protein recognition sites. (англ.) // The Journal of biological chemistry. — 1990. — Vol. 265, no. 27. — P. 16027—16030. — PMID 2204619.
- ↑ 1 2 Bruce, A.; Johnson, A.; Lewis, J.; Raff, M.; Roberts, K.; Walter, P. Molecular biology of the cell (неопр.). — 4th. — New York: Garland Science (англ.)русск., 2002. — ISBN 0-8153-3218-1.
- ↑ Kendrew, J.C.; Bodo, G.; Dintzis, H.M.; Parrish, R.G.; Wyckoff, H.; Phillips, D.C. A three-dimensional model of the myoglobin molecule obtained by x-ray analysis (англ.) // Nature : journal. — 1958. — Vol. 181, no. 4610. — P. 662—666. — PMID 13517261.
- ↑ Wand, A.J.; Englander, S. W. Protein complexes studied by NMR spectroscopy (неопр.) // Current opinion in biotechnology. — 1996. — Т. 7, № 4. — С. 403—408. — PMID 8768898.
- ↑ Vinogradova, O.; Qin, J. NMR as a unique tool in assessment and complex determination of weak protein-protein interactions (англ.) // Topics in current chemistry : journal. — 2012. — Vol. 326. — P. 35—45. — PMID 21809187.
- ↑ Berridge, M.J. Cell Signalling Biology: Module 6 – Spatial and Temporal Aspects of Signalling (англ.) // Biochemical Journal (англ.)русск. : journal. — 2012. — DOI:10.1042/csb0001006.
- ↑ 1 2 3 Phizicky E. M., Fields S. Protein-protein interactions: methods for detection and analysis. (англ.) // Microbiological reviews. — 1995. — Vol. 59, no. 1. — P. 94—123. — PMID 7708014.
- ↑ 1 2 Brettner L. M., Masel J. Protein stickiness, rather than number of functional protein-protein interactions, predicts expression noise and plasticity in yeast. (англ.) // BMC systems biology. — 2012. — Vol. 6. — P. 128. — DOI:10.1186/1752-0509-6-128. — PMID 23017156.
- ↑ 1 2 3 Wodak, S.J.; Vlasblom, J.; Turinsky, A.L.; Pu, S. Protein-protein interaction networks: the puzzling riches (англ.) // Current opinion in structural biology : journal. — 2013. — Vol. 23, no. 6. — P. 941—953. — PMID 24007795.
- ↑ Rajagopala, S.V.; Sikorski, P.; Caufield, J.H.; Tovchigrechko, A.; Uetz, P. Studying protein complexes by the yeast two-hybrid system (англ.) // Methods : journal. — 2012. — Vol. 58, no. 4. — P. 392—399. — PMID 22841565.
- ↑ Stelzl, U.; Wanker, E.E. The value of high quality protein-protein interaction networks for systems biology (англ.) // Current opinion in chemical biology : journal. — 2006. — Vol. 10, no. 6. — P. 551—558. — PMID 17055769.
- ↑ 1 2 Petschnigg, J.; Snider, J.; Stagljar, I. Interactive proteomics research technologies: recent applications and advances (англ.) // Current opinion in biotechnology : journal. — 2011. — Vol. 22, no. 1. — P. 50—8. — PMID 20884196.
- ↑ Battesti, A; Bouveret, E. The bacterial two-hybrid system based on adenylate cyclase reconstitution in Escherichia coli (англ.) // Methods : journal. — 2012. — Vol. 58, no. 4. — P. 325—334. — PMID 22841567.
- ↑ Enright, A. J.; Iliopoulos, I.; Kyrpides, N.C.; Ouzounis, C.A. Protein Interaction Maps for Complete Genomes Based on Gene Fusion Events (англ.) // Nature : journal. — 1999. — Vol. 402, no. 6757. — P. 86—90. — PMID 10573422.
- ↑ Pazos, F.; Valencia, A. Similarity of Phylogenetic Trees as Indicator of Protein-Protein Interaction (англ.) // Protein Eng., Des. Sel. : journal. — 2001. — Vol. 14, no. 9. — P. 609—614. — PMID 11707606.
- ↑ Jansen, R.; IGreenbaum, D.; Gerstein, M. Relating Whole- Genome Expression Data with Protein-Protein Interactions (англ.) // Genome Res. (англ.)русск. : journal. — 2002. — Vol. 12, no. 1. — P. 37—46. — PMID 11779829.
- ↑ Pazos, F.; Valencia, A. In Silico Two-Hybrid System for the Selection of Physically Interacting Protein Pairs (англ.) // Proteins: Struct., Funct., Genet. : journal. — 2002. — Vol. 47, no. 2. — P. 219—227. — PMID 11933068.
- ↑ Shen, J.; IZhang, J.; Luo, X.; Zhu, W.; Yu, K.; Chen, K.; Li, Y.; Jiang, H. Predicting protein-protein interactions based only on sequences information (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. — Vol. 104, no. 11. — P. 4337—4341. — PMID 17360525.
- ↑ Papanikolaou, N.; Pavlopoulos, G.A.; Theodosiou, T.; Iliopoulos, I. Protein-protein interaction predictions using text mining methods (англ.) // Methods : journal. — 2015. — Vol. 74. — P. 47—53. — PMID 25448298.
- ↑ Xenarios I., Rice D. W., Salwinski L., Baron M. K., Marcotte E. M., Eisenberg D. DIP: the database of interacting proteins. (англ.) // Nucleic acids research. — 2000. — Vol. 28, no. 1. — P. 289—291. — PMID 10592249.
- ↑ Schwikowski B., Uetz P., Fields S. A network of protein-protein interactions in yeast. (англ.) // Nature biotechnology. — 2000. — Vol. 18, no. 12. — P. 1257—1261. — DOI:10.1038/82360. — PMID 11101803.
- ↑ Rigaut G., Shevchenko A., Rutz B., Wilm M., Mann M., Séraphin B. A generic protein purification method for protein complex characterization and proteome exploration. (англ.) // Nature biotechnology. — 1999. — Vol. 17, no. 10. — P. 1030—1032. — DOI:10.1038/13732. — PMID 10504710.
- ↑ Prieto C., De Las Rivas J. APID: Agile Protein Interaction DataAnalyzer. (англ.) // Nucleic acids research. — 2006. — Vol. 34. — P. 298—302. — DOI:10.1093/nar/gkl128. — PMID 16845013.
- ↑ Michael Kohl, Sebastian Wiese, and Bettina Warscheid (2011) Cytoscape: Software for Visualization and Analysis of Biological Networks. In: Michael Hamacher et al. (eds.), Data Mining in Proteomics: From Standards to Applications, Methods in Molecular Biology, vol. 696, DOI 10.1007/978-1-60761-987-1_18
- ↑ Raman, K. Construction and analysis of protein-protein interaction networks (англ.) // Automated experimentation : journal. — 2010. — Vol. 2, no. 1. — P. 2. — PMID 20334628.
- ↑ Rivas, M.; Villar, D.; González, P.; Dopazo, X.M.; Mellstrom, B.; Naranjo, J.R. Building the DREAM interactome (неопр.) // Science China. Life sciences. — 2011. — Т. 54, № 8. — С. 786—792. — PMID 21786202.
- ↑ Esteves, S.L.; Domingues, S.C.; da Cruz e Silva, O.A.; Fardilha, M.; da Cruz e Silva, E.F. Protein phosphatase 1α interacting proteins in the human brain (англ.) // Omics : a journal of integrative biology : journal. — 2012. — Vol. 16, no. 1—2. — P. 3—17. — PMID 22321011.
Мембранные белки — Википедия
Материал из Википедии — свободной энциклопедии
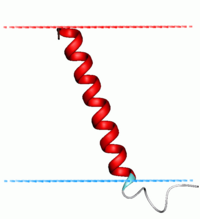
К мембранным белкам относятся белки, которые встроены в клеточную мембрану или мембрану клеточной органеллы или ассоциированы с таковой. Около 25 % всех белков являются мембранными.[1]
Мембранные белки могут быть классифицированы по топологическому или биохимическому принципу. Топологическая классификация основана на том, сколько раз белок пересекает липидный бислой. В соответствии с этим критерием белки подразделяются на монотопические, битопические и политопические:
- монотопические белки взаимодействуют с одной поверхностью мембраны и не пересекают её;
- битопические пронизывают мембрану насквозь и взаимодействуют с обеими её поверхностями;
- политопические пронизывают мембрану несколько раз (многократное взаимодействие с липидами).
Понятно, что первые относятся к периферическим белкам, а вторые и третьи к интегральным.
 Различные категории политопических белков. Связывание с мембраной за счёт (1) единичной трансмембранной альфа-спирали, (2) множественных трансмембранных альфа-спиралей, (3) бета-складчатой структуры.
Различные категории политопических белков. Связывание с мембраной за счёт (1) единичной трансмембранной альфа-спирали, (2) множественных трансмембранных альфа-спиралей, (3) бета-складчатой структуры.  Различные категории интегральных монотопических белков. Связывание с мембраной за счёт (1) амфипатической альфа-спирали, параллельной плоскости мембраны, (2) гидрофобной петли, (3) ковалентно соединённого жирнокислотного остатка, (4) электростатического взаимодействия (прямого или кальций-опосредованного).
Различные категории интегральных монотопических белков. Связывание с мембраной за счёт (1) амфипатической альфа-спирали, параллельной плоскости мембраны, (2) гидрофобной петли, (3) ковалентно соединённого жирнокислотного остатка, (4) электростатического взаимодействия (прямого или кальций-опосредованного).Топологическая классификация[править | править код]
По отношению к мембране мембранные белки делятся на поли- и монотопические.
- Политопические, или трансмембранные, белки полностью пронизывают мембрану и, таким образом, взаимодействуют с обеими сторонами липидного бислоя. Как правило, трансмембранный фрагмент белка является альфа-спиралью, состоящей из гидрофобных аминокислот (возможно от 1 до 20 таких фрагментов). Только у бактерий, а также в митохондриях и хлоропластах трансмембранные фрагменты могут быть организованы как бета-складчатая структура (от 8 до 22 поворотов полипептидной цепи).
- Интегральные монотопические белки постоянно встроены в липидный бислой, но соединены с мембраной только на одной стороне, не проникая на противоположную сторону.
Биохимическая классификация[править | править код]
По биохимической классификации мембранные белки делятся на интегральные и периферические.
- Интегральные мембранные белки прочно встроены в мембрану и могут быть извлечены из липидного окружения только с помощью детергентов или неполярных растворителей. По отношению к липидному бислою интегральные белки могут быть трансмембранными политопическими или интегральными монотопическими.
- Периферические мембранные белки являются монотопическими белками. Они либо связаны слабыми связями с липидной мембраной, либо ассоциируют с интегральными белками за счёт гидрофобных, электростатических или других нековалентных сил. Таким образом, в отличие от интегральных белков они диссоциируют от мембраны при обработке соответствующим водным раствором (например, с низким или высоким pH, с высокой концентрацией соли или под действием хаотропного агента). Эта диссоциация не требует разрушения мембраны.
Мембранные белки могут быть встроены в мембрану за счёт жирнокислотных или пренильных остатков либо гликозилфосфатидилинозитола, присоединённых к белку в процессе их посттрансляционной модификации.
- ↑ Stevens T.J. and Arkin I.T. (2000) Do more complex organisms have a greater proportion of membrane protein in their genomes?, Proteins, vol. 39(4):417-420
Беличьи — Википедия
Материал из Википедии — свободной энциклопедии
| Беличьи | |||
|---|---|---|---|
 | |||
промежуточные ранги
| |||
Sciuridae Fischer-Waldheim, 1817 | |||
Бе́личьи (устар. бе́лковые, устар. векшевидные[1], лат. Sciuridae) — семейство млекопитающих отряда грызунов.
К беличьим относятся разнообразные по внешнему виду и образу жизни животные, объединяемые единством происхождения и сходством анатомического строения. Размеры мелкие и средние. Длина тела от 6 (мышиная белка) до 60 см (сурки). По внешнему виду беличьих можно разделить на 3 типа: на древесных беличьих, наземных беличьих и летяг, причём считается, что общие предки были наиболее близки к древесным беличьим. У древесных беличьих, к которым относятся собственно белки, длинные пушистые хвосты, острые когти и крупные уши, иногда с кисточками. У летяг по бокам тела, между запястьями и лодыжками имеется кожная перепонка, позволяющая им планировать. Наземные беличьи отличаются более плотным телосложением и короткими, сильными передними конечностями. У всех беличьих задние конечности длиннее передних, но не более чем в 2 раза. Задние конечности 5-, передние 4- или 5-палые. IV палец на передних и задних конечностях наиболее длинный. Волосяной покров густой и мягкий. Окраска однотонная или с полосами и пятнами, варьирует от чёрной и белой до рыжей или тёмно-жёлтой. Сосков от 2 до 6 пар. Зубов всего 20—22. Коренные зубы с корнями, с каждой стороны верхней челюсти их по 5 (у одного вида — 4), нижней — по 4. Жевательная поверхность коренных зубов бугорчатая или бугорчато-гребенчатая. Передний верхний предкоренной зуб всегда меньше других; у белок он в виде тонкого столбика, а у персидской белки вообще отсутствует.
Распространены беличьи очень широко. Отсутствуют в Австралийской области, на Мадагаскаре, в полярных областях, в северо-западной Африке (Сахара) и на юге Южной Америки (Патагонии, Чили, большей части Аргентины). В Северном полушарии ископаемые остатки беличьих встречаются с олигоцена. Населяют самые разнообразные ландшафты: от тропических дождевых лесов до арктической тундры. В горах встречаются до нижней кромки ледников. Ведут наземный или древесный образ жизни. Активны главным образом днём; летяги — преимущественно ночью. Питаются разнообразными растительными кормами (семенами, орехами, грибами), реже насекомыми и мелкими позвоночными. Наземные виды кормятся преимущественно зеленью. Виды в умеренных областях ареала делают запасы на зиму или впадают в зимнюю спячку. Образ жизни одиночный, иногда колониальный. Древесные беличьи как правило строят гайна, в то время как наземные беличьи обитают в норах. Для некоторых видов отмечены дальние миграции. Длительность беременности 22—45 дней. Самки приносят от 1 до 15 голых и слепых детёнышей.
Ряд видов имеет промысловое значение и добывается ради меха или мяса. В семействе есть вредители сельского хозяйства (ряд сусликов) и переносчики опасных заболеваний человека (некоторые сурки, суслики).
Семейство включает 48 родов, объединяемых в пять подсемейств. По количеству видов (280) беличьи уступают только семейству мышиных[2].
- Подсемейство Ratufinae
- Подсемейство Sciurillinae
- Подсемейство Sciurinae
- Триба Sciurini
- Триба Pteromyini
- Подсемейство Callosciurinae
- Подсемейство Xerinae
- Триба Xerini
- Триба Protoxerini
- Триба Marmotini
G-белки — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 июля 2019; проверки требуют 4 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 июля 2019; проверки требуют 4 правки. У этого термина существуют и другие значения, см. G.
G-белки (англ. G proteins) — это семейство белков, относящихся к ГТФазам и функционирующих в качестве вторичных посредников во внутриклеточных сигнальных каскадах. G-белки названы так, поскольку в своём сигнальном механизме они используют замену GDP на GTP как молекулярный функциональный «выключатель» для регулировки клеточных процессов.
G-белки были обнаружены и исследованы Альфредом Гилманом и Мартином Родбеллом, которые получили за это открытие Нобелевскую премию по физиологии и медицине 1994 года[1].
G-белки делятся на две основных группы — гетеротримерные («большие») и «малые». Гетеротримерные G-белки — это белки с четвертичной структурой, состоящие из трёх субъединиц: альфа(α), бета (β) и гамма (γ). Малые G-белки — это белки из одной полипептидной цепи, они имеют молекулярную массу 20—25 кДа и относятся к суперсемейству Ras малых ГТФаз. Их единственная полипептидная цепь гомологична α-субъединице гетеротримерных G-белков. Обе группы G-белков участвуют во внутриклеточной сигнализации.
Гетеротримерные G-белки[править | править код]
У всех гетеротримерных G-белков сходный механизм активации: они активируются при взаимодействии со специфическими рецепторами, сопряженными с G-белками, при этом обменивая ГДФ на ГТФ и распадаясь на α- и βγ-субъединицы. α-субъединица, связанная с ГТФ, воздействует на следующее звено в цепи передачи сигнала. βγ-субъединица также может вызывать собственные эффекты. Инактивация G-белков происходит в результате медленного гидролиза ГТФ до ГДФ α-субъединицей, после чего происходит реассоциация (объединение) субъединиц.
Некоторые G-белки и их функции[править | править код]
Gs – сопряжение возбуждающих рецепторов с аденилатциклазой; Gi – сопряжение тормозных рецепторов с аденилатциклазой; Go – сопряжение рецепторов с ионными каналами; Gq – сопряжение рецепторов, активирующих фосфолипазу C.
В работе многих G-белков участвуют вспомогательные белки. GAPs (GTPase Activating Proteins, белки-активаторы ГТФазной активности) ускоряют гидролиз ГТФ, ускоряя инактивацию G-белков. Особенно важна функция GAPs для малых G-белков, так как альфа-субъединицы гетеротримерных G-белков часто сами обладают достаточной ГТФ-азной активностью. К GAP-белкам относятся белки семейства RGS.
GEFs (Guanine nucleotide Exchange Factors, факторы обмена гуаниловых нуклеотидов), ускоряют обмен ГДФ на ГТФ и таким образом активируют G-белки. Обычно для G-белка GEF-ом служит активированный лигандом рецептор, однако в некоторых случаях белки AGS (Activator of G-protein Signaling, активаторы передачи сигнала G-белками) могут активировать G-белок независимо от воздействия на него рецептора.
- ↑ Press Release: The Nobel Assembly at the Karolinska Institute decided to award the Nobel Prize in Physiology or Medicine for 1994 jointly to Alfred G. Gilman and Martin Rodbell for their discovery of «G-proteins and the role of these proteins in signal transduction in cells». 10 October 1994
- Eric R. Kandel, James H. Schwartz, Thomas M. Jessell. Principles of neural science (неопр.). — New York: McGraw-Hill Education, 2000.
- Lodish et al. 2000. Molecular Cell Biology 4th ed. W.H. Freeman and Company, New York.
- Voet, Donald and Judith G. Voet. 1995. Biochemistry 2nd ed. John Wilely & Sons, New York.
- Gilman A. G proteins: transducers of receptor-generated signals (англ.) // Annu Rev Biochem (англ.)русск. : journal. — 1987. — Vol. 56. — P. 615—649.
- Neves S.R., Ram P.T., Iyengar R. G Protein Pathways (англ.) // Science. — 2002. — Vol. 296. — P. 1636—1639.
Семейство белков — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 января 2016; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 января 2016; проверки требует 1 правка. Семейство белков циклофилина человека. Сходство в структуре изомеразных белковых доменов некоторых его членов.
Семейство белков циклофилина человека. Сходство в структуре изомеразных белковых доменов некоторых его членов.Семейство белков — это группа эволюционно связанных белков, обладающих гомологичной аминокислотной последовательностью. Этот термин почти синонимичен термину «семейство генов», поскольку, если белки имеют гомологичные аминокислотные последовательности, то и кодирующие их гены также должны проявлять значительную степень гомологии в нуклеотидных последовательностях ДНК. Этот термин не следует путать с термином «семейство» в таксономии видов живых организмов.
Также как и для многих других биологических терминов, использование понятия семейство белков сильно зависит от контекста: оно может обозначать большую группу белков с едва заметной гомологией первичных последовательностей, или очень узкую группу белков с почти одинаковой первичной структурой, функцией, и трёхмерной организацией, или любой другой промежуточный случай. Чтобы различить две эти крайние ситуации, Дайхофф ввёл понятие белкового суперсемейства[1][2][3]. С течением времени были придуманы такие понятия как класс, группа, клан и подсемейство, но всех их постигла судьба такого же двусмысленного употребления. В общепринятом употреблении подразумевается, что суперсемейство (структурная гомология) содержит семейства (гомология первичной последовательности), которые содержат подсемейства. Следовательно, суперсемейства такие как клан PA протеаз имеют более низкий уровень консервативных последовательностей, чем одно из семейств входящих в него, например семейство C04. Представляется маловероятным, что в ближайшее время появится точное определение с чёткими критериями, а следовательно читателю предстоит самому решить, как именно понимать эти термины в каждом конкретном контексте.
![Сверху представлены консервативные последовательности 250 белков из клана PA протеаз (суперсемейство). Ниже, консервативные последовательности 70 белков из протеазного семейства C04. Стрелочки указывают на остатки каталитической триады[en]. Выравнивание выполнено при помощи алгоритма DALI](/800/600/https/upload.wikimedia.org/wikipedia/commons/thumb/e/ee/PA_clan_vs_C04_family_sequence_conservation.png/1000px-PA_clan_vs_C04_family_sequence_conservation.png)
.
Концепция белкового семейства зародилась во времена, когда было ещё очень мало белков с известной первичной и третичной структурой; в основном были исследованы небольшие, однодоменные белки такие как миоглобин, гемоглобин, и цитохром c. С тех пор обнаружилось, что многие белки содержат множество структурно и функционально независимых единиц или доменов. Из-за происходившей в ходе эволюции рекомбинации генов разные домены развивались независимо. По этой причине в последние годы всё больше внимания уделяют семействам белковых доменов. Целый ряд онлайн ресурсов посвящён определению и каталогизированию таких доменов (см. список в конце статьи).
Части каждого белка имеют разные структурные ограничения (то есть особенности строения необходимые для сохранения структуры и функции протеина). Например, для функционирования активного центра фермента необходимо, что бы определённые аминокислотные остатки были очень точно расположены относительно друг друга в трёхмерном пространстве. С другой стороны, белок-белковое взаимодействие может происходить по большой поверхности и иметь ограничения по гидрофобности или гидрофильности аминокислот. Функционально значимые части белков эволюционируют медленнее, чем неконсервативные регионы такие как поверхностные петли, и дают начало блокам консервативных последовательностей. Такие блоки принято называть мотивами. Как и в предыдущем случае, их определению и каталогизации посвящён целый ряд онлайн ресурсов.
В соответствии с существующими на данный момент представлениями, семейства белков могут образовываться двумя путями. В первом случае, происходит разделение родительского вида на два генетически изолированных вида-потомка, что позволяет гену/белку независимо накапливать вариации (мутации) в этих двух линиях. В результате, образуется семейство ортологичных белков, обычно имеющих общий консервативный мотив. Второй путь — это дупликация гена и появления паралога. Поскольку первая копия гена всё ещё способна выполнять свою функцию, то дубликат может свободно изменяться и приобретать новые функции (путём случайных мутаций). Некоторые семейства генов/белков, особенно у эукариот, входе эволюции подвергаются значительному копированию или редукции, иногда вместе с удвоением всего генома.
![Сверху представлены консервативные последовательности 250 белков из клана PA протеаз (суперсемейство). Ниже, консервативные последовательности 70 белков из протеазного семейства C04. Стрелочки указывают на остатки каталитической триады[en]. Выравнивание выполнено при помощи алгоритма DALI](/800/600/https/upload.wikimedia.org/wikipedia/commons/thumb/a/ae/RAStree.png/800px-RAStree.png) Филогенетическое дерево суперсемейства Ras-белков
Филогенетическое дерево суперсемейства Ras-белковПоскольку общее число белков с известной структурой растёт, а интерес к протеомному анализу увеличивается, то осуществляются попытки организовать белки в семейства и описать их домены и мотивы. Достоверное выделение белковых семейств жизненно необходимо для филогенетического анализа, определения функции белка, исследования множественности функции белка в данной филогенетической группе. Enzyme Function Initiative (EFI) использует семейства и суперсемейства белков как базис для создания стратегии широкомасштабного таксономического распределения энзимов с неизвестной функцией[4].
Алгоритмические средства для установления семейства белка, основаны на понятии подобия. Большую часть времени единственное сходство к которому у нас есть доступ, это гомология первичной структуры.
Ресурсы, посвящённые семействам белков[править | править код]
Существует немало биологических баз данных, посвящённых семействам белков и позволяющих быстро установить, является ли вновь открытый и идентифицированный белок членом уже известного семейства белков. В частности:
Существуют также специализированные поисковые механизмы:
- BLAST— поиск по последовательностям ДНК
- BLASTp— поиск по последовательностям белков
- ↑ Dayhoff M. O. Computer analysis of protein sequences. (англ.) // Federation proceedings. — 1974. — Vol. 33, no. 12. — P. 2314—2316. — PMID 4435228. [исправить]
- ↑ Dayhoff M. O., McLaughlin P. J., Barker W. C., Hunt L. T. Evolution of sequences within protein superfamilies // Die Naturwissenschaften. — 1975. — Апрель (т. 62, № 4). — С. 154—161. — ISSN 0028-1042. — DOI:10.1007/BF00608697. [исправить]
- ↑ Dayhoff M. O. The origin and evolution of protein superfamilies. (англ.) // Federation proceedings. — 1976. — Vol. 35, no. 10. — P. 2132—2138. — PMID 181273. [исправить]
- ↑ Gerlt John A., Allen Karen N., Almo Steven C., Armstrong Richard N., Babbitt Patricia C., Cronan John E., Dunaway-Mariano Debra, Imker Heidi J., Jacobson Matthew P., Minor Wladek, Poulter C. Dale, Raushel Frank M., Sali Andrej, Shoichet Brian K., Sweedler Jonathan V. The Enzyme Function Initiative // Biochemistry. — 2011. — 22 ноября (т. 50, № 46). — С. 9950—9962. — ISSN 0006-2960. — DOI:10.1021/bi201312u. [исправить]
- ↑ Gandhimathi A., Nair A. G., Sowdhamini R. PASS2 version 4: an update to the database of structure-based sequence alignments of structural domain superfamilies. (англ.) // Nucleic acids research. — 2012. — Vol. 40. — P. D531–534. — DOI:10.1093/nar/gkr1096. — PMID 22123743. [исправить]

Добавить комментарий