Фенилацетон — Википедия
Материал из Википедии — свободной энциклопедии
| Фенилацетон | |
|---|---|
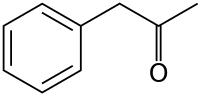 ( {{{картинка}}}) | |
| Систематическое наименование | 1-фенилпропан-2-он |
| Сокращения | P2P, Ф-2-П, БМК |
| Традиционные названия | Бензилметилкетон, 1-фенилацетон, фенил-2-пропанон, 1-фенил-2-пропанон |
| Хим. формула | C9H10O |
| Молярная масса | 134,18 г/моль |
| Плотность | 1,0±0,1 г/см³ |
| Температура | |
| • плавления | −15[1] |
| • кипения | 216[1] °C |
| • воспламенения | 87 °C |
| Показатель преломления | 1,507 |
| Рег. номер CAS | 103-79-7 |
| PubChem | 7678 |
| Рег. номер EINECS | 203-144-4 |
| SMILES | |
| InChI | |
| ChEBI | 52052 |
| ChemSpider | 21106366 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фенилацето́н (сокращённо P2P, от англ. Phenyl-2—Propanone или Ф-2-П), также известный как бензилметилкетон, — органическое соединение, бесцветная или желтоватая жидкость с приятным запахом.
Вещество используется при синтезе веществ класса фенилалкиламинов, включая метамфетамин и амфетамин в качестве исходного вещества или интермедиата.
Один из простых примеров органического синтеза фенилацетона — реакция Фриделя — Крафтса бензола с хлорацетоном.
Фенилацетон также может быть получен и из других соединений. Например:
При синтезе амфетамина из фенилацетона используется либо реакция Лейкарта, либо восстановительное аминирование в присутствии металлического катализатора. Для восстановления может использоваться алюмогидрид лития, цианоборогидрид натрия, амальгама алюминия, никель Ренея, либо щелочной катализатор Урушибара (в автоклаве).
Средняя цена фенилацетона — 100 € за 1 кг, но на чёрном рынке в Европе стоимость может доходить до 900 € за 1 кг[6].
Законное использование[править | править код]
Европейское бюро по борьбе с мошенничеством и Международный комитет по контролю над наркотиками перечисляют следующих легальных производителей фенилацетона: Япония, Китай, Франция, Индия и США
Вещество используется в фармацевтической промышленности в некоторых странах при изготовлении лекарственных средств группы психостимуляторов. Помимо этого, фенилацетон используется в производстве бензил-радикалов путём фотолиза, применяющихся для синтеза пропилгекседрина (англ.)[6].
В Турции и США фенилацетон присутствует в пятновыводителях и чистящих средствах[6].
Нелегальное использование[править | править код]
Фенилацетон используется нелегально для синтеза амфетамина и метамфетамина.
При употреблении амфетамина человеком в организме образуется неактивный метаболит — фенилацетон. Метаболизация происходит путём окислительного дезаминирования. Затем происходит окисление фенилацетона до бензойной кислоты и её конъюгирование с глицином с образованием гиппуровой кислоты. Дезаминирование, вероятно, затрагивает подсемейство ферментов CYP2C цитохрома Р450 [7].
У употребляющих амфетамин менее 1 % образовавшегося фенилацетона выводится с мочой, в основном выводится гиппуровая кислота — 16—28 %[8].
До апреля 2010 года входил в список IV прекурсоров, оборот которых в Российской Федерации ограничен и в отношении которых устанавливаются меры контроля в соответствии с законодательством и международными договорами РФ. После выхода Постановления Правительства Российской Федерации от 21 апреля 2010 года № 255 внесён в список I наркотических средств и психотропных веществ, оборот которых в Российской Федерации запрещён в соответствии с законодательством Российской Федерации и международными договорами Российской Федерации[9]. Для целей 228, 228.1, 229 И 229.1 УК РФ значительным размером вещества считается 1 гр, крупным — 10 гр, особо крупным — 2 кг[10].
В США входит в список II контролируемых субстанций (англ.) с 11 февраля 1980 года[11]
- ↑ 1 2 Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. Phenylaceton (нем.)
- ↑ Г. Дженкинс, У. Хартунг. Фенамин // Химия органических лекарственных препаратов. — М., 1949. — С. 390. — 746 с.
- ↑ Самаренко В. Я. Текст лекций по курсу «Химическая технология лекарственных субстанций». — Санкт-Петербургская Государственная Химико-Фармацевтическая Академия (СПХФА). — С. 104.
- ↑ Snow, 1998, с. 93.
- ↑ Snow, 1998, с. 89.
- ↑ 1 2 3 4 Организация Объединённых Наций. 1-фенил-2-пропанон // Бюллетень по наркотическим средствам. — 2008. — С. 35. — 282 с. — ISBN 978-92-1-448027-3.
- ↑ Donald G. Barceloux. Ampheramine and Methamphetamine. Biotransformation // Medical Toxicology of Drug Abuse: Synthesized Chemicals and Psychoactive Plants. — John Wiley & Sons, 2012. — С. 8. — 904 с.
- ↑ Steven B. Karch, MD, FFFLM. Amphetamine. Metabolism and Excretion // Drug Abuse Handbook. — CRC Press, 2006. — С. 170. — 1288 с. — ISBN 978-0-8493-1690-6.
- ↑ Постановление от 21 апреля 2010 г. № 255 «О внесении изменений в некоторые акты Правительства Российской Федерации в связи с совершенствованием контроля за оборотом наркотических средств, психотропных веществ и их прекурсоров»
- ↑ Постановление от 1 октября 2012 г. № 1002 об утверждении значительного, крупного и особо крупного размеров наркотических средств и психотропных веществ Архивная копия от 11 сентября 2014 на Wayback Machine // ФСКН
- ↑ Controlled Substances Act Schedule II (21 CFR 1308.12) (англ.)
- Otto Snow. Amphetamine Syntheses Overview & Reference guide for Professionals. — 1998. — 257 с. — ISBN 0-9663128-0-5.
Синтез фенилацетона из 📊 анилина
Этилформиат вступает в альдольную конденсацию довольно своеобразным способом, и поэтому этому вопросу посвящен спе циальный раздел (о других конденсациях Кляйзена см. гл. 11 Кетоны , разд. Е.2, и гл. 14 с0фиры карбоновых кислот , разд. В.1). Имеется ряд таких реакций [1]. Если кетон содержит две различные активные метиленовые группы, как, например, метилэтилкетон, конденсация может протекать по любой алкильной группе с образованием альдегидов I и И, что и наблюдалось р дост аточной Степени [2]. Согласно Роху, даже в случае фенилацетона предпочтительнее формилирование метильного углерода, хотя продукт, получаемый из этого соединения, легко превращается вновь в исходное соединение, в результате чего происходит конденсация по метиленовому звену [3].
Синтез фенилацетона(черновик)
Санкт-Петербургская Государственная Химико-Фармацевтическая Академия (СПХФА). — С. 104.
- , с. 93.
- , с. 89.
- ↑ Организация Объединённых Наций .1-фенил-2-пропанон// Бюллетень по наркотическим средствам. — 2008. — С. 35. — 282 с. — ISBN 978-92-1-448027-3 .
- Donald G. Barceloux.Ampheramine and Methamphetamine. Biotransformation// Medical Toxicology of Drug Abuse: Synthesized Chemicals and Psychoactive Plants. — John Wiley & Sons, 2012. — С. 8. — 904 с.
- Steven B. Karch, MD, FFFLM.Amphetamine. Metabolism and Excretion// Drug Abuse Handbook.
— CRC Press, 2006. — С. 170. — 1288 с. — ISBN 978-0-8493-1690-6 . - Постановление от 21 апреля 2010 г.
Фенилацетон
ИнфоЗатем происходит окисление фенилацетона до бензойной кислоты и её конъюгирование с глицином с образованием гиппуровой кислоты. Дезаминирование, вероятно, затрагивает подсемейство ферментов CYP2C цитохрома Р450[7]. У употребляющих амфетамин менее 1 % образовавшегося фенилацетона выводится с мочой, в основном выводится гиппуровая кислота — 16—28 %[8].
Правовой статус До апреля 2010 года входил в список IV прекурсоров, оборот которых в Российской Федерации ограничен и в отношении которых устанавливаются меры контроля в соответствии с законодательством и международными договорами РФ. После выхода Постановления Правительства Российской Федерации от 21 апреля 2010 года № 255 внесён в список I наркотических средств и психотропных веществ, оборот которых в Российской Федерации запрещён в соответствии с законодательством Российской Федерации и международными договорами Российской Федерации[9].
- Бензальдегид реагирует с нитроэтаном, образуя фенил-2-нитропропен, который при восстановлении в кислой среде превращается в фенилацетон. В качестве катализатора используется бутиламин.
- Цианистый бензил реагирует с этилацетатом в присутствии этилата натрия, образуя α-фенилацетоацетонитрил, затем производится гидролиз нитрильной группы и декарбоксилирование кислоты. Выход — 80 %.
- Фенилуксусная кислота дистиллируется с ацетатом свинца или кальция с получением фенилацетона, ацетона и дифенилкетона.
- Также можно получать фенилацетон путём кипячения фенилуксусной кислоты с уксусным ангидридом в присутствии ацетата натрия (безводного)[2].
Уксусный ангидрид и ацетат натрия нагреваются около 2 часов, а затем добавляется фенилуксусная кислота и производится кипячение около 20 часов (при температуре 145 °С)[3].
Способ получения фенилацетона
На деле конденсация по метильному углеродному атому, по-видимому, преобладает в тех случаях, когда для конденсации используют растворители, свободные от спиртов. Если исключить проблему формилирования кетона по двум атомам углерода, протекает реакция конденсации и выходы достигают 50—80%, однако необходимо очень осторожно обращаться с продуктом, так как он склонен к дальнейшей полимеризации или конденсации с образованием более сложных структур [4]. Обычно продукт выделяют в виде натриевой соли [5, 6],.
но при быстрой экстракции охлажденного подкисленного раствора натриевой соли можно получить и свободную кислоту. Приведен пример нежелательной с точки зрения получения альдегидов конденсации [7] [c.76] Советские химики О. Ю. Магидсон и Г. А.
Справочник химика 21
Источник информации: Рубцов М.В., Байчиков А.Г. «Синтетические химико-фармацевтические препараты» М. 1971 стр. 38-39Смесь 37,5 кг (368 моль) уксусного ангидрида и 5 кг (60,7 моль) безводного ацетата натрия нагревают при кипении 2 часа, прибавляют 12,5 кг (92 моль) фенилуксусной кислоты и кипятят при перемешивании 18-20 часов. Затем отгоняют в вакууме 5 кг уксусного ангидрида, охлаждают до 60 С и прибавляют 20 л воды. Реакционную массу нагревают 1,5 ч при 90-100 С, прибавляют еще 60 л воды и экстрагируют метилбензилкетон хлороформом.
К хлороформным экстрактам (около 20 кг) прибавляют 17 кг 32-36% водного раствора гидросульфита натрия, перемешивают при 15-17 С 5-6 часов и оставляют на 8-10 часов. Образовавшееся бисульфитное производное отфильтровывают и тщательно промывают хлороформом.
Синтез фенилацетона
ВажноНелегальное использование Фенилацетон используется нелегально для синтеза амфетамина и метамфетамина . Метаболит При употреблении амфетамина человеком в организме образуется неактивный метаболит — фенилацетон. Метаболизация происходит путём окислительного дезаминирования .
Затем происходит окисление фенилацетона до бензойной кислоты и её конъюгирование с глицином с образованием гиппуровой кислоты . Дезаминирование, вероятно, затрагивает подсемейство ферментов CYP2C цитохрома Р450 . У употребляющих амфетамин менее 1 % образовавшегося фенилацетона выводится с мочой, в основном выводится гиппуровая кислота — 16—28 % .
Правовой статус До апреля 2010 года входил в список IV прекурсоров , оборот которых в Российской Федерации ограничен и в отношении которых устанавливаются меры контроля в соответствии с законодательством и международными договорами РФ.
способ получения фенилацетона — патент РФ 2245321
Изобретение относится к способу получения фенилацетона путем взаимодействия фенилуксусной кислоты с уксусной кислотой в газовой фазе при их мольном соотношении 1:2-5, на катализаторе, содержащем смесь окиси кальция и окиси магния, при температуре не ниже 350°С, при этом нагрузка на катализатор составляет 2,2-8,8 кг исходной смеси /(кг кат час). Способ обеспечивает повышение выхода до 79,9-82,6%.
Изобретение относится к способу получения фенилацетона, являющегося полупродуктом для получения широкого ряда биологически активных веществ. В частности, на основе фенилацетона получают витамин B12, различные родентициды индандионового ряда.
Известен способ получения фенилацетона путем взаимодействия цианистого бензила с этилацетатом в среде этилата натрия при температуре 45°С (пат. РФ №2144766, авт. свид. СССР №1037441). Основным недостатком способа является низкий выход готового продукта 51-58 мас.% и очень большое количество водносолевых отходов, которые образуются на стадии нейтрализации избытка серной кислоты щелочью.
Известен способ получения фенилацетона путем взаимодействия фенилуксусной кислоты с уксусной кислотой в газовой фазе на различных катализаторах. Так в патентах США №2612524 в качестве катализатора использовали смесь окиси магния и гидроокиси магния. В патенте Германии №2758113 в качестве катализатора использовали диоксид циркония и (или) диоксид тория. Общим недостатком этих способов является, прежде всего, низкий выход готового продукта — не выше 61%, кроме того, диоксид тория является радиоактивным соединением.
Наиболее близким способом является способ получения фенилацетона путем взаимодействия фенилуксусной кислоты с уксусной кислотой в газовой фазе на катализаторе при температуре процесса 440°С (пат. Японии №8198796). Исходная смесь состоит из фенилуксусной кислоты — 2 об.%, уксусной кислоты — 20 об.%, азота в качестве инерта — 78 об.%. Катализатором являлась смесь окиси магния с окисью сурьмы в соотношении 1:0,1 соответственно. Процесс ведут с объемной скоростью газового потока 4615 ч-1 Катализатор использовали в таблетированном виде, либо наносили на носитель сферической или цилиндрической формы. Выход фенилацетона — 68,2%.
Недостатком прототипа является низкий выход фенилацетона, использование большого избытка уксусной кислоты, необходимость разбавления смеси исходных кислот большим количеством азота.
Цель данного изобретения — повышение выхода и увеличение производительности, уменьшение отходов производства, упрощение технологии получения фенилацетона.
Поставленная цель достигается за счет использования способа получения фенилацетона в газовой фазе путем взаимодействия фенилуксусной кислоты с уксусной кислотой, взятой в избытке, на катализаторе, содержащем смесь окиси кальция и окиси магния. Процесс ведут при температуре не ниже 350°С и мольном соотношение фенилуксусной кислоты к уксусной кислоте 1:(2-5), при этом нагрузка на катализатор составляет 2,2-8,8 кг исходной смеси /(кг кат час). Используя заявляемый способ исключается разбавление исходной смеси азотом.
Механизм получения фенилацетона из смеси фенилуксусной и уксусной кислоты в газовой фазе сводится к образованию смешанного ацетата, являющегося невыделяемым полупродуктом, который под воздействием температуры разлагается на фенилацетон и карбонат соответствующего металла (в зависимости от вида катализатора). Этим фактором обуславливаются температуры, при котором идет процесс. В патенте Японии №8198796 указывают на то, что в случае использования катализатора, содержащего окись магния, температура процесса не должна быть ниже 250°С, а в случае катализатора, содержащего окись кальция, не ниже 450°С. Как предполагают авторы, в системе со временем устанавливается декомпозиционное равновесие между окисью металла и его карбонатом. Если не придерживаться данных температур, весь катализатор перейдет в карбонат, и, тем самым, дезактивируется. Этим авторы объясняют отсутствия активности у окиси бария из-за его большой температуры разложения карбоната (1450°С), несмотря на то, что он является щелочноземельным металлом.
Это утверждение не оправдано. В настоящем изобретении использовалась смесь окиси кальция с окисью магния, причем некоторые эксперименты ставились так, что изначально в качестве катализатора присутствовали только карбонаты этих металлов. Но диоксид углерода выделялся без промедления, реакция получения фенилацетона шла с выходами, превышающими выходы в вышеописанном патенте Японии. Из этого следует, что процесс может проходить и в том случае, когда в качестве катализатора присутствует только карбонат металла. Также в литературе описано применение ацетатов бария или кальция для получения фенилацетона (Apitzch H.Uber die Einwirkund von Schewefelkoh-lenstoff und Atzkali auf ketone. 1905. Vol.38. S.2897. Bowman Ludlam E. The preparation of Mixed Ketones by Heating the Mixed Calcium salts of org. Acids. J. Chem. Soc. 1902. vol.81. p.1186).
Смесь окиси кальция и окиси магния показала более высокую активность, чем катализаторы, описанные в вышеупомянутых патентах. Методом дериватографии был исследован процесс разложения образующихся в процессе ацетатов. Чистый ацетат кальция имел температуру разложения 430°С. В присутствии минимальных количеств окиси магния (1%), его температура разложения понижалась до 410°С, а температура разложения ацетата магния несколько повышалась. Это доказывает взаимное влияния друг на друга этих двух окисей. Понижение температуры разложения ацетата способствовало сближению температур разложения ацетата и фенилацетата. Вероятно, этот фактор сказался и на смешанном ацетате, позволяя предпочтительнее образовываться фенилацетону по отношению к ацетону и дибензилкетону.
Зависимость выхода фенилацетона от времени пребывания исходной смеси кислот над катализатором имеет экстремальную зависимость. Следовательно, для получения максимального выхода фенилацетона необходимо оптимизировать нагрузку на катализатор. Меньшая нагрузка ведет к увеличению времени пребывания на катализаторе и уменьшению выхода фенилацетона за счет прохождения побочных реакций, повышенного смолообразования. Большая нагрузка ведет к уменьшению времени пребывания реакционной смеси в аппарате. Выход фенилацетона понижается за счет уменьшения конверсии фенилуксусной кислоты.
В любом из вышеописанных процессов используется избыток уксусной кислоты по отношению к фенилуксусной кислоте (1:10). Это обусловлено тем, что по механизму, описанному выше, также получается дибензилкетон, образующийся из двух молекул фенилуксусной кислоты. Фенилуксусная кислота — значительно более дорогой реагент, нежели уксусная кислота, и, исходя из этого, для того, чтобы свести образование дибензилкетона к минимуму, используется избыток уксусной кислоты. В заявляемом способе удалось снизить мольный избыток уксусной кислоты (1: 2-5), который в достаточной мере гасит реакцию образования дибензилкетона, не обременяя процесс большим количеством побочных продуктов. В прототипе большой избыток уксусной кислоты значительно увеличивает количество образующегося ацетона и диоксида углерода, обременяя тем самым технологическую схему более сложной системой улавливания фенилацетона и ацетона, и понижает производительность установки.
Изобретение иллюстрируется следующими примерами:
Пример 1
Смесь 23,94 г фенилуксусной кислоты (ФУК) и 36,96 г уксусной кислоты (УК), взятых при соотношение ФУК:УК=1:3,5, предварительно испарив, пропустили через контактный реактор при температуре 450°С, с катализатором, содержащим смесь окиси кальция с окисью магния, нанесенную на окись алюминия. Процесс ведут при нагрузке на катализатор 8,8 кг реакционной смеси /(кг кат час). Анализ полученной реакционной смеси показал 79,3% выход фенилацетона (по фенилуксусной кислоте).
Пример 2
Смесь 11,91 г фенилуксусной кислоты (ФУК) и 18,39 г уксусной кислоты (УК), взятых при соотношение ФУК:УК=1:3,5, предварительно испарив, пропустили через контактный реактор при температуре 400°С, с катализатором, содержащим смесь окиси кальция с окисью магния, нанесенную на окись алюминия. Процесс ведут при нагрузке на катализатор 3,4 кг реакционной смеси /(кг кат час). Анализ полученной реакционной смеси показал 82,6% выход фенилацетона (по фенилуксусной кислоте).
Пример 3
Смесь 9,42 г фенилуксусной кислоты (ФУК) и 20,78 г уксусной кислоты (УК), взятых при мольном соотношение ФУК:УК=1:5, предварительно испарив, пропустили через контактный реактор при температуре 400°С, с катализатором, содержащим смесь окиси кальция с окисью магния, нанесенную на окись алюминия. Процесс ведут при нагрузке на катализатор 3,61 кг реакционной смеси /(кг кат час). Анализ полученной реакционной смеси показал 79,5% выход фенилацетона (по фенилуксусной кислоте).
Пример 4
Смесь 19,13 г фенилуксусной кислоты (ФУК) и 16,87 г уксусной кислоты (УК), взятых при мольном соотношение ФУК:УК=1:2, предварительно испарив, пропустили через контактный реактор при температуре 400°С, с катализатором, содержащим смесь окиси кальция с окисью магния, нанесенную на окись алюминия. Процесс ведут при нагрузке на катализатор 4,33 кг реакционной смеси/(кг кат час). Анализ полученной реакционной смеси показал 79,3% выход фенилацетона (по фенилуксусной кислоте).
Пример 5
Смесь 13,21 г фенилуксусной кислоты (ФУК) и 20,39 г уксусной кислоты (УК), взятых при соотношение ФУК:УК=1:3,5, предварительно испарив, пропустили через контактный реактор при температуре 350°С, с катализатором, содержащим смесь окиси кальция с окисью магния, нанесенную на окись алюминия. Процесс ведут при нагрузке на катализатор 2,2 кг реакционной смеси /(кг кат час). Анализ полученной реакционной смеси показал 79,3% выход фенилацетона (по фенилуксусной кислоте).
ФОРМУЛА ИЗОБРЕТЕНИЯ
Способ получения фенилацетона в газовой фазе путем взаимодействия фенилуксусной кислоты с уксусной кислотой, взятой в избытке, на катализаторе, содержащем смесь окиси кальция и окиси магния, отличающийся тем, что процесс ведут при температуре не ниже 350°С и мольном соотношении фенилуксусной кислоты к уксусной кислоте 1:(2-5), при этом нагрузка на катализатор составляет 2,2-8,8 кг исходной смеси/(кг кат ч).
|
|
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
Синонимы:
1-фенилпропанон-2бензилметилкетон
Внешний вид:
бесцветн. кристаллыБрутто-формула (система Хилла): C9H10OФормула в виде текста: C6H5Ch3C(O)Ch4Молекулярная масса (в а.е.м.): 134,18Температура плавления (в °C): 27Температура кипения (в °C): 214Растворимость (в г/100 г или характеристика):вода: не растворимдиэтиловый эфир: легко растворим этанол: легко растворим Метод получения 1.(лабораторный синтез)Источник информации: «Методы получения химических реактивов и препаратов» вып.26 М. 1974 стр. 155-156 Реакцию проводят в кварцевой трубке длиной 85 см, диаметром 0,18 мм, соединенной через тройник с делительной воронкой и источником углекислого газа и помещенной в трубчатую печь с температурой 400—450°С. Среднюю часть реактора (по длине 50 см) заполняют окисью алюминия. Реакцию проводят в атмосфере углекислого газа; скорость подачи — 1 пузырек в секунду. В реактор приливают со скоростью 50—60 мл/час раствор 136 г (1 моль) фенилуксусной кислоты в 120 мл ледяной уксусной кислоты, затем добавляют 10 мл ледяной уксусной кислоты (для вытеснения из трубки продукта реакции). Катализат собирают в охлаждаемый приемник с обратным холодильником. По окончании реакции катализат выливают в смесь 300 г льда и 100 г воды, затем нейтрализуют по лакмусу 50%-ным раствором едкого натра. Водный слой отделяют и экстрагируют 2—3 раза бензолом порциями по 60 мл. Бензольные вытяжки соединяют с маслянистым слоем. Растворитель отгоняют, остаток перегоняют при пониженном давлении, собирая фракцию с т. кип. 113—115°С/20 мм.рт.ст. Выход метилбензилкетона равен 80-90 г (60—67%), d = 1,0239, n = 1,5161. Метод получения 2.(промышленный синтез)Источник информации: Рубцов М.В., Байчиков А.Г. «Синтетические химико-фармацевтические препараты» М. 1971 стр. 38-39 Смесь 37,5 кг (368 моль) уксусного ангидрида и 5 кг (60,7 моль) безводного ацетата натрия нагревают при кипении 2 часа, прибавляют 12,5 кг (92 моль) фенилуксусной кислоты и кипятят при перемешивании 18-20 часов. Затем отгоняют в вакууме 5 кг уксусного ангидрида, охлаждают до 60 С и прибавляют 20 л воды. Реакционную массу нагревают 1,5 ч при 90-100 С, прибавляют еще 60 л воды и экстрагируют метилбензилкетон хлороформом. К хлороформным экстрактам (около 20 кг) прибавляют 17 кг 32-36% водного раствора гидросульфита натрия, перемешивают при 15-17 С 5-6 часов и оставляют на 8-10 часов. Образовавшееся бисульфитное производное отфильтровывают и тщательно промывают хлороформом. 15-17 кг отмытого бисульфитного соединения прибавляют к смеси 2,7 л 40% раствора гидроксида натрия и 9 л воды, нагревают 1 час при 55-60 С, верхний слой (7 кг) после отстаивания отделяют и перегоняют в вакууме. Получают 3,7 кг (29%) метилбензилкетона (фенилацетона) с температурой кипения 110-114 С (20 мм.рт.ст.). Плотность:1,003 (20°C, г/см3)Дополнительная информация:Входит в список IV (прекурсоры) наркотических и психотропных веществ.
Источники информации:Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я |
Способ получения фенилацетона
Изобретение относится к способу получения фенилацетона путем взаимодействия фенилуксусной кислоты с уксусной кислотой в газовой фазе при их мольном соотношении 1:2-5, на катализаторе, содержащем смесь окиси кальция и окиси магния, при температуре не ниже 350°С, при этом нагрузка на катализатор составляет 2,2-8,8 кг исходной смеси /(кг кат час). Способ обеспечивает повышение выхода до 79,9-82,6%.
Изобретение относится к способу получения фенилацетона, являющегося полупродуктом для получения широкого ряда биологически активных веществ. В частности, на основе фенилацетона получают витамин B12, различные родентициды индандионового ряда.
Известен способ получения фенилацетона путем взаимодействия цианистого бензила с этилацетатом в среде этилата натрия при температуре 45°С (пат. РФ №2144766, авт. свид. СССР №1037441). Основным недостатком способа является низкий выход готового продукта 51-58 мас.% и очень большое количество водносолевых отходов, которые образуются на стадии нейтрализации избытка серной кислоты щелочью.
Известен способ получения фенилацетона путем взаимодействия фенилуксусной кислоты с уксусной кислотой в газовой фазе на различных катализаторах. Так в патентах США №2612524 в качестве катализатора использовали смесь окиси магния и гидроокиси магния. В патенте Германии №2758113 в качестве катализатора использовали диоксид циркония и (или) диоксид тория. Общим недостатком этих способов является, прежде всего, низкий выход готового продукта — не выше 61%, кроме того, диоксид тория является радиоактивным соединением.
Наиболее близким способом является способ получения фенилацетона путем взаимодействия фенилуксусной кислоты с уксусной кислотой в газовой фазе на катализаторе при температуре процесса 440°С (пат. Японии №8198796). Исходная смесь состоит из фенилуксусной кислоты — 2 об.%, уксусной кислоты — 20 об.%, азота в качестве инерта — 78 об.%. Катализатором являлась смесь окиси магния с окисью сурьмы в соотношении 1:0,1 соответственно. Процесс ведут с объемной скоростью газового потока 4615 ч-1 Катализатор использовали в таблетированном виде, либо наносили на носитель сферической или цилиндрической формы. Выход фенилацетона — 68,2%.
Недостатком прототипа является низкий выход фенилацетона, использование большого избытка уксусной кислоты, необходимость разбавления смеси исходных кислот большим количеством азота.
Цель данного изобретения — повышение выхода и увеличение производительности, уменьшение отходов производства, упрощение технологии получения фенилацетона.
Поставленная цель достигается за счет использования способа получения фенилацетона в газовой фазе путем взаимодействия фенилуксусной кислоты с уксусной кислотой, взятой в избытке, на катализаторе, содержащем смесь окиси кальция и окиси магния. Процесс ведут при температуре не ниже 350°С и мольном соотношение фенилуксусной кислоты к уксусной кислоте 1:(2-5), при этом нагрузка на катализатор составляет 2,2-8,8 кг исходной смеси /(кг кат час). Используя заявляемый способ исключается разбавление исходной смеси азотом.
Механизм получения фенилацетона из смеси фенилуксусной и уксусной кислоты в газовой фазе сводится к образованию смешанного ацетата, являющегося невыделяемым полупродуктом, который под воздействием температуры разлагается на фенилацетон и карбонат соответствующего металла (в зависимости от вида катализатора). Этим фактором обуславливаются температуры, при котором идет процесс. В патенте Японии №8198796 указывают на то, что в случае использования катализатора, содержащего окись магния, температура процесса не должна быть ниже 250°С, а в случае катализатора, содержащего окись кальция, не ниже 450°С. Как предполагают авторы, в системе со временем устанавливается декомпозиционное равновесие между окисью металла и его карбонатом. Если не придерживаться данных температур, весь катализатор перейдет в карбонат, и, тем самым, дезактивируется. Этим авторы объясняют отсутствия активности у окиси бария из-за его большой температуры разложения карбоната (1450°С), несмотря на то, что он является щелочноземельным металлом.
Это утверждение не оправдано. В настоящем изобретении использовалась смесь окиси кальция с окисью магния, причем некоторые эксперименты ставились так, что изначально в качестве катализатора присутствовали только карбонаты этих металлов. Но диоксид углерода выделялся без промедления, реакция получения фенилацетона шла с выходами, превышающими выходы в вышеописанном патенте Японии. Из этого следует, что процесс может проходить и в том случае, когда в качестве катализатора присутствует только карбонат металла. Также в литературе описано применение ацетатов бария или кальция для получения фенилацетона (Apitzch H.Uber die Einwirkund von Schewefelkoh-lenstoff und Atzkali auf ketone. 1905. Vol.38. S.2897. Bowman Ludlam E. The preparation of Mixed Ketones by Heating the Mixed Calcium salts of org. Acids. J. Chem. Soc. 1902. vol.81. p.1186).
Смесь окиси кальция и окиси магния показала более высокую активность, чем катализаторы, описанные в вышеупомянутых патентах. Методом дериватографии был исследован процесс разложения образующихся в процессе ацетатов. Чистый ацетат кальция имел температуру разложения 430°С. В присутствии минимальных количеств окиси магния (1%), его температура разложения понижалась до 410°С, а температура разложения ацетата магния несколько повышалась. Это доказывает взаимное влияния друг на друга этих двух окисей. Понижение температуры разложения ацетата способствовало сближению температур разложения ацетата и фенилацетата. Вероятно, этот фактор сказался и на смешанном ацетате, позволяя предпочтительнее образовываться фенилацетону по отношению к ацетону и дибензилкетону.
Зависимость выхода фенилацетона от времени пребывания исходной смеси кислот над катализатором имеет экстремальную зависимость. Следовательно, для получения максимального выхода фенилацетона необходимо оптимизировать нагрузку на катализатор. Меньшая нагрузка ведет к увеличению времени пребывания на катализаторе и уменьшению выхода фенилацетона за счет прохождения побочных реакций, повышенного смолообразования. Большая нагрузка ведет к уменьшению времени пребывания реакционной смеси в аппарате. Выход фенилацетона понижается за счет уменьшения конверсии фенилуксусной кислоты.
В любом из вышеописанных процессов используется избыток уксусной кислоты по отношению к фенилуксусной кислоте (1:10). Это обусловлено тем, что по механизму, описанному выше, также получается дибензилкетон, образующийся из двух молекул фенилуксусной кислоты. Фенилуксусная кислота — значительно более дорогой реагент, нежели уксусная кислота, и, исходя из этого, для того, чтобы свести образование дибензилкетона к минимуму, используется избыток уксусной кислоты. В заявляемом способе удалось снизить мольный избыток уксусной кислоты (1: 2-5), который в достаточной мере гасит реакцию образования дибензилкетона, не обременяя процесс большим количеством побочных продуктов. В прототипе большой избыток уксусной кислоты значительно увеличивает количество образующегося ацетона и диоксида углерода, обременяя тем самым технологическую схему более сложной системой улавливания фенилацетона и ацетона, и понижает производительность установки.
Изобретение иллюстрируется следующими примерами:
Пример 1
Смесь 23,94 г фенилуксусной кислоты (ФУК) и 36,96 г уксусной кислоты (УК), взятых при соотношение ФУК:УК=1:3,5, предварительно испарив, пропустили через контактный реактор при температуре 450°С, с катализатором, содержащим смесь окиси кальция с окисью магния, нанесенную на окись алюминия. Процесс ведут при нагрузке на катализатор 8,8 кг реакционной смеси /(кг кат час). Анализ полученной реакционной смеси показал 79,3% выход фенилацетона (по фенилуксусной кислоте).
Пример 2
Смесь 11,91 г фенилуксусной кислоты (ФУК) и 18,39 г уксусной кислоты (УК), взятых при соотношение ФУК:УК=1:3,5, предварительно испарив, пропустили через контактный реактор при температуре 400°С, с катализатором, содержащим смесь окиси кальция с окисью магния, нанесенную на окись алюминия. Процесс ведут при нагрузке на катализатор 3,4 кг реакционной смеси /(кг кат час). Анализ полученной реакционной смеси показал 82,6% выход фенилацетона (по фенилуксусной кислоте).
Пример 3
Смесь 9,42 г фенилуксусной кислоты (ФУК) и 20,78 г уксусной кислоты (УК), взятых при мольном соотношение ФУК:УК=1:5, предварительно испарив, пропустили через контактный реактор при температуре 400°С, с катализатором, содержащим смесь окиси кальция с окисью магния, нанесенную на окись алюминия. Процесс ведут при нагрузке на катализатор 3,61 кг реакционной смеси /(кг кат час). Анализ полученной реакционной смеси показал 79,5% выход фенилацетона (по фенилуксусной кислоте).
Пример 4
Смесь 19,13 г фенилуксусной кислоты (ФУК) и 16,87 г уксусной кислоты (УК), взятых при мольном соотношение ФУК:УК=1:2, предварительно испарив, пропустили через контактный реактор при температуре 400°С, с катализатором, содержащим смесь окиси кальция с окисью магния, нанесенную на окись алюминия. Процесс ведут при нагрузке на катализатор 4,33 кг реакционной смеси/(кг кат час). Анализ полученной реакционной смеси показал 79,3% выход фенилацетона (по фенилуксусной кислоте).
Пример 5
Смесь 13,21 г фенилуксусной кислоты (ФУК) и 20,39 г уксусной кислоты (УК), взятых при соотношение ФУК:УК=1:3,5, предварительно испарив, пропустили через контактный реактор при температуре 350°С, с катализатором, содержащим смесь окиси кальция с окисью магния, нанесенную на окись алюминия. Процесс ведут при нагрузке на катализатор 2,2 кг реакционной смеси /(кг кат час). Анализ полученной реакционной смеси показал 79,3% выход фенилацетона (по фенилуксусной кислоте).
Способ получения фенилацетона в газовой фазе путем взаимодействия фенилуксусной кислоты с уксусной кислотой, взятой в избытке, на катализаторе, содержащем смесь окиси кальция и окиси магния, отличающийся тем, что процесс ведут при температуре не ниже 350°С и мольном соотношении фенилуксусной кислоты к уксусной кислоте 1:(2-5), при этом нагрузка на катализатор составляет 2,2-8,8 кг исходной смеси/(кг кат ч).
Фенилацетон, получение — Справочник химика 21
Фенамин (бензедрин, амфетамин, сульфат 1-фенил-2-аминонропа-на, сульфат 1-фенил-изопропиламина), gHg— Hg— HNHj—СН3, приготовляется следующим образом. Фенилацетон, который может быть получен с выходом 60—65% при пропускании смеси фенил-уксусной-и уксусной кислот над окисью тория, превращается в оксим, который затем восстанавливается в первичный амин. Этот амин может быть также получен непосредственно из фенилаце-тона и формамида. [c.390]Получение фенилацетона (бензилметилкетона) кетонным расщеплением нитрила а-фенилацетоуксусной кислоты (2-ацетил-2-фенилацетонитрила) Джулиан П., Оливер Д. В сб. Синтезы органических препаратов. Сб. 2. Пер. с англ. — М. ИЛ, 1949. с. 316.. [c.96]
Ниже приведено в качестве пр1 мера описание способа получения фенилацетона, взятое из Organi Syntheses , 16, 49 [см. примечание 106, стр. 653]. [c.486]
Этилформиат вступает в альдольную конденсацию довольно своеобразным способом, и поэтому этому вопросу посвящен спе циальный раздел (о других конденсациях Кляйзена см. гл. 11 Кетоны , разд. Е.2, и гл. 14 с0фиры карбоновых кислот , разд. В.1). Имеется ряд таких реакций [1]. Если кетон содержит две различные активные метиленовые группы, как, например, метилэтилкетон, конденсация может протекать по любой алкильной группе с образованием альдегидов I и И, что и наблюдалось р дост аточной Степени [2]. Согласно Роху, даже в случае фенилацетона предпочтительнее формилирование метильного углерода, хотя продукт, получаемый из этого соединения, легко превращается вновь в исходное соединение, в результате чего происходит конденсация по метиленовому звену [3]. На деле конденсация по метильному углеродному атому, по-видимому, преобладает в тех случаях, когда для конденсации используют растворители, свободные от спиртов. Если исключить проблему формилирования кетона по двум атомам углерода, протекает реакция конденсации и выходы достигают 50—80%, однако необходимо очень осторожно обращаться с продуктом, так как он склонен к дальнейшей полимеризации или конденсации с образованием более сложных структур [4]. Обычно продукт выделяют в виде натриевой соли [5, 6],. но при быстрой экстракции охлажденного подкисленного раствора натриевой соли можно получить и свободную кислоту. Приведен пример нежелательной с точки зрения получения альдегидов конденсации [7] [c.76]
Советские химики О. Ю. Магидсон и Г. А. Гаркуша разработали удобный метод получения фенилацетона путем нагревания фенилуксусной кислоты с уксусным ангидридом в присутствии безводного уксуснокислого натрия [2121. [c.653]
Получение фенилацетона (метилбензилкетона) кетонным расщеплением нитрила а-фенилацетоуксусной кислоты (получение его см. на стр. 458). Джулиан П., Оливер Дж., Синтезы органических препаратов, [c.473]
Этот углеводород был приготовлен дегидратацией соответствующего третичлого спирта, 1-фенил-2-метилпропанола-2 СбН5СН2СОН(СНз)г, полученного действием магнийметилиодида ца фенилацетон или на фенил уксусный эфир. [c.167]
Из 1,3-дифторацетона и бромистого фенилмагния получен 1,3-дифтор-2-фенилпропанол-2 с выходом 72%, а из фторацетона —только фенилацетон с выходом 48% [377]. [c.138]
При получении фенилацетона трубку для сожжения (длина 90 см, диаметр 2 см) наполняют пропитанной по указанному выше способу окисью тория —пемзой, нагревают ее до 430—450°, пропускают через прибор, для его промывки, ток сухого углекислого газа (для осушки газа, а также в качестве счетчика пузырьков применяется промывная склянка с серной кислотой) и начинают затем приливать в трубку через капельную воронку раствор 136 г фенилуксусной кислоты в 120 мл ледяной уксусной кислоты (2 моля) со скоростью 12—15 капель в минуту одновременно через трубку непрерывно пропускают ток сухого углекислого газа, причем скорость пропускация регулируют таким образом, чтобы через промывную склянку проходило бы по одному пузырьку в секунду. Приливание смеси продолжается 12—15 час., после чего трубку споласкивают 10 мл ледяной уксусной кислоты, превращающейся при этом в ацетон, который растворяет и увлекает за собой остающиеся в трубке вещества. Продукт реакции, состоящий из коричневатого, слабо флуоресцирующего масла и водного слоя, обрабатывают 300 г смеси воды со льдом и подщелачивают небольшим избытком 50%-пого раствора едкого натра.Маслянистый слой отделяют, а водный слой дважды извлекают бензолом (50 мл на канедое извлечение). Бензольный раствор соединяют с отделенным первоначально маслом и подвергают фракционированию. Фенилацетон перегоняется при 21—22 мм в пределах от 110 до 115°. Выход его 74—87 г, т. е. 55—65% от теории. [c.487]
Общей характерной чертой всех трех вышеприведенных механизмов является их предсказание, что продукт реакции, образовавшийся в результате перегруппировки какого-либо а-гало-генкетона, будет отличным от продукта, полученного из его а -галогенизомера . Например, из 1-хлор-З-фенилацетона (IV) должна образоваться по любому из указанных путей 3-фенил-пропионовая кислота (V), тогда как из 1-хлор-1-фенилацетона (VI) в результате перегруппировки должна получиться исключительно 2-фенилпропионовая кислота (VII). Однако было найдено, что из обоих галогенкетонов IV и VI образуется одна и [c.269]
Способ получения фенилацетона
Изобретение относится к способу получения фенилацетона, являющегося полупродуктом для получения Витамина B12, различные родентициды индандионового ряда. Способ заключается во взаимодействии фенилуксусной кислоты с уксусной кислотой в газовой фазе при температуре не ниже 350С (температура разложения образующегося фенилуксусного ацетата) на катализаторе, в качестве которого используют окись кобальта на инертном носителе. Способ обеспечивает получение целевого продукта с выходом 80,4%.
Изобретение относится к способу получения фенилацетона, являющегося полупродуктом для получения широкого ряда биологически активных веществ. В частности, на основе фенилацетона получают витамин B12, различные родентициды индандионового ряда.
Известен способ получения фенилацетона путем взаимодействия цианистого бензила с этилацетатом в среде этилата натрия при температуре 45С (пат. РФ №2144766, автор. свид. СССР №1037441). Основным недостатком способа является низкий выход готового продукта 51-58 мас.% и очень большое количество водносолевых отходов, которые образуются на стадии нейтрализации избытка серной кислоты щелочью.
Известен способ получения фенилацетона путем взаимодействия фенилуксусной кислоты с уксусной кислотой в газовой фазе на различных катализаторах. Так в патентах США №2612524 в качестве катализатора использовали смесь окиси магния и гидроокиси магния. В патенте Германии №2758113 в качестве катализатора использовали диоксид циркония и (или) диоксид тория. Общим недостатком этих способов является прежде всего низкий выход готового продукта — не выше 61%, кроме того, диоксид тория является радиоактивным соединением.
Наиболее близким способом является способ получения фенилацетона путем взаимодействия фенилуксусной кислоты с уксусной кислотой в газовой фазе на катализаторе при температуре процесса 470С (пат. США №5750795). Исходная смесь состоит из фенилуксусной кислоты — 2 об.%, уксусной кислоты — 20 об.%, азота в качестве инерта — 78 об.%. Катализатором являлась смесь окиси магния с окисью сурьмы в соотношении 1:0,1 соответственно. Катализатор использовали в таблетированном виде либо наносили на носитель сферической или цилиндрической формы. Выход фенилацетона — 68,2%.
Недостатком прототипа является низкий выход фенилацетона, использование большого избытка уксусной кислоты, необходимость разбавления смеси исходных кислот большим количеством азота.
Цель данного изобретения — повышение выхода, уменьшение отходов производства, упрощение технологии получения фенилацетона.
Поставленная цель достигается за счет использования способа получения фенилацетона путем взаимодействия фенилуксусной кислоты с уксусной кислотой в газовой фазе на катализаторе при температуре не ниже ниже 350С (температура разложения образующегося фенилуксусного ацетата), при этом в качестве катализатора используют окись кобальта СоО (Мол.в. 75 г/моль) на инертном носителе.
Механизм получения фенилацетона из смеси фенилуксусной и уксусной кислоты в газовой фазе сводится к образованию фенилуксусного ацетата, являющегося невыделяемым полупродуктом, который под воздействием температуры разлагается на фенилацетон и карбонат соответствующего металла (в зависимости от вида катализатора). Этим фактором обуславливаются температуры, при котором идет процесс. В патенте США №5750795 указывают на то, что в случае использования катализатора, содержащего окись магния, температура процесса не должна быть ниже 250С, а в случае катализатора, содержащего окись кальция, не ниже 450С. Как предполагают авторы, в системе со временем устанавливается декомпозиционное равновесие между окисью металла и его карбонатом. Если не придерживаться данных температур, весь катализатор перейдет в карбонат и тем самым дезактивируется. Этим авторы объясняют отсутствия активности у окиси бария из-за его большой температуры разложения карбоната (1450С), несмотря на то что он является щелочноземельным металлом. Это утверждение неоправданно. В настоящем изобретении использовалась окись кобальта в качестве катализатора, у которой температура разложения карбоната до окиси равна 910С, и тем не менее реакция получения фенилацетона идет, причем с выходами, превышающими выходы в вышеописанном патенте. Из этого следует, что процесс может проходить и в том случае, когда в качестве катализатора присутствует только карбонат металла. Окись кобальта показала более высокую активность, чем катализаторы, описанные в вышеупомянутых патентах. Методом дериватографии был исследован процесс разложения образующихся в процессе ацетатов. Было замечено, что у симметричных ацетатов кобальта (уксусного и фенилуксусного) наиболее близкие температуры разложения по отношению к другим видам катализаторов, то есть эти вещества схожи по своей основности. Вероятно, этот фактор сказался и на смешанном фенилуксусном ацетате, позволяя предпочтительнее образовываться фенилацетону по отношению к ацетону и дибензилкетону.
В любом из вышеописанных процессах, и в заявленном тоже, используется избыток уксусной кислоты по отношению к фенилуксусной кислоте (мольном соотношении фенилуксусной кислоты к уксусной от 1:2 до 1:5 моль на моль). Это обусловлено тем, что по механизму, описанному выше, также получается дибензилкетон, образующийся из двух молекул фенилуксусной кислоты. Фенилуксусная кислота значительно более дорогой реагент, нежели уксусная кислота, и исходя из этого, для того чтобы свести образование дибензилкетона к минимуму, используется избыток уксусной кислоты. В нашем случае исходя из экономических соображений (большой избыток уксусной кислоты значительно увеличивает количество образующегося ацетона и диоксида углерода, обременяя тем самым технологическую схему более сложной системой улавливания фенилацетона и ацетона, и понижает производительность установки) брался 3,5 мольный избыток уксусной кислоты, который в достаточной мере гасил реакцию образования дибензилкетона, не обременяя процесс большим количеством побочных продуктов.
Изобретение иллюстрируется следующими примерами.
Пример 1 (использовали окись кобальта в количествах от 0,5-5 мас.% от общего веса катализатора)
Смесь 11,5 г (0,085 моль) фенилуксусной кислоты и 17,70 г (0,295 моль) уксусной кислоты, предварительно испарив, пропустили через контактный реактор при температуре 350-400С, содержащий окись кобальта в качестве катализатора, нанесенный на окись алюминия, выбранного в качестве инертного носителя. Средний выход фенилацетона (по фенилуксусной кислоте) 80,4% при 100% конверсии исходных кислот.
Пример 2 (сравнительный)
Смесь 16,39 г (0,121 моль) фенилуксусной кислоты и 25,31 г (0,422 моль) уксусной кислоты, предварительно испарив, пропустили через контактный реактор при температуре 400С, содержащий чистую окись магния в качестве катализатора, нанесенную на окись алюминия. Анализ полученной реакционной смеси показал 64,8% выход фенилацетона (по фенилуксусной кислоте).
Пример 3 (сравнительный).
Смесь 3,11 г (0,023 моль) фенилуксусной кислоты и 4,79 г (0,080 моль) уксусной кислоты, предварительно испарив, пропустили через контактный реактор при температуре 350С, содержащий чистую окись цинка в качестве катализатора, нанесенную на окись алюминия. Анализ полученной реакционной смеси показал 45,7% выход фенилацетона (по фенилуксусной кислоте).
Формула изобретения
Способ получения фенилацетона путем взаимодействия фенилуксусной кислоты с уксусной кислотой в газовой фазе на катализаторе при температуре не ниже 350С, отличающийся тем, что в качестве катализатора используют окись кобальта на инертном носителе.

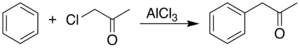
Добавить комментарий