Незаменимые аминокислоты. Справка — РИА Новости, 28.02.2011
Валин необходим для метаболизма в мышцах, он активно участвует в процессах восстановления поврежденных тканей. Помимо этого, он может быть использован мышцами в качестве дополнительного источника энергии. Валином богаты зерновая пища, мясо, грибы, молочные продукты, а также арахис.
Лизин необходим для нормального формирования костей и роста детей, способствует усвоению кальция и поддержанию нормального обмена азота у взрослых. Лизин участвует в синтезе антител, гормонов, ферментов, формировании коллагена и восстановлении тканей. Пищевыми источниками лизина являются сыр, яйца, рыба, молоко, картофель, красное мясо, соевые и дрожжевые продукты.
Лейцин защищает мышечные ткани и может являться источником энергии. Его наличие способствует восстановлению костей, кожи, мышечной ткани. Снижает уровень холестерина. К пищевым источникам лейцина относятся бурый рис, бобовые, мясо, орехи.
Изолейцин необходим для синтеза гемоглобина, увеличивает выносливость и способствует восстановлению мышц. К пищевым источникам изолейцина относятся куриное мясо, кешью, яйца, рыба, чечевица, мясо, рожь, миндаль, нут (турецкий горох), печень, соя.
Треонин способствует поддержанию нормального белкового обмена в организме, помогая при этом работе печени. Необходим организму для правильной работы иммунной системы. Содержится в яйцах, молочных продуктах, бобах и орехах.
Метионин способствует нормальному пищеварению, сохранению здоровой печени, участвует в переработке жиров, защищает от воздействия радиации. Метионин содержится в бобовых, яйцах, чесноке, луке, йогурте мясе.
Фенилаланин является нейромедиатором для нервных клеток головного мозга. Эффективно помогает при депрессии, артрите, мигрени, ожирении. Не усваивается организмом, которому не хватает витамина С. Содержится в говядине, курином мясе, рыбе, соевых бобах, яйцах, твороге, молоке, а также является составной частью синтетического сахарозаменителя — аспартама.
Триптофан используется организмом для синтеза в головном мозге серотонина, который в свою очередь является важнейшим нейромедиатором. Необходим при бессоннице, депрессии и для стабилизации настроения. Снижает вредное воздействие никотина. В пище эта аминокислота находится в буром рисе, деревенском сыре, мясе, бананах, йогурте, сушеных финиках, курице, кедровых орехах и арахисе.
Потребность человека в незаменимых аминокислотах составляет от 250 до 1100 миллиграммов в сутки. Существуют биологически активные добавки, содержащие необходимые дозы этих веществ. Особо внимание восполнению их в организме рекомендуется уделять вегетарианцам (поскольку некоторые незаменимые аминокислоты в необходимых количествах содержатся только в продуктах животного происхождения), беременным женщинам и спортсменам.
Материал подготовлен на основе информации открытых источников
Смотрите полный выпуск программы «Сытые и стройные» с Маргаритой Королевой: «Пища для мозга, или Что надо есть, чтобы ничего не забывать» >>
Сколько всего аминокислот существует?
Выберите разделВ помощь кондитеруКак применятьПолезно знатьРецептуры и технологииРецептыРецепты кондитера
Этот блог не предназначен для предоставления диагностики, лечения или медицинской консультации. Контент, представленный в этом блоге, предназначен только для информационных целей. Пожалуйста, проконсультируйтесь с врачом или другим медицинским работником относительно любых медицинских или связанных со здоровьем диагнозов или вариантов лечения. Информация в этом блоге не должна рассматриваться в качестве замены консультации с медицинским работником. Утверждения, сделанные о конкретных продуктах в этом блоге, не одобрены для диагностики, лечения, лечения или профилактики заболеваний.
Контент, представленный в этом блоге, предназначен только для информационных целей. Пожалуйста, проконсультируйтесь с врачом или другим медицинским работником относительно любых медицинских или связанных со здоровьем диагнозов или вариантов лечения. Информация в этом блоге не должна рассматриваться в качестве замены консультации с медицинским работником. Утверждения, сделанные о конкретных продуктах в этом блоге, не одобрены для диагностики, лечения, лечения или профилактики заболеваний.
Как вы думаете – сколько всего аминокислот существует? Давайте разберемся в этом вопросе. Аминокислоты — это в первую очередь «фундамент» для образования в нашем организме протеинов, гормонов, антител, белков в тканях, различных ферментов. Все белки – это соединенные в определенной последовательности цепочки из аминокислот. Если отсутствует одна аминокислота, то строительство молекулы белка становится попросту невозможным.
Каково назначение этих элементов? Аминокислоты в первую очередь обеспечивают функционирование практически всех систем в организме, угнетая или наоборот стимулируя все процессы жизнедеятельности:
- обогащают энергией, необходимой для мышечной ткани;
- обеспечивают правильную работу и функционирование нервной системы, являясь нейромедиаторами;
- активно участвуют в водно-солевом обмене.

На сегодняшний день обнаружено 26 аминокислот. Простыми компонентами в образовании белка, считаются 20 аминокислот. Все живые организмы образуют множество различных соединений белка. Все аминокислоты можно разделить на две группы:
1. Аминокислоты незаменимые – они поступают в наш организм исключительно с белковой пищей. Это следующие кислоты:
- гистидин;
- метионин;
- треонин;
- изолейцин;
- лейцин;
- фенилаланин;
- триптофан;
- валин.
2. Аминокислоты заменимые – они поступают в человеческий организм с белковой пищей или строятся из других аминокислот. В их число входят:
- аланин;
- глицин;
- аргинин;
- аспарагин;
- кислота аспарагиновая;
- цистеин;
- кислота глютаминовая;
- глютамин;
- пролин;
- серин;
- таурин;
- тирозин.

А где же эти аминокислоты синтезируются? Основная масса аминокислот в организме человека образуется в печени. Но к сожалению, стрессы, инфекции, старение и многие другие факторы, нарушают эти процессы, что ведет к быстрому истощению организма и потере физической активности.
Чтобы и вы получили такой ошеломительный эффект, покупайте кондитерские ингредиенты по промокоду BLOG со скидкой в 10%, который распространяется на все заказы до 15 кг! И до встреч в новых статьях!
Что такое незаменимые аминокислоты, как пополнить их запас в организме?
Что такое незаменимые аминокислоты, как пополнить их запас в организме?
Организм человека не может функционировать без аминокислот. Некоторые из них он вырабатывает самостоятельно – заменимые и условно заменимые. А некоторые получает исключительно с пищей. Рассказываем, что такое незаменимые аминокислоты, и как пополнить их запас в организме.
Аминокислоты — важное строительное «сырье» в организме человека. Все аминокислоты делятся на 3 группы: заменимые, условно заменимые и незаменимые. Классификация зависит от возможности организма самостоятельно производить эти вещества. Те, которые самостоятельно не вырабатываются, играют большую роль в образовании гормонов, строительстве белковых цепей.
Группа незаменимых аминокислот
Это соединения, которые состоят из углерода, водорода, кислорода и азота. Из общего количества только 9 структурных частей белка считаются незаменимыми. Это вещества, которые не могут синтезироваться организмом, а человек получает их исключительно из пищи.
К незаменимым аминокислотам относятся:
- изолейцин;
- лизин;
- лейцин;
- гистидин;
- триптофан;
- фенилаланин;
- валин;
- треонин;
- метионин.

Внимание! Каждая из известных кислот является необходимой для слаженной работы всех систем. Рацион должен быть сбалансирован и содержать все вещества. Они обеспечивают полноценную здоровую жизнь, сохраняют молодость и крепость мышц.
Для чего нужны?
Без незаменимых аминокислот не проходит ни один процесс в организме. К основным из них относятся:
- ответственность за структуру и функционирование белка;
- стимулирование роста мышц и ответственность за их восстановление;
- участие в нормальном метаболизме;
- включение в состав коллагена и эластина;
- регулирование аппетита, сна и настроения;
- помощь в формировании защитной оболочки вокруг нервных клеток.
Поэтому регулярное и достаточное поступление аминокислот данной группы является обязательным.
Симптомы дефицита
Если с пищей не поступает нормы незаменимых аминокислот, то возникает дефицит данных веществ. Его симптомы:
Его симптомы:
- постоянное чувство усталости и сонливости;
- анемия, которая сопровождается головокружением и прочими характерными симптомами;
- значительно ослабевает иммунитет;
- начинают выпадать волосы.
При этом есть неприятности и при лишнем потреблении данных веществ. Могут начаться патологии щитовидной железы, нарушается работа суставов. Поэтому для употребления суточной нормы незаменимых аминокислот необходимо правильно сформировать рацион, а также проконсультироваться с диетологом.
Как восполнить недостаток
Для обеспечения организма незаменимыми аминокислотами, нужно соблюдать всего несколько правил разумного питания:
- ежедневно в рационе должна присутствовать молочная и кисломолочная еда;
- мясо и рыбу также нужно употреблять ежедневно, но готовить их лучше на пару, запекать или тушить, подавать с зеленью;
- 50 грамм орешков и семян в сутки способствуют обогащению незаменимыми аминокислотами в любом возрасте;
- следует есть бобовые продукты и зерновые с зеленью.

При регулярном соблюдении таких рекомендаций опасного дефицита незаменимых аминокислот не возникнет, а человек сохранит молодость и здоровье.
Внимание! Особенно важно пополнить рацион аминокислотами при регулярном посещении тренажерного зала или профессиональных занятиях спортом. Тогда расход аминокислот значительно увеличивается, а правильному питанию нужно уделить особое внимание. Оно будет способствовать не только восполнению запаса полезных элементов, но и естественному снижению веса и наращиванию мышечной массы.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций.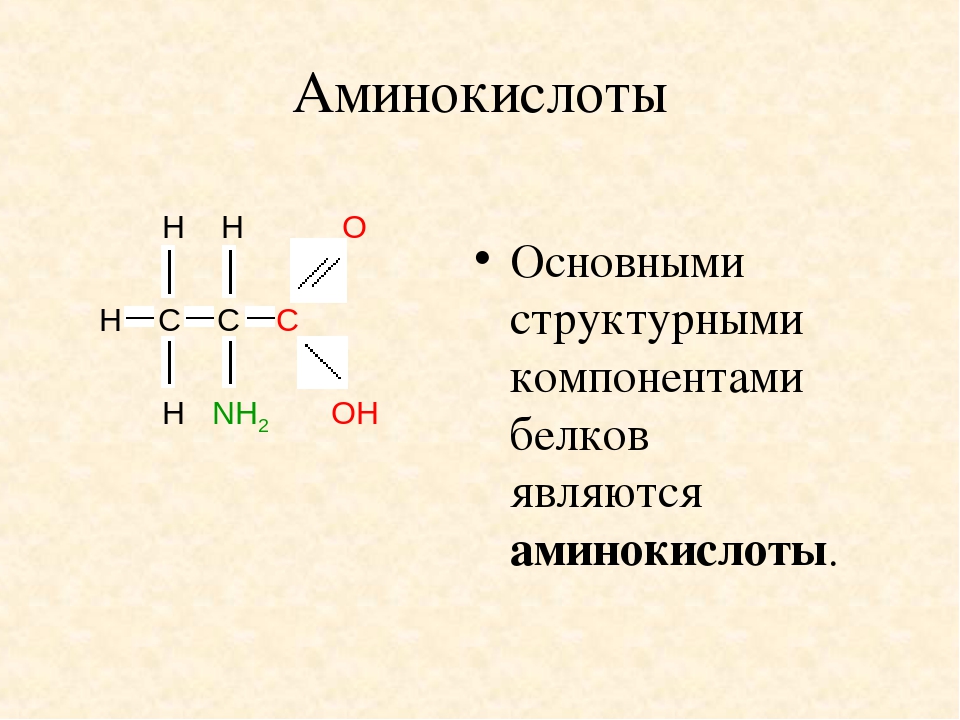 Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Клетки человека научили встраивать в белки неканонические аминокислоты
Bobjgalindo / Wikimedia Commons
Американские молекулярные биологи заставили кроветворные клетки человека кодировать неклассические аминокислоты и встраивать их в состав белков. Оказалось, что при этом клетки сохраняют способность дифференцироваться и могут выживать в организме мышей. Это может быть полезно, чтобы получать человеческие белки с измененными свойствами — и, например, сразу проверять их фармакологические свойства in vivo. Работа опубликована в журнале Proceedings of the National Academy of Sciences.
Оказалось, что при этом клетки сохраняют способность дифференцироваться и могут выживать в организме мышей. Это может быть полезно, чтобы получать человеческие белки с измененными свойствами — и, например, сразу проверять их фармакологические свойства in vivo. Работа опубликована в журнале Proceedings of the National Academy of Sciences.
Вписать новую аминокислоту в генетический код не так сложно, как может показаться. Дело в том, что в нашем генетическом коде уже есть свободные «слова» из трех нуклеотидов, которые сами по себе ничего не кодируют. Они служат стоп-кодонами. Как только рибосома, которая строит белок, доходит до такого «бессмысленного слова», она останавливается, и белок считается готовым. И вот таким стоп-кодонам можно искусственно приписать новое значение.
Для того, чтобы у триплета нуклеотидов появилось значение, необходимо, чтобы клетка умела его расшифровывать. Обычно это происходит так: к информационной РНК прилипает транспортная РНК, которая несет на себе нужную аминокислоту. Для стоп-кодонов такой транспортной РНК в клетке нет, но ее можно добавить извне. И придется добавить еще фермент, который соединяет транспортную РНК с неканонической аминокислотой. Тогда клетка будет встраивать новую аминокислоту на место стоп-кодона.
Для стоп-кодонов такой транспортной РНК в клетке нет, но ее можно добавить извне. И придется добавить еще фермент, который соединяет транспортную РНК с неканонической аминокислотой. Тогда клетка будет встраивать новую аминокислоту на место стоп-кодона.
Подобные эксперименты уже ставили на разных организмах, от бактерий до мышей. И вот группа ученых из Института Скриппс под руководством Питера Шульца (Peter Schultz) добралась до клеток человека. В своей работе исследователи заставили один из стоп-кодонов (УАГ) кодировать аминокислоту пирролизин — подобно тому, как это делают некоторые бактерии и археи.
Чтобы добиться своей цели, авторы работы заражали клетки человека вирусным вектором на основе вируса Эпштейна-Барр. Гены вируса были необходимы, чтобы этот участок ДНК продолжал существовать и размножаться внутри ядра. Кроме того, вектор содержал ген транспортной РНК для пирролизина и фермента трансферазы, который соединяет пирролизин с РНК. Наконец, внутри вектора находился ген зеленого флуоресцентного белка с мутацией: один из его кодонов был искусственно заменен на стоп-кодон УАГ. Это необходимо, чтобы проверить эффективность переписывания: если клетка научилась встраивать пирролизин вместо стоп-кодона, то белок получится полноразмерным и будет светиться. Если не научилась, то белок порвется на середине, и свечения не видно.
Это необходимо, чтобы проверить эффективность переписывания: если клетка научилась встраивать пирролизин вместо стоп-кодона, то белок получится полноразмерным и будет светиться. Если не научилась, то белок порвется на середине, и свечения не видно.
Сначала ученые опробовали свой метод на клетках эмбриональной почки человека. Как и следовало ожидать, они начали светиться только при добавлении пирролизина. Затем исследователи взяли кроветворные стволовые клетки из пуповинной крови человека. Успешного встраивания они добились примерно у половины клеток, и почти треть из них приобрела способность светиться.
Затем эти клетки подсадили иммунодефицитным мышам, чтобы выяснить, насколько они сохраняют свою жизнеспособность и новые свойства в живом организме. Оказалось, что они в три раза хуже приживаются, чем клетки, в которые не вводили вирусный вектор (9,5 процентов клеток в кровотоке и 27,8 процентов соответственно). Тем не менее, когда ученые увеличили число пересаживаемых клеток, они добились того, что четверть кроветворных клеток в организме мыши оказались человеческими. Около 20 процентов из них продолжали светиться. Затем они проследили, что из этих человеческих клеток получаются разные типы форменных элементов, включая разные виды лейкоцитов, и некоторые из них сохраняют способность к свечению.
Около 20 процентов из них продолжали светиться. Затем они проследили, что из этих человеческих клеток получаются разные типы форменных элементов, включая разные виды лейкоцитов, и некоторые из них сохраняют способность к свечению.
Таким образом, авторам работы удалось заставить стволовые клетки человека кодировать неканонические аминокислоты. Этот метод может оказаться полезен, чтобы получать человеческие белки с измененными свойствами — структурой или функциями — для исследований или разработки лекарств. Авторы работы, например, предположили, что иммунные клетки, которые происходят из таких клеток крови, могут производить модифицированные антитела, поэтому было бы интересно проверить реакцию химерных мышей из их эксперимента на какие-нибудь аллергены.
Мы уже рассказывали о том, как молекулярные биологи переписали, а затем урезали генетический код кишечной палочки, добавили в генетический алфавит четыре «буквы» и обнаружили нетрадиционный код у одного паразитического растения.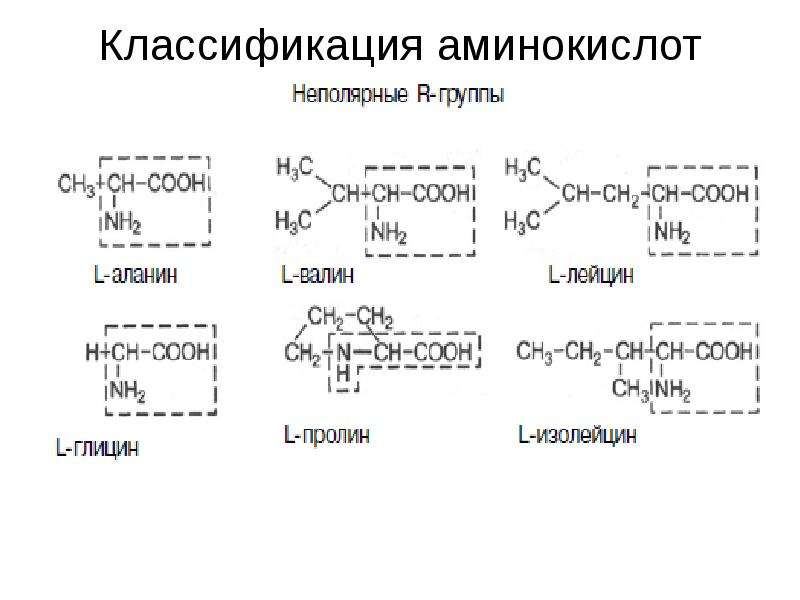 Подробнее о том, как и зачем ученые строят и переписывают геномы организмов, читайте в нашем материале «С правом на переписку».
Подробнее о том, как и зачем ученые строят и переписывают геномы организмов, читайте в нашем материале «С правом на переписку».
Полина Лосева
Аминокислоты в питании человека Текст научной статьи по специальности «Фундаментальная медицина»
lectures
АМИНОКИСЛОТЫ В ПИТАНИИ ЧЕЛОВЕКА
Лысиков Ю.А.
ГУ Институт питания РАМН, Москва
Лысиков Юрий Александрович 109240 Москва, Устьинский проезд, д. 2/14 E-mail: [email protected]
РЕЗЮМЕ
В статье представлены данные о метаболизме аминокислот в организме человека. Рассмотрена структура и свойства аминокислот, критерии незаменимости, вклад аминокислот в энергетику организма, специфические функции аминокислот, потребность в аминокислотах.
Рассмотрена структура и свойства аминокислот, критерии незаменимости, вклад аминокислот в энергетику организма, специфические функции аминокислот, потребность в аминокислотах.
SUMMARY
The article presents data on amino acids metabolism in human organism. The review described structure and function of amino acids, essentiality criteria, amino acids energy source role, amino acids specific functions, amino acids requirements.
CO CO
СТРУКТУРА И СВОЙСТВА АМИНОКИСЛОТ
Известно около 200 природных аминокислот, из них только 20 входят в состав белков. Эти аминокислоты называют протеиногенными — строящими белки. В организме человека наряду с протеиногенными аминокислотами можно найти и другие, которые играют иную роль, например, орнитин, в-аланин, таурин и др. . Многие из протеиноген-ных аминокислот в организме человека выполняют важные самостоятельные функции, например, глицин, глютаминовая и аспарагиновая кислоты являются биологически активными соединениями, фенилаланин, тирозин и триптофан служат источником образования биогенных аминов и других биорегуляторов, глицин и таурин входят в состав желчных кислот.
. Многие из протеиноген-ных аминокислот в организме человека выполняют важные самостоятельные функции, например, глицин, глютаминовая и аспарагиновая кислоты являются биологически активными соединениями, фенилаланин, тирозин и триптофан служат источником образования биогенных аминов и других биорегуляторов, глицин и таурин входят в состав желчных кислот.
Первая аминокислота, аспарагин, была открыта еще в 1806 году. Последней из обнаруженных известных аминокислот оказался треонин, который
соон
Н — С — 1ЧН2
Рис. 1. Общая структурная формула аминокислоты
удалось выделить лишь в 1938 году. Каждая аминокислота имеет тривиальное (традиционное) название, иногда связанное с источником происхождения. Например, аспарагин впервые был обнаружен в аспарагусе, глютаминовая кислота — в клейковине (глютене) пшеницы. Глицин был назван так за сладкий вкус (от греческого glykos — сладкий). В пищевых продуктах наиболее распространены 22 аминокислоты.
Глицин был назван так за сладкий вкус (от греческого glykos — сладкий). В пищевых продуктах наиболее распространены 22 аминокислоты.
Все 20 аминокислот, которые входят в состав белка, характеризуются общей структурной особенностью — наличием карбоксильной группы (-СООН) и аминогруппы (-№И2), связанной с одним и тем же атомом углерода и различаются структурой боковых цепей групп) (рис. 1). Почти все аминокислоты содержат по одной карбоксильной и аминогруппе. Однако имеются аминокислоты, которые могут содержать две карбоксильные (дикарбоновые аминокислоты) или две аминогруппы (диаминоами-нокислоты). Большинство аминокислот являются а-аминокислотами, в отличие от в-аминокислот, таких как в-аланин и таурин.
Стереоизомеры аминокислот. Из-за асимметрии молекулы все а-аминокислоты, за исключением
глицина, могут существовать в форме двух Б- или Ь-стереоизомеров — оптических изомеров, которые представляют собой зеркальные изображения друг друга. В ходе биосинтеза белка в его состав попадают только Ъ-аминокислоты. Следует подчеркнуть, что присутствие в составе белка Ъ-аминокислот определяет его структуру и свойства. Б-аминокислоты никогда не включаются в белки в процессе биосинтеза. В то же время в составе белка можно обнаружить и Б-аминокислоты. Причина этого парадокса
В ходе биосинтеза белка в его состав попадают только Ъ-аминокислоты. Следует подчеркнуть, что присутствие в составе белка Ъ-аминокислот определяет его структуру и свойства. Б-аминокислоты никогда не включаются в белки в процессе биосинтеза. В то же время в составе белка можно обнаружить и Б-аминокислоты. Причина этого парадокса
заключается в том, что для аминокислот характерна медленная самопроизвольная неферментативная рацемизация, в результате которой в составе белка появляются Б-аминокислоты. По этой причине структура белка со временем начинает меняться, могут изменяться и его свойства. Это является одним из механизмов старения белков, что вызывает необходимость их непрерывного обновления.
Таблица 1
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ [2; 3]
Химическая структура Полярность боковой цепи Изоэлектри-ческая точка р! Молекулярная масса , г/моль Степень гидрофильности Полярность боковой цепи
1. Алифатические Высокогидрофильные
Алифатические Высокогидрофильные
Алании -1,9 6,0 89 Глютамин +9,4
Валин* -2,0 6,0 117 Аспарагин +9,7
Глицин -2,4 6,0 75 Глютаминовая кислота +10,2
Изолейцин* -2,2 5,9 131 Гистидин +10,3
Лейцин* -2,3 6,0 131 Аспарагиновая кислота +11,0
2. Серосодержащие Лизин* +15,0
Метионин* -1,5 5,7 149 Аргинин +20,0
Цистеин -1,2 5,0 121 Умеренно гидрофильные
3. Ароматические Треонин* +4,9
Тирозин +6,1 5,7 181 Серин +5,1
Триптофан* +5,9 5,9 204 Триптофан* +5,9
Фенилаланин* +0,8 5,5 165 Пролин +6,0
4. Оксиаминокислоты Тирозин +6,1
Оксиаминокислоты Тирозин +6,1
Серин +5,1 5,7 105 Высокогидрофобные
Треонин* +4,9 5,6 119 Цистеин -1,2
5. Дикарбоновые (кислые) Метионин* -1,5
Аспарагиновая кислота +11,0 2,8 133 Аланин -1,9
Глютаминовая кислота +10,2 3,2 147 Валин* -2,0
6. Амиды дикарбоновых кислот Изолейцин* -2,2
Аспарагин +9,7 5,4 132 Лейцин* -2,3
Глютамин +9,4 5,7 146 Глицин -2,4
7. Диаминоаминокислоты (основные) Фенилаланин* +0,8
Аргинин +20,0 10,9 174
Гистидин +10,3 7,6 155
Лизин* +15,0 9,7 146
8. Иминокислота
Иминокислота
Пролин +6,0 6,3 115
о
СО
Примечание: * — незаменимые аминокислоты.
сэ
о
Биосинтез Ь-аминокислот в клетках организма происходит с помощью стереоспецифических ферментов, которые имеют асимметричные активные центры. При химическом синтезе аминокислот с одинаковой скоростью образуются как Б-, так и Ь-стереоизомеры. В результате получается рацемическая (одинаковая по составу) смесь разных стереоизомеров аминокислот. Рацемическую смесь аминокислот можно разделить на Б- и Ь-стереоизомеры, но это дорого. Поэтому полученные искусственным путем препараты аминокислот могут содержать не только необходимые организму Ь-аминокислоты, но и Б-стереоизомеры. Полные гидролизаты белков будут содержать только Ь-стереоизомеры аминокислот. В природе встречаются и некоторые Б-аминокислоты, которые входят в состав пептидных антибиотиков и клеточных стенок бактерий [1].
Полные гидролизаты белков будут содержать только Ь-стереоизомеры аминокислот. В природе встречаются и некоторые Б-аминокислоты, которые входят в состав пептидных антибиотиков и клеточных стенок бактерий [1].
По химической структуре можно выделить 8 классов аминокислот (табл. 1):
1. Алифатические аминокислоты (аланин, ва-лин, глицин, изолейцин и лейцин) отличаются тем, что их боковые цепи содержат лишь атомы углерода и водорода.
У валина, изолейцина и лейцина боковая цепь разветвляется, их еще называют аминокислотами с разветвленной цепью.
2. Серосодержащие аминокислоты (метионин и цистеин) содержат атомы серы. При этом место серы может занимать атом селена.
3. Ароматические аминокислоты (тирозин, триптофан и фенилаланин) содержат ароматические циклические группы.
4. Оксиаминокислоты (серин и треонин) содержат -ОН-группы.
5. Дикарбоновые аминокислоты (аспарагино-вая и глютаминовая кислоты) содержат две карбоксильные группы
6. Амиды дикарбоновых аминокислот (аспа-рагин и глютамин) содержат атом азота в составе второй карбоксильной группы.
7. Диамино-, или двуосновные, аминокислоты (аргинин, гистидин и лизин) содержат две аминогруппы.
8. «Аминокислота» пролин занимает особое положение, поскольку, аминокислотой не является. По своей структуре это иминокислота и включает циклическое имидазольное кольцо. Благодаря циклической группе пролин вызывает изгибы в полипептидной цепочке белка, что очень важно, например, для структуры белка соединительной ткани коллагена, где пролина очень много.
Благодаря наличию карбоксильной и аминогруппы в водных растворах все аминокислоты ионизированы и ведут себя одновременно как кислоты и как основания. В водной среде организма свободные аминокислоты играют роль буферных веществ, стабилизируя рН среды. При этом растворимость в воде и степень гидрофильности разных аминокислот существенно различается. По степени
гидрофильности — способности связывать молекулы воды аминокислоты можно разделить на [2]:
1. Высокогидрофильные: аспарагин, аспара-гиновая кислота, аргинин, гистидин, глютамин, глютаминовая кислота и лизин, которые почти всегда располагаются на внешней поверхности молекул белка.
2. Умеренно гидрофильные: пролин, серин, тирозин, треонин и триптофан. Они занимают промежуточное положение, отличаясь определенной гидрофильностью.
3. Гидрофобные: аланин, валин, глицин, изо-лейцин, лейцин, метионин, цистеин и фенилала-нин, которые располагаются в основном внутри молекул белка.
Гидрофильность аминокислот во многом зависит от их полярности, которая связана с величиной заряда их боковых групп. Пять алифатических аминокислот (аланин, валин, глицин, изолейцин и лейцин) содержат слабо полярные боковые группы. Слабую полярность имеют серосодержащие аминокислоты (метионин и цистеин), а также одна из ароматических аминокислот — фенилаланин. Благодаря гидрофобности эти аминокислоты плохо растворяются в воде. Остальные аминокислоты содержат заряженные положительно полярные боковые группы и поэтому они более гидрофильны и хорошо растворяются в воде. Полярность аминокислот оказывают существенное влияние на структуру белка, его свойства и функции. Следует подчеркнуть, что большинство гидрофобных аминокислот являются незаменимыми (валин, изолейцин, лейцин, метионин и фенилаланин). Две других незаменимых аминокислоты (треонин и триптофан) отличаются умеренной гидрофильностью.
Две других незаменимых аминокислоты (треонин и триптофан) отличаются умеренной гидрофильностью.
Онкотическое давление. Гидрофобные аминокислоты, как правило, располагаются внутри молекулы белка, тогда как гидрофильные — на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка. Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток. Гидрофильность белков крови обеспечивают онкотическое давление, которое удерживает жидкость в кровеносных сосудах. При уменьшении содержания белка в организме человека в первую очередь уменьшается количество плазменных белков, что приводит к снижению он-котического давления крови, выходу жидкости из кровеносной системы в межклеточное пространство, что может приводить к возникновению безбелковых (голодных) отеков. Гидрофильность пищевых белков обеспечивает их способность набухать, образовывать студни, эмульсии и пены. Гидрофильность белков клейковины злаков определяет качество зерна и его хлебопекарные свойства.
Гидрофильность белков клейковины злаков определяет качество зерна и его хлебопекарные свойства.
Нестандартные аминокислоты в составе белка. Кроме 20 стандартных аминокислот, которые присутствуют почти во всех белках, существуют так называемые нестандартные аминокислоты, которые
встречаются лишь в некоторых из них. Причем, каждая из этих аминокислот представляет собой производное одной из обычных. К нестандартным аминокислотам относят: производное пролина — 4-гидроксипролин и 5-гидроксипролин. Обе аминокислоты входят в состав коллагена. В мышечном белке миозине присутствует производное лизина — Nметиллизин. Другое производное лизина — аминокислота десмозин (комплекс из четырех молекул лизина — тетрапептид) содержится только в фибриллярном белке соединительной ткани — эластине. В белке протромбине, а также в некоторых других белках, которые активно связывают ионы кальция, присутствует у-карбоксиглютаминовая кислота.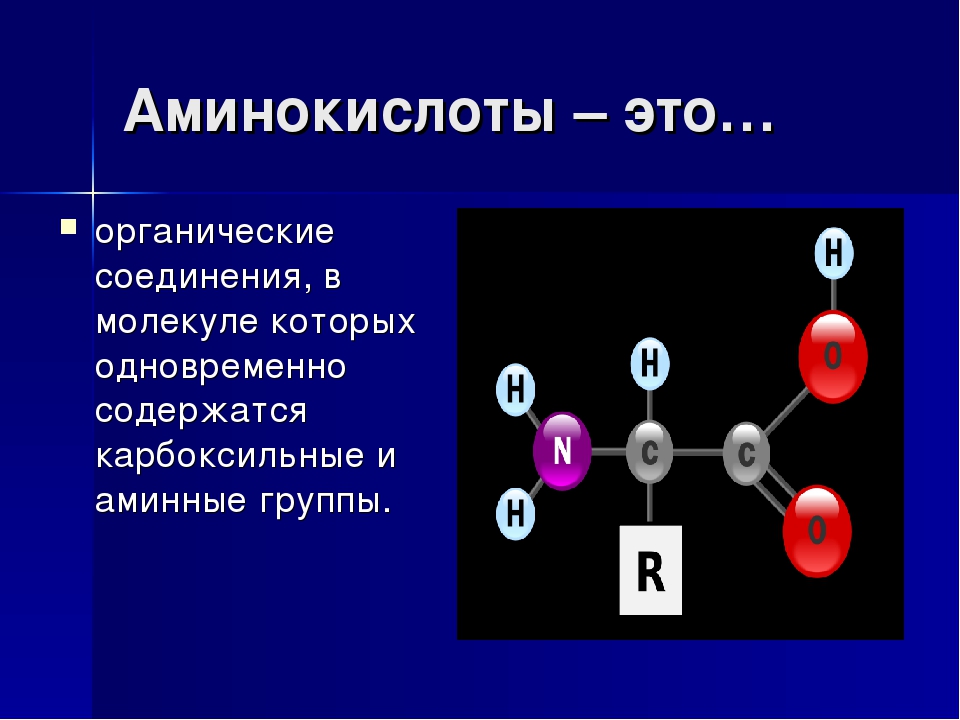
Особо следует остановиться на серосодержащей аминокислоте цистеине. Она может находиться в составе белка в двух формах: либо в форме цисте-ина, либо в форме дипептида — цистина, который представляет собой комплекс из двух молекул ци-стеина, ковалентно связанных друг с другом при помощи дисульфидного мостика. Благодаря этому свойству цистеин выполняет важную функцию по стабилизации структуры белковой молекулы. Цистеин играет ключевую роль в формировании инсулина и иммуноглобулинов (антител). В этих белках благодаря дисульфидным цистеиновым мостикам соединяются разные полипептидные цепи в одну молекулу белка. Такие поперечные связи обычно отсутствуют во внутриклеточных белках, но широко представлены в секреторных белках. Разрушение дисульфидных связей в кератине, формирующем структуру волос, лежит в основе процесса химической завивки. Для этого используют тиоловые соединения, под действием которых происходит разрыв поперечных дисульфидных связей в кератине. После укладки волос действие кислорода воздуха приводит к образованию новых поперечных связей, которые закрепляют новую форму волос.
После укладки волос действие кислорода воздуха приводит к образованию новых поперечных связей, которые закрепляют новую форму волос.
Функциональная классификация аминокислот. С физиологических позиций аминокислоты можно разделить на:
• Протеиногенные, которые входят в состав белка (20 аминокислот), и непротеиногенные, не входящие в состав белка, но выполняющие в организме человека другие важные функции.
• Заменимые (8 аминокислот) и незаменимые (12 аминокислот). О них мы будем говорить ниже.
• Глюкогенные, которые превращаются в глюкозу и далее в гликоген или расщепляются по пути метаболизма глюкозы с образованием АТФ. Глюкогенными, в той или иной степени, являются подавляющее большинство — 19 аминокислот, за исключением лейцина.
• Кетогенные, которые могут превращаться в кетоновые тела (короткоцепочечные жирные кислоты). Кетогенными являются 6 аминокислот: изолейцин, лейцин, лизин, тирозин, триптофан и фенилаланин.
Кетогенными являются 6 аминокислот: изолейцин, лейцин, лизин, тирозин, триптофан и фенилаланин.
АМИНОКИСЛОТЫ КАК ИСТОЧНИКИ ЭНЕРГИИ
Известно, что при полном окислении 1 г белка (или смеси аминокислот) в калориметрической бомбе в среднем образуется 5,65 ккал. Углерод аминокислот окисляется до СО2, водород — до Н2О, а азот — до NО2. Однако в организме человека энергию в форме АТФ можно получить только при окислении углеводородной составляющей аминокислот. Поэтому из 5,65 ккал организму будут доступны только 4,3 ккал, а оставшаяся часть (1,3 ккал) является энергией окисления азота. В настоящее время установлено, что действительная энергетическая ценность белка колеблется от 1,82 до 4,27 ккал/г, однако за эталон принимают цифру 4,0 ккал/г [4]. Существенные различия в энергетической ценности белка связаны, с одной стороны, с различной молекулярной массой аминокислот, а с другой — с разными путями и механизмами их окислительного метаболизма (рис.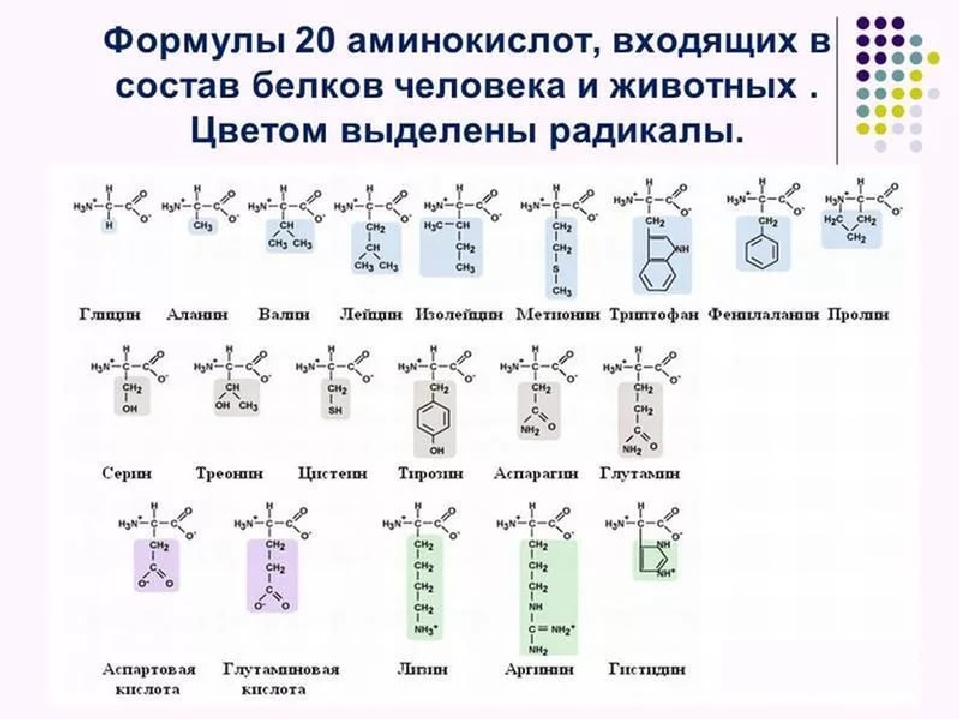 2).
2).
Считают, что белки (аминокислоты) могут обеспечить 11-14% энергии суточного рациона. Например, при суточной калорийности в 2500 ккал на белок может приходиться 275-350 ккал, что должно соответствовать 69-88 г белка. Однако все пищевые аминокислоты не могут полностью окисляться с образованием энергии. Значительная часть энергии теряется в процессе кругооборота и метаболизма аминокислот. Поэтому эффективность использования энергии пищи организмом человека, как полагают, составляет около 20-25% [4].
Аминокислоты мышечных белков, а также сывороточные и другие белки являются важным источником образования глюкозы и метаболической энергии в форме АТФ. При длительном голодании это приводит к массивному распаду мышечного белка и снижения содержания белка и его фракций в сыворотке крови. Диеты с низким (недостаточным) количеством углеводов также ведут к деградации мышечных и сывороточных белков.
В биосинтезе глюкозы участвуют в основном заменимые аминокислоты — 10-25% и только 1% незаменимых аминокислот. В организме человека углеродные скелеты некоторых аминокислот могут непосредственно превращаться в пируват или в промежуточные продукты цитратного цикла (окса-лоацетат, сукцинил-КоА, кетоглутарат и фума-рат) с освобождением энергии в дыхательной цепи митохондрий (табл. 2). При этом оксалоацетат может превращаться в фосфоенолпируват и по пути глюконеогенеза — в глюкозу. Источником глюкозы может стать и пируват [5]. Таким образом, разные глюкогенные аминокислоты могут включаться в пути обмена глюкозы (гликолиз и глюконеогенез) на разных его этапах. Судьба разных аминокислот
го
О 2
ГЛЮКОЗА
ГЛИКОГЕН
фосфоенолп и руват
оксалоацетат
го
го
0 ^
2
го
1
I
ГЛЮКОЗА
ГЛИКОГЕН
фосфоенолпируват
оксалоацетат
Пируват
аминокислоты
Ацетил-КоА
I
ЦИТРАТНЫЙ ЦИКЛ сукцинил КоА, кетоглутарат, фумарат, оксалоацетат
ДЫХАТЕЛЬНАЯ ЦЕПЬ
ЭНЕРГИЯ
Рис. 2. Пути метаболизма глюкогенных аминокислот
2. Пути метаболизма глюкогенных аминокислот
о
неодинакова: одни из них могут превращаться в глюкозу и далее в гликоген, тогда как другие, минуя глюкозу, могут непосредственно окисляться до СО2 и Н2О с образованием АТФ.
Установлено, что из 100 г аминокислот может образовываться только 57 г глюкозы. При голодании в первые 3-4 дня из аминокислот в среднем в сутки образуется около 41 г глюкозы, а спустя несколько недель голодания образование глюкозы снижается до 16 г в сутки. При сахарном диабете 2-го типа превращение глюкогенных аминокислот в глюкозу происходит с гораздо большей скоростью, чем у здоровых людей [5]. Как следствие этого у больных диабетом с мочой выводится большое количество мочевины, которая образуется при дезаминировании глюкогенных аминокислот. В критических состояниях скорость глюконеогенеза с использованием аминокислот также существенно возрастает.
Среди аминокислот наиболее эффективно превращаются в глюкозу серин, аланин и пролин, тогда как глютамин, который широко используется в энтеральном и парентеральном питании, стоит на четвертом месте (табл. 3).
Важную роль в процессах глюконеогенеза играет так называемый цикл аланина, который характерен для мышечной ткани (рис. 3). При дефиците глюкозы в организме или при голодании усиливается катаболизм мышечных белков с освобождением свободных аминокислот, около 50% которых составляет аланин [2]. Аланин поступает в печень, где из него образуется пируват, который включается в глюконеогенез. Когда в мышечной ткани возобновляется биосинтез белка, возникает потребность в аланине, который начинает синтезироваться из пирувата. В свою очередь источником пирувата является глюкоза, из которой он образуется в результате гликолиза. Таким образом, аланин завершает свой кругооборот:
НЕЗАМЕНИМОСТЬ АМИНОКИСЛОТ
Говоря о значении различных аминокислот для организма человека, необходимо рассмотреть понятие незаменимости. Основным критерием в определении биологической ценности аминокислот является их способность поддерживать рост животных и человека, что связано с биосинтезом белка в организме. Исключение из пищевого рациона хотя бы одной из таких аминокислот, при сохранении содержания остальных, влечет за собой задержку роста и снижение массы тела растущего организма. Поэтому незаменимыми аминокислотами считают такие, которые «либо не синтезируются в организме, или синтезируются со скоростью, недостаточной или не соответствующей обмену веществ,
S Lr
обеспечивающих пластические и регенера- sj
тивные процессы, связанные с образованием ц
новых клеток и тканей» [6]. <
Согласно классическим исследованиям Rose, для взрослого здорового человека жизненно необходимыми являются 8 аминокислот, которые стали считать незаменимыми (табл. 4). Полагают, что эти аминокислоты не образуются в организме человека и обязательно должны поступать с пищей.
Остальные 12 аминокислот считают заменимыми. К ним относят: аланин, аргинин, аспарагин, аспарагиновую кислоту, гистидин, глицин, глютамин, глютами-новую кислоту, пролин, серин, тирозин и цистеин. Эти аминокислоты, как полагают,
катаболизм белка t! глюконеогенез
БЕЛОК аланин пируват ГЛЮКОЗА
анаболизм белка МЫШЕЧНАЯ ТКАНЬ гликолиз ПЕЧЕНЬ
Рис. 3. Цикл аланина Таблица 2
СУДЬБА ГЛЮКОГЕННЫХ АМИНОКИСЛОТ [5]
Аминокислоты Превращаются в: Результат
Аланин, глицин, серин, треонин, цистеин Пируват Глюкоза/АТФ
Аспарагин, аспарагиновая кислота Оксалоацетат Глюкоза/АТФ
Валин, изолейцин, метионин, триптофан Сукцинил-КоА АТФ
Аргинин, гистидин, глутамин, глутаминовая кислота, пролин Кетоглутарат АТФ
Аспарагиновая кислота, тирозин, фенилаланин Фумарат АТФ
Таблица 3
СКОРОСТЬ ГЛЮКОНЕОГЕНЕЗА В ПЕЧЕНИ ИЗ РАЗЛИЧНЫХ ПРЕДШЕСТВЕННИКОВ [5]
Предшественник Образование глюкозы мк моль/мин г ткани Предшественник Образование глюкозы, мкмоль/мин г ткани
Фруктоза 2,68 Глутамин 0,45
Диоксиацетон 2,07 Треонин* 0,40
Лактат 1,06 Глутамат 0,31
Пируват 1,02 Аргинин 0,27
Серин 0,98 Аспартат 0,23
Аланин 0,66 Изолейцин* 0,22
Пролин 0,55 Орнитин 0,19
Глицерин 0,48 Валин* 0,12
Примечание: * — незаменимые аминокислоты.
m
о
способны синтезироваться в организме человека в достаточном количестве. Наряду с этим выделяют группу аминокислот, которые необходимы человеку в определенные периоды развития и в некоторых физиологических и клинических ситуациях. Эти аминокислоты относят к условно незаменимым (табл. 5).
Другим критерием значимости и биологической ценности аминокислот считают степень их участия в обеспечении азотистого равновесия. Имеются данные о целесообразности выделения третьей группы аминокислот, обладающих свойствами ускорять рост. К их числу относят 7 аминокислот: аргинин, глютаминовую кислоту, пролин, серин, тирозин, триптофан и цистеин.
Заслуживает внимание классификация аминокислот, предложенная Josue de Castro, который разделил их на две группы. В первую группу вошли 5 аминокислот, обеспечивающие рост: аргинин, гистидин, лизин, пролин и цистеин. Во вторую — другие 5 аминокислот, которые необходимы для регенерации тканей: аспарагиновая и глютаминовая кислоты, тирозин, триптофан и фенилаланин [6].
А.Э. Шарпенак относил к незаменимым 12 аминокислот: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, тирозин, треонин, триптофан, фенилаланин и цистеин. По данным Eagle, для культивирования клеток животных и человека необходимы те же 12 аминокислот, но с заменой треонина на глютамин [6].
Таблица 4
НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ [6]
Автор Rose Условно незаменимые Ускоряют рост Jose de Castro А.Э. Шарпенак Eagle, 1958
Число 8 6 7 10 12 12
Валин Аспартат Аргинин Рост Аргинин Аргинин
Изолейцин Гистидин Глютамат Аргинин Валин Валин
Лейцин Глютамин Пролин Гистидин Гистидин Гистидин
ЛИЗИН* Таурин Серин Лизин Изолейцин Изолейцин
Метионин Тирозин Тирозин Пролин Лейцин Лейцин
Ами- ТРЕОНИН* Цистеин Триптофан Цистеин Лизин Лизин
лоты Триптофан Цистеин Регенерация Метионин Метионин
Фенилаланин Аспартат Тирозин Тирозин
Абсолютно Глютамат Треонин Глютамин
заменимые Тирозин Триптофан Триптофан
ГЛЮТАМАТ Триптофан Фенилаланин Фенилаланин
СЕРИН Фенилаланин Цистеин Цистеин
Примечание: * — абсолютно незаменимые аминокислоты.
Таблица 5
ФУНКЦИИ УСЛОВНО НЕЗАМЕНИМЫХ АМИНОКИСЛОТ
Аминокислота Функции в организме
Аспартат Необходим для процессов регенерации
Гистидин Необходим для маленьких детей, у которых эндогенный синтез недостаточен
Глютамин Необходим для процессов регенерации, является важным энергетическим субстратом в критических состояниях
Таурин Необходим для новорожденных, у которых эндогенный синтез недостаточен, а также для больных в критических состояниях. Дефицит возникает при недостатке метионина и цистеина
Тирозин Необходим для маленьких детей, у которых эндогенный синтез недостаточен. При нарушении функции почек снижено образование тирозина из фенилаланина
Цистеин Необходим для маленьких детей, у которых эндогенный синтез недостаточен. Дефицит возникает при недостаточном содержании метионина в питании. Крайне необходим при нарушениях функции печени и для больных в критических состояниях
В основе разноголосицы в определении важности и незаменимости тех или иных аминокислот лежат особенности их биосинтеза и метаболизма в организме человека. За исключением двух аминокислот — лизина и треонина, которые являются у человека абсолютно незаменимыми, остальные «незаменимые» аминокислоты в определенных количествах могут синтезироваться за счет реакций трансаминирования, но объем их синтеза является недостаточным.
Ряд незаменимых аминокислот являются предшественниками для синтеза заменимых. Например, из незаменимой аминокислоты фенилаланина синтезируется заменимая аминокислота тирозин, а из незаменимого метионина — заменимый цистеин. Установлено, что до 80-89% метионина может трансформироваться в цистеин, а 70-75% фенилаланина — в тирозин [2]. По этой причине незаменимых аминокислот метионина и фенилаланина требуется больше, так как существенная их часть должна расходоваться на образование цистеина и тирозина. Аминокислоты цистеин и тирозин по своему физиологическому значению близки к незаменимым аминокислотам, к которым их относили ранее. Таким образом, поступление с пищей цистеина и тирозина позволяют сократить потребность в незаменимых аминокислотах мети-онине и фенилаланине.
С метаболических позиций абсолютно заменимыми являются глютаминовая кислота и серин, которые в необходимых количествах синтезируются из кетокислот. Биосинтез остальных «заменимых» аминокислот в организме человека ограничен. По этой и другим причинам полностью обеспечить потребность организма только за счет биосинтеза большинства заменимых аминокислот невозможно. Важно подчеркнуть, что потребность организма в белке, а, стало быть, в аминокислотах — есть величина переменная, которая изменяется на протяжении жизни и может резко возрастать при очень многих физиологических и патологических состояниях.
Подводя итог спорам о важности и незаменимости тех или иных аминокислот, следует подчеркнуть:
• Во-первых, ценность тех или иных аминокислот определяется возможностью их биосинтеза в организме. При этом часть незаменимых аминокислот может синтезироваться в организме, но объем их биосинтеза недостаточен. Разумеется, те аминокислоты, которые ни при каких условиях не образуются в организме и являются абсолютно незаменимыми, должны непрерывно поступать с пищей. Возможности запасания и резервирования лимитирующих аминокислот в составе мышечных белков, альбумина или других белков ограничены.
• Во-вторых, некоторая часть незаменимых аминокислот, помимо пищи, может образовываться при микробиологическом синтезе кишечной микрофлорой и поступать во внутреннюю среду организма.
• В-третьих, физиологическая потребность в незаменимых аминокислотах есть величина переменная и может изменяться в зависимости от активности процессов анаболизма и катаболизма белка, которые, в свою очередь, зависят от уровня физической активности, особенностей обмена веществ, состояния здоровья.
• В-четвертых, обеспечение организма белком и незаменимыми аминокислотами зависит не только от качества, но и режима питания, а также от содержания других компонентов пищевого рациона, например, углеводов. Заменимые аминокислоты занимают
достаточно большой удельный вес в составе белков пищи — до 2/3 суммы аминокислот. В организме человека они выполняют весьма важные функции, причем многие из них играют не меньшую роль, чем незаменимые аминокислоты. Следует подчеркнуть, что хотя заменимые аминокислоты могут образовываться в организме, однако за счет эндогенного биосинтеза обеспечивается лишь минимальная потребность организма. Более того, установлено, что при небольшом потреблении белка в том случае, когда потребность в незаменимых аминокислотах удовлетворяется полностью, лимитирующими становятся заменимые аминокислоты I II [6]. Для обеспечения стабильного азотистого равновесия в организме необходимо примерно в 2 раза больше качественного белка, чем для того, чтобы закрыть потребность в незаменимых аминокислотах. Таким образом, хотя заменимые аминокислоты не являются лимитирующим фактором в белковом питании, но их присутствие в питании также является обязательным. Поступление достаточного количества заменимых аминокислот в составе белков пищи является тем путем, с помощью которого можно обеспечить их оптимальную физиологическую потребность, более легкое и быстрое использования для нужд организма.
ФИЗИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ОТДЕЛЬНЫХ АМИНОКИСЛОТ
В организме человека аминокислоты, помимо строительства белковых молекул, выполняют еще целый ряд важных функций:
• Участвуют в образовании других аминокислот.
• Входят в состав разных природных соединений — коферментов, желчных кислот, антибиотиков.
• Участвуют в образовании гормонов, медиаторов и нейротрансмиттеров.
• Являются источниками метаболитов, принимающих участие в обмене веществ.
К числу медиаторов относятся некоторые аминокислоты (глютаминовая и аспарагиновая кислоты, глицин и дофа), а также биогенные амины.
1-Л
о
<3
о
Биогенные амины образуются при отщеплении от аминокислот карбоксильной группы (реакция декарбоксилирования). К их числу относятся: у-аминомасляная кислота, дофамин, норадреналин, адреналин, серотонин, гистамин. Из триптофана через промежуточный продукт 5-гидрокситриптофан образуется нейромедиатор серотонин. Из глютамино-вой кислоты образуется у-аминомасляная кислота.
Гистамин — важнейший медиатор и нейромедиатор, образуется в основном в тучных клетках и нейтрофильных лейкоцитах и участвует в развитии аллергических и воспалительных реакций. При аллергических реакциях высвобождение гистамина происходит под действием аллергенов, лекарств, некоторых тканевых гормонов. В ЦНС гистамин действует как нейромедиатор. Важным системным эффектом гистамина является расширение кровеносных сосудов, снижение артериального давления и частоты сердечных сокращений. Гистамин также стимулирует секрецию соляной кислоты.
Таблица 6
Адреналин — гормон коры надпочечников, где он образуется из аминокислоты тирозина. Адреналин является ключевым гормоном стресса — «аварийным гормоном» и действует на обмен веществ и сердечно-сосудистую систему: повышает сердечную функцию; сужает сосуды, повышая артериальное давление; расширяет бронхи, увеличивая снабжение кислородом; ускоряет расщепление гликогена до глюкозы, обеспечивая энергией мышечную ткань.
Катехоламины — группа биогенных аминов, которые содержат в качестве общего фрагмента производное фенилаланина — катехол. Все эти вещества берут свое начало от аминокислоты тирозина, из которой первоначально образуется аминокислота дофа (3,4-дигидроксифенилаланин). При ее декар-боксилировании образуется дофамин, который в дальнейшем может превращаться в норадреналин и далее в адреналин. Адреналин выполняет функции, как медиатора, так и гормона [2].
ПРОДУКТЫ МЕТАБОЛИЗМА И СПЕЦИФИЧЕСКИЕ ФУНКЦИИ ОТДЕЛЬНЫХ АМИНОКИСЛОТ [8]
Аминокислота Метаболиты аминокислот Физиологическая функция
Аргинин Образования N0 Креатин Полиамины Молекулярный биорегулятор Предшественник креатинфосфата Экспрессия генов
Аспарагиновая кислота Основа нуклеотида пиримидина Входит в состав нуклеотидов и нуклеиновых кислот
Гистидин Гистамин Нейромедиатор, медиатор воспаления, стимуляция секреции соляной кислоты
Глицин Основа нуклеотида пурина Порфирин Креатин Гиппуровая кислота Гликохолевая желчная кислота Входит в состав нуклеотидов и нуклеиновых кислот Входит в состав гемоглобина и цитохрома Предшественник креатинфосфата Связывание токсических соединений — детоксикация Эмульгирование липидов
Глютаминовая кислота Глютамин у-аминомасляная кислота Транспорт азота в организме, важный источник энергии, предшественник глутатиона Нейромедиатор
Лизин Гидроксилизин Карнитин Составная часть коллагена Транспорт жирных кислот в клетке
Метионин Холин Составная часть фосфолипидов
Серин Этаноламин Холин-ацетилхолин Составная часть фосфолипидов Нейромедиатор
Тирозин Норадреналин-адреналин Тироксин Меланин Нейромедиатор, гормон Гормон щитовидной железы Пигмент кожи и волос
Триптофан Серотонин Никотиновая кислота Нейромедиатор Витамин, составная часть пуриновых нуклеотидов, NAD и NADH
Цистеин Таурин Таурохолевая желчная кислота Антиокислительная активность Предшественник глутатиона
В процессе обмена веществ отдельные аминокислоты превращаются в метаболиты, которые выполняют важные функции в организме человека.-имидазолилпролиновая кислота) выделен в 1896 году. В значительном количестве содержится в гемоглобине, а также входит в состав карнозина и ансерина. По этой причине недостаток гистидина приводит к снижению уровня гемоглобина. Гемоглобин является одним из резервов гистидина в организме и при недостатке гистидина происходит повышенное разрушение гемоглобина, в результате которого высвобождается гистидин. При декарбоксилировании гистидина образуется гистамин. В ряде продуктов при их хранении, например в рыбе и сыре, происходит микробиологическое декарбоксилирование гисти-дина с образованием и накоплением больших количеств гистамина, что может иметь клинические последствия.
Лейцин (а-аминоизокапроновая кислота) впервые получен из сыра в 1819 году. Его много в составе белка (в среднем 10%). При недостатке лейцина в
Таблица 7
питании у детей происходит задержка роста и снижение массы тела, отмечают изменения в почках и щитовидной железе.
Лизин (а,е-диаминокапроновая кислота) выделен в 1889 году из казеина. Недостаточное содержание лизина в широко распространенных зерновых продуктах и сравнительно высокая потребность в нем организма (3-5 г в сутки) делают его одной из наиболее важных незаменимых аминокислот. Его недостаток в питании приводит к уменьшению числа эритроцитов и снижению гемоглобина, возникают дистрофические изменения в мышцах, в печени и в легких, нарушается кальцификация костей. Наиболее богат лизином мышечный белок — миозин, а также гемоглобин.
Метионин (а-амино-у-метилтиомасля-ная кислота) впервые был выделен в 1922 году из казеина. Метионин относится к серосодержащим аминокислотам и играет исключительно важную роль в обмене веществ и в процессах метилирования и трансметилирования. Метионин является основным донатором метильных групп. В процессе деметилирования метионина образуется гомоцистеин. Метильные группы метионина используются для синтеза хо-лина, который участвует в обмене липидов. Метионин, также как и холин, относится к липотропным веществам, оказывая влияние на обмен липидов и фосфолипидов, он важен в профилактике атеросклероза. При высоком уровне метионина наиболее полно проявляется
I
ФУНКЦИИ И ПРИЗНАКИ НЕДОСТАТОЧНОСТИ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ [6]
Аминокислота Функция Признаки недостаточности
Валин Легко переаминируется и теряется, восстанавливает мышцы после физической нагрузки Гипертензия, атаксия
Гистидин Синтез фолиевой кислоты, нуклеиновых кислот, гемоглобина и карнозина, важна при уремии, усиливает секрецию соляной кислоты и пепсина Анемия, нехватка карнози-на, нарушение умственного развития у детей
Изолейцин Много в составе иммуноглобулинов, ключевая роль в утилизации пищи Потеря массы тела, высокий диурез
Лейцин Активирует эндокринную систему, важная роль для иммунной системы Задержка роста и физического развития
Лизин Содержится во всех белках, обеспечивает рост костной ткани, стимулирует митозы, поддерживает половую функцию у женщин, снижает уровень триглицеридов, противовирусное действие Головная боль, тошнота, снижение слуха, медленный рост костной ткани
Метионин Защита печени, детоксикация организма, защита от токсикоза беременных, антиоксидантное действие, синтез гемоглобина, функция щитовидной железы, рост Ожирение, цирроз печени, анемия, кровотечения, атрофия мышц
Треонин Усвоение пищевого белка, липотропное действие, обмен коллагена и эластина, повышает иммунитет Потеря веса, высокий диурез
Фенилала-нин 50% идет на синтез белка, синтез адреналина и тирозина, умственная активность, память, улучшает работу печени и поджелудочной железы Нарушение функции щитовидной железы и надпочечников, гипотония
г^.
о
СО
о
биологическое действие витамина В и фолиевой кислоты. В свою очередь эти витамины стимулируют деметилирование метионина и образование холина. Метионин играет важную роль в функции надпочечников, он необходим для синтеза адреналина. Имеются данные о профилактическом действии метионина при лучевых поражениях и бактериальной интоксикации.
Треонин (а-амино-в-оксимасляная кислота) получен в 1935 году из фибрина. Дефицит треонина вызывает задержку роста и снижение массы тела.
Триптофан (а-амино-в-индолилпропионовая кислота) выделен в 1901 году. Важнейшая из незаменимых аминокислот необходим для роста и поддержания азотистого равновесия, участвует в биосинтезе белков сыворотки крови и гемоглобина. Триптофан играет важную роль в образовании никотиновой кислоты (витамина РР).
Фенилаланин (а-амино-в-фенилпропионовая кислота) выделен в 1879 году. Фенилаланин регулирует функцию щитовидной железы и надпочечников. Из него образуется гормон тироксин, а также аминокислота тирозин, из которого, в свою очередь, образуется адреналин. Тирозин может образовываться из фенилаланина, однако обратного образования фенилаланина из тирозина не происходит.
ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ЗАМЕНИМЫХ АМИНОКИСЛОТ
Аргинин (амино-$-гуанидин валериановая кислота) открыт в 1886 году. Играет очень важную роль в обмене веществ. Белки ядер сперматозоидов содержат до 80% аргинина. Аргинин является предшественником оксида азота (N0), который является важным молекулярным биорегулятором. Введение аргинина приводит к расширению сосудов и существенному снижению артериального давления при гипертонической болезни. Регулярное назначение аргинина способствует улучшению клинического состояния больных ишемической болезнью сердца. Помимо этого он снижает вязкость крови и уменьшает риск тромбоза сосудов. При физической нагрузке аргинин способствует улучшению кровотока в коронарных артериях. Аргинин ускоряет регенерацию печени при ее токсическом поражении и может применяться при лечении цирроза печени и жирового гепатоза. Ингаляционное назначение аргинина при муковис-цидозе приводит к быстрому улучшению функции легких, он помогает при астматическом бронхите.
Известно, что аргинин стимулирует активность Т-лимфоцитов, предотвращает возрастное угнетение фагоцитоза макрофагами. Неспецифическая стимуляция иммунной функции аргинином сопровождается снижение частоты рака толстой кишки и молочной железы у экспериментальных животных. Назначение аргинина больным сахарным диабетом 2-го типа существенно повышает чувствительность к инсулину рецепторов клеток организма. У пациентов
с сахарным диабетом он ингибирует гликозилиро-вание гемоглобина, снижая развитие осложнений. У лиц с повышенной физической нагрузкой аргинин усиливает действие инсулина и увеличивает рост кровеносных капилляров в скелетных мышцах. Аргинин стимулирует выработку соматотропного гормона (гормона роста), способствует уменьшению жировых отложений, росту мышечной массы, увеличивает активность и физическую выносливость, улучшает настроение. Он повышает половую функцию, увеличивают выработку сперматозоидов.
Аргинин не рекомендуют беременным и кормящим женщинам, больным шизофренией. Он может стимулировать свободнорадикальные процессы, поэтому его следует принимать в сопровождении антиоксидантов.
Глицин (аминоуксусная кислота) — наиболее простая из аминокислот, в большом количестве содержится в клетках головного и спинного мозга. Он является метаболитом широкого спектра действия, специфическим регулятором активности нервных клеток, тормозным медиатором. Глицин способен связывать различные эндогенные и экзогенные (лекарства) соединения. В настоящее время его применяют как успокаивающее (седативное) средство, он улучшает мозговую функцию. Менее известна его способность нормализовать синтез коллагена и соединительной ткани.
Глютамин (8-амид-а-аминоглутаровая кислота) — самая распространенная свободная аминокислота в организме человека (в мышечной ткани содержание свободного глютамина составляет 67%). Очень активно обменивается в организме и является наиболее важной для переноса азота в печень и другие органы. Однако содержание глютамина в составе белка сравнительно небольшое — 5-7% (на лейцин приходится 10%). Глютамин является важным энергетическим субстратом для клеток печени, эпителиальных клеток тонкой кишки и иммунных клеток. Введение глютамина тяжелым больным ослабляет потерю мышечной массы улучшает функцию всасывания. Наличие глютамина является необходимым условием синтеза нуклео-тидов — пиринов и пиримидинов.
Глютамин играет ключевую роль в регуляции синтеза глутатиона — трипептида, состоящего из глютаминовой кислоты, цистеина и глицина. Глутатион является важнейшим эндогенным анти-оксидантом и защищает клетки от окислительного повреждения. Потребность в глютамине возрастает при окислительном стрессе.
Глютаминовая кислота (аминоглютаровая кислота) выделена в 1866 году из эндосперма пшеницы. Глютаминовая кислота играет активную роль в обмене белка и в удалении из организма продуктов распада. Глютаминовая кислота является единственной аминокислотой, поддерживающей дыхание клеток головного мозга. Аминокислоту применяют при лечении некоторых нервных и психических заболеваний. Глютаминовая кислота
участвует в поддержании кислотно-щелочного го-меостаза в крови и тканях.
Пролин (пирролидин-а-карбоновая кислота) — способствует заживлению ран, укрепляет сухожилия, связки и суставы, увеличивает физическую работоспособность, укрепляет сердечную мышцу.
Тирозин (а-амино-в-параоксифенилпропионовая кислота) — способствует функционированию щитовидной железы (синтез тироксина), гипофиза, надпочечников, снижает раздражительность, усталость, стресс, укрепляет сон.
Цистеин (ди-а-амино-в-тиопропионовая кислота) — способствует заживлению ожогов и ран, регенерации кожи, активирует иммунную систему, обладает антиоксидантной активностью.
ПОТРЕБНОСТЬ В АМИНОКИСЛОТАХ
Физиологическая потребность в аминокислотах окончательно не установлена. Проведенные исследования позволили выявить ориентиры потребности в незаменимых аминокислотах, отражающие минимальную потребность, «безусловно достаточное количество» и минимальные показатели суточной потребности [6]. Считают, что может быть «только один уровень физиологической потребности в незаменимых аминокислотах для здорового человека, хотя этот уровень для разных людей и в разное время может быть различным». ФАО/ВОЗ предложил в качестве идеального белка аминокислотную шкалу, в которой представлены незаменимые аминокислоты в расчете на 100 г стандартного белка. Однако данная шкала далека от идеального белка, о чем мы будем говорить ниже.
Поскольку заменимые аминокислоты могут образовываться в организме, определение их физиологической потребности также непросто. В 2004 году в РФ предложены (на основе расчета) значения адекватного и верхнего уровня потребности для заменимых и незаменимых аминокислот, табл. 9.
Как видно из таблицы, в 2004 году по сравнению с 1971-м суточная потребность примерно для половины аминокислот была пересмотрена как в сторону повышения (аспарагиновая кислота, серин и аланин), так и в сторону снижения (фенилаланин, валин, метионин, триптофан и глютами-новая кислота). При этом суточная потребность в заменимых аминокислотах выше (в 2,5 раза), чем в незаменимых, и в настоящее время составляет 56,9 г/сутки (72%), против 22,6 г/сутки (28%) для незаменимых аминокислот. В соответствии с современными нормами потребности среди незаменимых аминокислот доминируют: лейцин, фенилаланин и лизин, тогда как среди заменимых: глютамин (включая глютамат), аспарагин (включая аспартат) и серин. Следует подчеркнуть, что в соответствии с нормами потребности заменимых аминокислот должно быть в 2-2,5 раза больше, чем незаменимых.
Аминокислотный скор. Качество белка можно оценивать, сравнивая его аминокислотный состав с составом стандартного (идеального) белка. Такой расчет называют аминокислотным скором (оценкой). Аминокислотный скор определяют по формуле:
I
Таблица 8
ФУНКЦИИ И ПРИЗНАКИ НЕДОСТАТОЧНОСТИ ЗАМЕНИМЫХ АМИНОКИСЛОТ [6]
Аминокислота Функция Признаки недостаточности
Аргинин Образование мочевины, регулирует рост, тормозит рост опухолей за счет стимуляции иммунитета, детоксикация печени Нарушение роста, риск развития сахарного диабета, эректильная дисфункция
Глицин Синтез коллагена и соединительной ткани, седативное действие, нормализует мозговую функцию и сон, связывание аммиака. Увеличивает синтез лецитина Артрозы и артриты Повышенная возбудимость
Глютамин Переносчик аминных групп, важный энергетический субстрат для печени, тонкой кишки и иммунной системы, играет ключевую роль в регуляции синтеза глутатиона Быстрая потеря мышечной массы у больных, окислительный стресс
Пролин Синтез коллагена и соединительной ткани
Таурин Незаменим у детей, необходим в критических состояниях Нарушение развития мозга, миокарда, ЖКТ
Тирозин Синтез тироксина, пигмента кожи меланина, норадренали-на и адреналина Нарушение пигментации кожи
Триптофан Образование альбумина, выработка серотонина, снижает содержание жира, гипотензивное действие, синтез альбумина и глобулинов, гормона роста, антидепрессант, улучшает сон, снижает аппетит Анемия, стерильность, выпадение волос, депрессия, тревожность
Цистеин Процессы регенерации и заживления ожогов и ран Длительное заживление ран
о о
CD CD
(содержание аминокислоты данного белка (г/100 г) / содержание аминокислоты стандартного белка (г/100 г)) х 100.
Если в исследуемом белке содержание какой-либо аминокислоты будет менее 100%, то эта аминокислота окажется лимитирующей. Для взрослого человека в качестве идеального белка применяют шкалу ФАО/ВОЗ, в которой указано содержание каждой из незаменимых аминокислот в расчете на 100 г белка. Однако для человека и животных существует другие белки, которые в определенные периоды жизни являются единственным источником аминокислот для растущего организма. Среди белков животного происхождения к ним относятся белки молока и яйца. Среди растительных белков
Таблица 9
такими белками являются, например, белки сои, орехов, зародыша пшеницы и др. Сравним состав незаменимых аминокислот женского молока, который можно считать эталонным, с составом аминокислот известных животных (табл. 10) и растительных (табл. 11) белков [9].
Как видно из таблицы, состав незаменимых аминокислот женского молока является достаточно уникальным и не похожим как по составу, так и по соотношению аминокислот среди аналогичных по значимости белков коровьего молока и куриного яйца. В составе коровьего молока незаменимых аминокислот на 11% меньше, чем в женском молоке, в белке коровьего молока на 30% меньше валина, хотя метионина на 61% больше. Куриное яйцо по
РЕЙТИНГ ПОТРЕБНОСТИ ВЗРОСЛОГО ЧЕЛОВЕКА В АМИНОКИСЛОТАХ (г/сутки)
Аминокислоты А.Э. Шарпенак [6] Rous, Mesy, Block [6] ФАО/ВОЗ г/100 г белка [4] О.П. Молчанова, 1971 [6] Адекватный уровень (РФ, 2004) Верхний уровень (РФ, 2004)
Незаменимые
Лейцин 10,0*** 9,1 6,6 4-6 4,6 7,3
Фенилаланин 4,5 4,4 6,3* 2-4 4,4* 6,9*
Лизин 8,0 5,2 5,8 3-5 4,1 6,4
Валин 6,0 3,8 3,5 4,0 2,5 3,9
Треонин — 3,5 3,4 2-3 2,4 3,7
Изолейцин — 3,3 2,8 3-4 2,0 3,1
Метионин 2,5 3,8** 2,5** 2-4 1,8** 2,8**
Триптофан 1,6 1,1 1,1 1,0 0,8 1,2
Суммарно, г/сутки 32,6 34,2 32,0 26 22,6 35,3
% аминокислот 32% 34% 28% 28%
Заменимые
Глютамин + глютаминовая кислота 16,0 13,6 21,8
Аспарагин + аспарагиновая кислота 6,0 12,2 19,9
Серин 3,0 8,3 13,3
Аланин 3,0 6,6 10,6
Аргинин 6,0 6,1 9,8
Пролин 5,0 4,5 7,2
Глицин 3,0 3,5 5,6
Гистидин 2,0 2,1 3,4
Тирозин 3-4
Цистеин 2-3
Суммарно, г/сутки 68 50 56,9 91,6
% аминокислот 68% 66% 72% 72%
Сумма всех аминокислот 100 76 79,5 126,9
заменимые : незаменимые 2,12 1,92 2,5 2,6
Примечание:* — фенилаланин + тирозин; ** — метионин + цистеин; *** — лейцин + изолейцин.
Таблица 10
СРАВНИТЕЛЬНЫЙ СОСТАВ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ ЖЕНСКОГО МОЛОКА
И ЖИВОТНЫХ БЕЛКОВ
Аминокислоты Женское молоко Коровье молоко Куриное яйцо Рыба Мясо ФАО/ВОЗ
Незаменимые г/100 г г/100 г % г/100 г % г/100 г % г/100 г % г/100 г %
Лейцин 10,2 9,7 95 9,2 90 9,1 89 8,7 85 6,6 65
Валин 9,9 6,9 70 7,3 74 6,1 62 5,9 60 3,5 35
Лизин 8,5 7,5 88 7,9 93 9,5 112 8,6 101 5,8 68
Изолейцин 7,6 6,2 82 8,0 105 6,0 79 4,5 59 2,8 37
Фенилаланин 5,9 5,7 97 7,3 124 4,8 81 4,5 76 6,3* —
Треонин 5,0 4,6 92 5,9 118 5,1 102 5,3 106 3,4 68
Метионин 2,3 3,7 161 4,1 178 2,6 113 3,2 139 2,5** —
Триптофан 1,9 1,6 84 1,5 79 0,8 42 1,2 63 1,1 58
Аргинин*** 5,0 4,3 86 6,5 130 8,1 162 6,5 130 — —
Гистидин*** 2,7 2,5 93 2,1 78 2,6 96 3,0 111 — —
Суммарно 51,3 45,9 89 51,2 100 44,0 86 41,9 82 32,0 62
Заменимые 48,7 54,1 48,8 56,0 58,1 68,0
Заменимые : незаменимые 0,94 1,18 0,95 1,27 1,39 2,13
Примечание: * — фенилаланин + тирозин; ** — метионин + цистеин; *** — заменимые аминокислоты.
Таблица 11
СРАВНИТЕЛЬНЫЙ СОСТАВ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ ЖЕНСКОГО МОЛОКА
И РАСТИТЕЛЬНЫХ БЕЛКОВ
Аминокислоты Женское молоко Соевые бобы Овсяные хлопья Пшеничная мука Картофель
Незаменимые г/100 г г/100 г % г/100 г % г/100 г % г/100 г %
Лейцин 10,2 7,7 75 7,7 75 6,2 61 10* 56
Валин 9,9 5,3 54 5,3 54 4,3 43 4,0 40
Лизин 8,5 6,9 81 3,0 35 2,5 29 2,6 31
Изолейцин 7,6 5,8 76 5,3 70 3,1 41
Фенилаланин 5,9 5,0 85 4,6 78 4,8 81 6,4 108
Треонин 5,0 4,4 88 3,5 70 2,8 56 3,1 62
Метионин 2,3 1,3 57 1,2 52 1,2 52 1,5 65
Триптофан 1,9 1,3 68 1,3 68 1,3 68 0,6 32
Аргинин** 5,0 7,3 146 7,4 148 4,5 90 1,4 28
Гистидин** 2,7 2,5 93 2,0 74 2,0 74 0,6 22
Суммарно 51,3 37,7 73 31,9 62 26,2 51 28,2 55
Заменимые 48,7 62,3 68,1 73,8 71,8
Заменимые : незаменимые 0,94 1,65 2,13 2,82 2,55
Примечание: * — лейцин + изолейцин; ** — заменимые аминокислоты. а белку женского молока, и кроме фенилаланина, ™ являются дефицитными практически по всем не° а__заменимым аминокислотам, особенно по лизину
(29-35%), валину (40-54%) и метионину (52-65%). Среди наиболее распространенных растительных белков, безусловно, лучшим является белок сои, который содержит существенно больше незаменимых аминокислот, чем другие растительные белки. Однако белок сои дефицитен по валину (54%), метионину (57%) и изолейцину (76%). Обращает на себя внимание доминирование в растительном белке заменимых аминокислот, которых больше чем незаменимых в 1,6-2,5 раза.
Сравнивая состав незаменимых аминокислот «идеального» белка ФАО/ВОЗ с белками женского или коровьего молока, а также яйца, можно увидеть, что последние отличаются принципиально иным составом и соотношением заменимых и незаменимых аминокислот близким к 1,0. Тогда как в «идеальном» белке ФАО/ВОЗ, а также в современных отечественных нормах это соотношение больше 2,0 (2,12-2,5), что характерно для белков растительного происхождения. Таким образом, по составу незаменимых аминокислот к идеальному белку наиболее близки белки яиц и молока. Белки рыбы
и мяса по содержанию аминокислот существенно отличаются от идеала, а растительные белки имеют еще более низкую биологическую ценность.
Биологическая ценность белка — доля задержки азота в организме от всего белка, попавшего в кровь. Мерой биологической ценности является такое количество белка, которое необходимо для поддержания азотистого равновесия в организме человека или животных. Если в белке есть все необходимые организму незаменимые и заменимые аминокислоты в нужном количестве и в необходимых пропорциях, и они полностью всасываются в желудочно-кишечном тракте, то его биологическая ценность будет равна 100. Когда в составе белка соотношение аминокислот неоптимальное, имеется дефицит отдельных незаменимых аминокислот или если белок плохо усваивается, то его биологическая ценность будет заведомо ниже (табл. 12).
Кругооборот белка в организме человека — явление физиологическое и связано с необходимостью обновления белка. Дело в том, что большинство белков и, прежде всего ферменты, живут недолго и могут разрушаться через несколько часов после биосинтеза. Значительно более долговечны структурные белки, гистоны, гемоглобин или компоненты цитоскелета клетки. Полупериод жизни белков в организме человека в среднем составляет 2-8 дней. Постоянное обновление белка играет важную роль в обмене веществ и является весьма эффективным механизмом регуляции активности ферментов, обновления пула иммуноглобулинов, удаления дефектных и ненужных в данное время белков. Быстрое разрушение требуется для удаления из организма биологически активных пептидов и пептидных гормонов. Постоянное разрушение и ресинтез новых белков позволяет клеткам «быстро приводить в соответствие с метаболическими потребностями уровень и активность наиболее важных ферментов» [2]. Ориентировочно в организме взрослого человека ежедневно в результате протеолиза деградирует до аминокислот 300-400 г белка. В то же время примерно столько же аминокислот включается во вновь
Таблица 12
ОЛ
сэ
КАЧЕСТВО НЕКОТОРЫХ ПИЩЕВЫХ БЕЛКОВ ОТНОСИТЕЛЬНО БЕЛКОВ ЖЕНСКОГО МОЛОКА
Пищевой белок Химическая ценность, % Биологическая ценность, % Дефицитные аминокислоты
Женское молоко 100 95 Нет
Яйцо куриное 100 87 Валин (74%), триптофан (79%)
Говядина 98 93 Изолейцин (59%), валин (60%), триптофан (63%), фенилала-нин (76%)
Коровье молоко 95 80-82 Валин (70%)
Рыба 61-86 Триптофан (42%), валин (62%), изолейцин (79%)
Соя 61-73 Валин (64%), метионин (57%), лейцин (75%), изолейцин (76%)
Белый хлеб 47 30 Лизин (29%), изолейцин (41%), валин (43%), метионин (52%), треонин (56%), лейцин (61%), триптофан (68%)
образованные белки. Оба эти процесса формируют кругооборот белка в организме. Учитывая, что в организме содержится около 10 кг различных белков, текущий протеолиз затрагивает всего 3% белка [2].
В результате протеолиза образуются аминокислоты, которые могут быть использованы клеткой для биосинтеза новых белков или поступают в кровь, формируя пул свободных аминокислот, объем которого составляет около 100 г. Деградация белка в клетках осуществляется с помощью двух специализированных систем: лизосом и протеосом. Важную роль в осуществлении деградации белков организма играет система пищеварения, в которой переваривается, а затем реутилизируется значительная часть плазматических и других эндогенных белков, а также белки, которые попадают в просвет кишки при слущивании завершивших свою работу эпителиальных клеток. В ходе деградации белка может накапливаться аминный азот, который, в отличие от углеводородной части аминокислот, непригоден для получения энергии. Поэтому аминогруппы, которые не могут быть использованы повторно, например, в реакциях трансаминирования, превращаются в аммиак, а затем — в мочевину.
В организме человека существует весьма эффективный механизм регуляции уровня белка. Чем выше дефицит белка в организме, тем лучше
Таблица 13
усваивается пищевой белок, и тем меньше будут потери аминокислот с калом и мочой. С другой стороны, чем больше белка содержится в пище, тем хуже он будет усваиваться. При отсутствии дефицита белка в организме его усвоение в желудочно-кишечном тракте также снижается. Механизм регуляции уровня белка в организме человека также связан с увеличением кругооборота белка и аминокислот при его дефиците и снижением кругооборота и усилением катаболизма белка при его избыточном поступлении с пищей. Таким образом, организм способен в определенной степени сглаживать дефицит белка, в то же время препятствуя перегрузке организма пищевым белком. Например, после приема пищи с высоким содержанием белка более половины аминокислот (57%), поступающих в печень, превращается в мочевину, 14% аминокислот остаются в печени и 23% — выходят в кровь и поступают в пул свободных аминокислот. Только 6% аминокислот используется печенью для синтеза белков [2].
Свободные аминокислоты, находящиеся в крови, захватываются печенью, почками, поджелудочной железой, тонкой кишкой,
РЕЙТИНГ СОДЕРЖАНИЯ АМИНОКИСЛОТ В КРОВИ И В МОЧЕ ЧЕЛОВЕКА [10]
Аминокислота Содержание в крови, мг/100 мл Экскреция с мочой в сутки, мг
Незаменимые диапазон в среднем
Валин 2,88 4-6 5,0
Лизин 2,72 7-48 27,5
Лейцин 1,86 9-26 17,5
Треонин 1,67 15-53 34,0
Изолейцин 1,34 14-28 21
Триптофан 1,27
Метионин 0,52 5-10 7,5
Заменимые
Аланин 3,40 21-71 46
Пролин 2,36 Менее 10 10
Аргинин 1,62
Глицин 1,50 21-71 46
Цистеин 1,47 10-21 15,5
Гистидин 1,38 113-320 217
Серин 1,12 27-73 50
Тирозин 1,04 15-49 32
Глютамат 0,70 8-40 24
Аспартат 0,03 Менее 10 10
т
сэ
более 85% свободных аминокислот покидает систему кровообращения в течение 5-15 минут, поэтому концентрация аминокислот в крови достаточно низкая — 35-70 мг/100 мл [2] (табл. 13).
ЗАКЛЮЧЕНИЕ
Таким образом, потребность человека в белке во многом зависит от качественного состава аминокислот, и прежде всего незаменимых. Поэтому белков животного происхождения, которые наиболее близки по составу аминокислот к белкам организма человека, требуется меньше, чем белков растительных, аминокислотный состав которых существенно отличается от оптимального для человека. Например, при употреблении белков с высокой биологической ценностью (мяса, молока, яиц) для удовлетворения потребности взрослого человека достаточно 0,75 г/ кг массы тела (52,5 г белка/сутки). При употреблении смешанного рациона (белки животного и растительного происхождения) потребность в белке будет составлять 0,85-1,0 г кг массы тела (59,5-70,0 г белка/сутки). Более того, при потреблении животных белков с калом теряется 2,5-3,0% азота, тогда как употреблении в пищу растительных продуктов, богатых клетчаткой (овощи, зерновые) — до 40% пищевого азота [6].
Низкие нормы потребности в белке, которые в свое время предлагали Ро и Читтенден, а затем и Вильямс, были основаны на классических представлениях об азотистом балансе (равновесии). Согласно этим представлениям для поддержания азотистого (белкового) равновесия в организме большинства взрослых людей, которые здоровы и находятся в покое, может быть достаточно 30 г белка/сутки. Читтенден, который изучал белковый обмен у молодых людей (студентов, солдат, спортсменов), показал, что азотистое равновесие вполне может обеспечить 55-60 г белка/сутки [7].
В принципе для поддержания азотистого равновесия у взрослого и здорового человека на минимальном уровне достаточно 36,9 г молочного белка/ сутки. С учетом высокого качества белка куриного яйца минимальная потребность в белке для поддержания азотистого равновесия может составлять 0,34-0,43 г белка/кг массы тела в сутки, или 28 г яичного белка в сутки [11]. Однако для обеспечения «надежного уровня потребления», белка требуется больше — 56,25-57,5 г белка казеина в сутки при калорийности пищевого рациона около 3000 ккал/ сутки. Для нормального физического развития, повышения работоспособности и устойчивости к неблагоприятным внешним воздействиям, а также сопротивляемости организма к инфекции белка нужно еще больше, чем то количество, которое всего лишь «обеспечивает поддержание азотистого равновесия». В этой связи выделяют «оптимальную потребность человека в белке», которая должна превышать надежный уровень на 50% и будет составлять 84,4-87,5 г белка/сутки [7].
Таким образом, потребность в белке должна складываться из некоего минимального количества — «безопасного уровня белка», который обеспечивает «надежный уровень потребления», и «дополнительного количества белка», который учитывает особенности обмена веществ, состояние здоровья и качественный состав пищевого рациона. Безопасный уровень белка обеспечивает надежное поддержание азотистого равновесия в организме определенного числа людей, а введение дополнительного количества белка необходимо для заполнения так называемых «лабильныхрезервов белка».
В 1973 году ФАО/ВОЗ путем расчета определило, что величина средней потребности в белке населения развитых стран должно составлять 48,5-56,6 г/ сутки (при относительной биологической ценности 70-80%). Для развивающихся стран, в питании которых присутствует большая доля низкокачественного растительного белка (относительная биологическая ценность — 60-70%), средняя потребность в белке была определена равной 56,6-65,5 г в сутки [11].
Чем ниже биологическая ценность белка, тем больше его требуется. Однако в этом случае некоторые аминокислоты будут поступать в организм человека в избыточном количестве, превышающем текущие потребности, связанные с биосинтезом белка и специфическим метаболизмом отдельных аминокислот. Белки и аминокислоты не способны запасаться в организме, поэтому лишние аминокислоты будут либо выводиться из организма, либо подвергаться метаболической деградации. Содержащийся в аминокислотах азот будет превращаться в мочевину и креатинин и выделяться с почками, углеродный скелет — использоваться для биосинтеза глюкозы или жирных кислот, а другая его часть — окисляться до углекислого газа и воды с образованием АТФ.
Потребность в белке во многом зависит от калорийности и состава других компонентов пищевого рациона — углеводов и липидов (табл. 14). Низкокалорийные диеты или диеты с недостаточным количеством углеводов увеличивают потребность в белке, поскольку часть белка начинает расходоваться для образования глюкозы и кетоновых тел. При отсутствии в пищевом рационе углеводов и жиров для достижения азотистого равновесия пищевого белка требуется в 5 раз больше [6]. С увеличением калорийности пищевого рациона потребность в белке снижается.
Таким образом, рассматривая потребность организма в белке и аминокислотах, можно сделать следующие выводы:
• Белок пищи необходим не только для биосинтеза белков организма, но и для решения энергетических проблем, особенно в критических ситуациях.
• Отдельные аминокислоты пищевого белка выполняют в организме самостоятельную функцию, что необходимо учитывать при назначении
Таблица 14
ВЛИЯНИЕ КАЛОРИЙНОСТИ РАЦИОНА НА ПОТРЕБНОСТЬ В БЕЛКЕ ДЛЯ ПОДДЕРЖАНИЯ АЗОТИСТОГО РАВНОВЕСИЯ [12]
Калорийность рациона Потребность в белке для нулевого баланса Безопасный уровень потребления белка
ккал/кг кал/70 кг г/кг г/70 кг г/кг г/70 кг
40 2800 0,78 54,6 1,02 71,4
45 3150 0,56 39,2 0,74 51,8
48 3360 0,51 35,7 0,62 43,4
57 4000 0,42 29,4 0,50 35
Рекомендуемая норма потребления 0,80 56
I
аминокислот, используя отдельные аминокислоты для коррекции питания.
• Идеальными белками по составу и пропорциям незаменимых аминокислот являются белки молока и куриного яйца и в меньшей степени — белки мяса. Растительные белки содержат аминокислоты в иных пропорциях и дефицитны по большинству незаменимых аминокислот.
• Избыточное потребление белковой пищи «не идет нам впрок», поскольку лишние аминокислоты пищи будут разрушаться, а белковый азот удаляться из организма. Потребление белка
должно быть равномерным на протяжении суток, что позволяет оптимизировать его всасывание и утилизацию, а также свести к минимуму потери аминокислот.
• Умеренное потребление белка не является столь катастрофичным для организма человека, поскольку при этом снижаются потери аминокислот.
• Для достижения разных целей необходимы белковые модули с разным количеством и соотношением как заменимых, так и незаменимых аминокислот.
ЛИТЕРАТУРА
1. ЛенинджерА.Л. Основы биохимии. — М.: Мир, 1985. — Т. 1. — 365 с.
2. КольманЯ., РемК.-Г. Наглядная биохимия. — М.: Мир, 2000. — 469 с.
3. Попова Т.С., Шестопалов А.Е., Тамазашвили Т.Ш., Лейдерман И.Н. Нутритивная поддержка больных в критических состояниях. — М., 2002. — 320 с.
4. Мартинчик А.Н., Маев И.В., Петухов А.Б. Питание человека (основы нутрициологии). — М.: ГОУ ВУНМЦ МЗ РФ, 2002. — 572 с.
5. Ньюсхолм Э., Старт К. Регуляция метаболизма. — М.: Мир, 1977. — 408 с.
6. Гигиена питания / Под ред. К.С. Петровского. — М.: Медицина, 1971.— Т. 1. — 511 с.
7. Высоцкий В.Г. К оценке потребности человека в белке // Вопросы питания. — 1978. — № 6. — С. 8-17.
8. Основы клинического питания. — Петрозаводск: ИнтелТек, 2003. — 412 с.
9. Химический состав пищевых продуктов. Книга 2. — М.: ВО Агропромиздат, 1987. — 360 с.
10. Большая медицинская энциклопедия. — М.: Медицина, 1974. — Т. 1. — С. 364-371.
11. Energy and Protein Requirements // WHO Tech. Rep. Ser. — 1973. — No 522. — P. 40-72.
12. Общая нутрициология. — М.: МЕДпресс-информ, 2005. — 392 с.
LЛ
CD
Пищевые аминокислоты — Компания НЕО Кемикал
Аминокислоты — основной элемент построениях всех белков. Они делятся на заменимые, незаменимые и условно незаменимые.
Незаменимые аминокислоты – те аминокислоты, которые не могут быть синтезированы в организме человека и должны поступать в организм с пищей.
Условно незаменимыми кислотами называются аминокислоты, которые синтезируются организмом человека при определенных условиях. Часто организм испытывает недостаток этих аминокислот.
К заменимым относятся аминокислоты, которые наш организм способен синтезировать самостоятельно.
ВСАА — это комплекс из трех незаменимых аминокислот: L-лейцин, L-изолейцин и L-валин, основной материал для построения новых мышц. Составляют 35% всех аминокислот в мышцах и принимают важное участие в процессах анаболизма и восстановления, обладают антикатаболическим действием. BCAA не могут синтезироваться в организме, поэтому получать человек их может только с пищей и специальными добавками. BCAA в первую очередь метаболируются в мышцах, их можно рассматривать как основное «топливо» для мышц, которое повышает спортивные показатели, улучшает состояние здоровья, к тому же они абсолютно безопасны.
L — Валин — Один из главных компонентов в росте и синтезе тканей тела. Вместе с лейцином и изолейцином служит источником энергии в мышечных клетках, а также препятствует снижению уровня серотонина. Также необходим для поддержания нормального обмена азота в организме, входит в состав практически всех известных белков, является незаменимой аминокислотой не синтезируется в организме человека и поэтому должен поступать с пищей. Входит в состав ВСАА.
L — Лейцин — Лейцин входит в состав природных белков, применяется для лечения болезней печени, анемий и других заболеваний. В среднем суточная потребность организма в лейцине для здорового человека составляет 4-6 грамм. Входит в состав ВСАА и многих БАД
L — Изолейцин — это аминокислота входящая в состав всех природных белков. Является незаменимой аминокислотой, что означает, что изолейцин не может синтезироваться в организме человека и должен поступать в него с пищей. Участвует в энергетическом обмене..
L — Глутамин – одна из 20 стандартных аминокислот, входящих в состав белка. Самая распространенная аминокислота организма, мышцы состоят из неё на 60%. Широко используется в спортивном питании и при производстве БАД.
Креатин – Креатин чаще всего используется для повышения эффективности физических нагрузок и увеличения мышечной массы у спортсменов. Существуют научные исследования, поддерживающие использование креатина для улучшения спортивной активности молодых и здоровых людей во время кратковременной интенсивной активности и нагрузки
Аминокислоты, без которых нам не жить
Аминокислоты называют «строительным материалом» при синтезе в организме человека целого ряда белков. И любой белок – это цепочка из аминокислот, которые в определённой последовательности соединены между собой. При отсутствии хотя бы одной аминокислоты происходит сбой.
Из двадцати известных аминокислот, восемь являются незаменимыми. То есть сам организм синтезировать их не может, поэтому должен получать их вместе с пищей. Если же он их не получает, то нарушается работа нервной системы, водно-солевой обмен и многие другие функции в организме.
К незаменимым кислотам относятся:
Валин, который с лейцином и изолейцином участвует в синтезе тканей тела и стимулирует их рост, все трое они служат источником энергии в мышечных клетках.
Валин отвечает за мышечную координацию, понижает чувствительность организма к жаре, холоду и боли, поддерживает уровень гормона «счастья» – серотонина.
Содержится: в мясе, грибах, бобовых, зерновых, арахисе и молочных продуктах.
Лейцин необходим для активизации умственной деятельности и хорошей памяти, он защищает мышечные волокна от повреждений, восстанавливает кожные покровы, мышцы и кости, стимулирует гормон роста и снижает уровень сахара в крови. Содержится в нежирном мясе, печени, рыбе, твороге, молоке, натуральном йогурте, кефире, гречихе, чечевице, овсе, неочищенном рисе, люцерне.
Изолейцин так же отвечает за уровень сахара в крови, обеспечивает энергией все к летки и повышает выносливость. Содержится: в мясе птицы, печени, рыбе, яйцах, бобовых, чечевице, во ржи, миндале, кешью, сое, семечках.
Лизин отвечает за работу мозга и ясное мышление до глубокой старости, поддерживает энергию и следит за здоровьем сердца, оказывает сопротивление вирусам, способствует усвоению кальция, восстанавливает ткани, формируя коллаген. Содержится в мясе птицы, рыбе, молочных продуктах, бобовых, кукурузе, орехах, семечках, какао, в горьком шоколаде.
Метионин снижает содержание холестерина и улучшает работу печени, препятствует развитию депрессии.
Содержится в рыбе, желтке яиц, бобовых, зелёном горошке, гречихе, капусте, моркови, в апельсинах, арбузах и дыне.
Треонин – препятствует ожирению печени, участвует жировом и белковом обмене, повышает иммунитет. Содержится: в яйцах, молочных продуктах, бобовых, орехах.
Триптофан нормализует психическое состояние, отвечает за нормальное функционирование мозга и замедляет общее старение организма. Кроме того снижает аппетит и способствует повышению выработки гормона роста. Содержится в мясе птицы, рыбе, молоке, твороге, бобовых, орехах, кунжуте, бананах, в винограде и таких сухофруктах, как курага, инжир, финики.
Фенилаланин снижает аппетит и повышает настроение, а так же отвечает за быстроту реакций и уменьшает чувствительность организма к боли. Содержится он в говядине, курином мясе, рыбе, яйцах, твороге, молоке, сметане.
Получается, что для того, чтобы обеспечить организм незаменимыми аминокислотами, нужно потратить не так уж много денег.
Бобовые, злаки, семечки, овощи стоят недорого, мясо птицы, молочные продукты, яйца тоже доступны, есть недорогие сорта рыбы. Дорогими можно назвать только шоколад, орехи и некоторые сухофрукты. Но и их в небольшом количестве можно себе позволить – те же финики и курагу в виде перекуса на работе вместо тоже недешёвых конфет.
Для того чтобы сохранить здоровье, врачи советуют не забывать о крестоцветных – всех видах капусты, о цитрусовых и листовых огородных травах. А так же об оливковом и подсолнечном масле.
Всё это вместе снизит риск развития сердечно-сосудистых заболеваний, инсультов, помешает образованию склеротических бляшек и развитию слабоумия в старости.
Биохимия, незаменимые аминокислоты — StatPearls
Введение
Незаменимые аминокислоты, также известные как незаменимые аминокислоты, представляют собой аминокислоты, которые люди и другие позвоночные не могут синтезировать из промежуточных продуктов метаболизма. Эти аминокислоты должны поступать из экзогенной диеты, потому что в организме человека отсутствуют метаболические пути, необходимые для синтеза этих аминокислот. [1] [2] В питании аминокислоты подразделяются на незаменимые и несущественные. Эти классификации возникли в результате ранних исследований питания человека, которые показали, что определенные аминокислоты необходимы для роста или азотного баланса, даже когда имеется достаточное количество альтернативных аминокислот.[3] Хотя возможны вариации в зависимости от метаболического состояния человека, общепринято считать, что существует девять незаменимых аминокислот, включая фенилаланин, валин, триптофан, треонин, изолейцин, метионин, гистидин, лейцин и лизин. Мнемоническое слово PVT TIM HaLL («частный Тим Холл») — это широко используемое устройство для запоминания этих аминокислот, поскольку оно включает первую букву всех незаменимых аминокислот. Что касается питания, девять незаменимых аминокислот можно получить из одного полноценного белка.Полноценный белок по определению содержит все незаменимые аминокислоты. Полноценные белки обычно получают из источников питания животного происхождения, за исключением сои. [4] [5] Незаменимые аминокислоты также доступны из неполноценных белков, которые обычно представляют собой продукты растительного происхождения. Термин «ограничивающая аминокислота» используется для описания незаменимой аминокислоты, присутствующей в пищевом белке в наименьшем количестве по сравнению с эталонным пищевым белком, таким как яичные белки. Термин «ограничивающая аминокислота» может также относиться к незаменимой аминокислоте, которая не отвечает минимальным требованиям для человека.[6]
Fundamentals
Аминокислоты являются основными строительными блоками белков, и они служат азотистыми скелетами для таких соединений, как нейротрансмиттеры и гормоны. В химии аминокислота — это органическое соединение, которое содержит функциональные группы как амино (-Nh3), так и карбоновой кислоты (-COOH), отсюда и название аминокислота. Белки — это длинные цепи или полимеры определенного типа аминокислоты, известной как альфа-аминокислота. Альфа-аминокислоты уникальны, потому что функциональные группы амино и карбоновых кислот разделены только одним атомом углерода, который обычно является хиральным углеродом.В этой статье мы сосредоточимся исключительно на альфа-аминокислотах, из которых состоят белки. [7] [8]
Белки представляют собой цепочки аминокислот, которые собираются через амидные связи, известные как пептидные связи. Разница в группе боковой цепи или R-группе определяет уникальные свойства каждой аминокислоты. Затем уникальность различных белков определяется тем, какие аминокислоты они содержат, как эти аминокислоты расположены в цепи, и другими сложными взаимодействиями, которые цепь осуществляет с собой и с окружающей средой.Эти полимеры аминокислот способны производить разнообразие, наблюдаемое в жизни.
Существует около 20 000 уникальных генов, кодирующих белок, ответственных за более чем 100 000 уникальных белков в организме человека. Хотя в природе встречаются сотни аминокислот, для производства всех белков, содержащихся в организме человека и в большинстве других форм жизни, необходимо всего около 20 аминокислот. Все эти 20 аминокислот представляют собой L-изомер, альфа-аминокислоты. Все они, кроме глицина, содержат хиральный альфа-углерод.И все эти аминокислоты являются L-изомерами с R-абсолютной конфигурацией, за исключением глицина (без хирального центра) и цистеина (S-абсолютная конфигурация из-за серосодержащей R-группы). Следует упомянуть, что аминокислоты селеноцистеин и пирролизин считаются 21-й и 22-й аминокислотами соответственно. Это недавно открытые аминокислоты, которые могут включаться в белковые цепи во время синтеза рибосомных белков. Пирролойзин жизненно важен; однако люди не используют пирролизин для синтеза белка.После трансляции эти 22 аминокислоты также могут быть модифицированы посредством посттрансляционной модификации, чтобы добавить дополнительное разнообразие в генерацию белков. [8]
От 20 до 22 аминокислот, которые составляют белки, включают:
Из этих 20 аминокислот девять незаменимы:
Фенилаланин
Валин
Триптофан
Треонин
Метионин
Гистидин
Лейцин
Лизин
Изолейцин
Незаменимые, также известные как незаменимые аминокислоты, можно исключить из рациона.Организм человека может синтезировать эти аминокислоты, используя только незаменимые аминокислоты. Для большинства физиологических состояний здорового взрослого человека указанные выше девять аминокислот являются единственными незаменимыми аминокислотами. Однако такие аминокислоты, как аргинин и гистидин, можно считать условно незаменимыми, поскольку организм не может синтезировать их в достаточных количествах в течение определенных физиологических периодов роста, включая беременность, рост в подростковом возрасте или восстановление после травмы [9].
Механизм
Хотя для синтеза белка человека требуется двадцать аминокислот, люди могут синтезировать только половину этих необходимых строительных блоков.У людей и других млекопитающих есть только генетический материал, необходимый для синтеза ферментов, обнаруженных в путях биосинтеза заменимых аминокислот. Вероятно, есть эволюционное преимущество в удалении длинных путей, необходимых для синтеза незаменимых аминокислот с нуля. Потеряв генетический материал, необходимый для синтеза этих аминокислот, и полагаясь на окружающую среду, чтобы обеспечить эти строительные блоки, эти организмы могут снизить расход энергии, особенно при репликации своего генетического материала.Эта ситуация дает преимущество в выживании; однако это также создает зависимость от других организмов в отношении материалов, необходимых для синтеза белка. [10] [11] [12]
Клиническая значимость
Классификация незаменимых и заменимых аминокислот была впервые представлена в исследованиях питания, проведенных в начале 1900-х годов. Одно исследование (Rose 1957) показало, что человеческое тело способно поддерживать азотный баланс при диете, состоящей только из восьми аминокислот. [13] Эти восемь аминокислот были первой классификацией незаменимых аминокислот или незаменимых аминокислот.В это время ученые смогли идентифицировать незаменимые аминокислоты, проведя исследования кормления очищенными аминокислотами. Исследователи обнаружили, что, когда они исключили из рациона отдельные незаменимые аминокислоты, субъекты не смогли бы расти или поддерживать азотный баланс. Более поздние исследования показали, что некоторые аминокислоты являются «условно незаменимыми» в зависимости от метаболического состояния субъекта. Например, хотя здоровый взрослый может синтезировать тирозин из фенилаланина, у маленького ребенка может не развиться необходимый фермент (фенилаланингидроксилаза) для осуществления этого синтеза, и поэтому они не смогут синтезировать тирозин из фенилаланина, что делает тирозин незаменимым продуктом. незаменимая аминокислота в этих условиях.Эта концепция также появляется при различных болезненных состояниях. По сути, отклонения от стандартного метаболического состояния здорового взрослого человека могут привести организм в такое метаболическое состояние, при котором для баланса азота требуется больше, чем стандартные незаменимые аминокислоты. В целом, оптимальное соотношение незаменимых и заменимых аминокислот требует баланса, зависящего от физиологических потребностей, которые различаются у разных людей. Поиск оптимального соотношения аминокислот в общем парентеральном питании при заболеваниях печени или почек является хорошим примером различных физиологических состояний, требующих различного потребления питательных веществ.Следовательно, термины «незаменимые аминокислоты» и «заменимые аминокислоты» могут вводить в заблуждение, поскольку все аминокислоты могут быть необходимы для обеспечения оптимального здоровья. [1]
При состояниях недостаточного потребления незаменимых аминокислот, таких как рвота или низкий аппетит, могут появиться клинические симптомы. Эти симптомы могут включать депрессию, беспокойство, бессонницу, утомляемость, слабость, задержку роста у молодых и т. Д. Эти симптомы в основном вызваны недостаточным синтезом белка в организме из-за нехватки незаменимых аминокислот.Необходимое количество аминокислот необходимо для выработки нейромедиаторов, гормонов, роста мышц и других клеточных процессов. Эти недостатки обычно присутствуют в более бедных частях мира или у пожилых людей, которым не уделяется должного ухода [2].
Квашиоркор и маразм — примеры более серьезных клинических расстройств, вызванных недоеданием и недостаточным потреблением незаменимых аминокислот. Квашиоркор — это форма недоедания, характеризующаяся периферическими отеками, сухим шелушением кожи с гиперкератозом и гиперпигментацией, асцитом, нарушением функции печени, иммунодефицитом, анемией и относительно неизменным составом мышечных белков.Это результат диеты с недостаточным содержанием белка, но достаточным количеством углеводов. Маразм — это форма недоедания, характеризующаяся истощением, вызванным недостатком белка и недостаточным потреблением калорий в целом. [14]
Повышение квалификации / Контрольные вопросы
Рисунок
Родовая структура аминокислот. Внесен и создан Майклом Лопесом, B.S.
Ссылки
- 1.
- Hou Y, Yin Y, Wu G. Необходимость в питании «незаменимых аминокислот» для животных и людей.Exp Biol Med (Maywood). 2015 август; 240 (8): 997-1007. [Бесплатная статья PMC: PMC44] [PubMed: 26041391]
- 2.
- Hou Y, Wu G. Adv Nutr. 01 ноября 2018 г .; 9 (6): 849-851. [Бесплатная статья PMC: PMC6247364] [PubMed: 30239556]
- 3.
- Reeds PJ. Незаменимые и незаменимые аминокислоты для человека. J Nutr. 2000 Июл; 130 (7): 1835С-40С. [PubMed: 10867060]
- 4.
- Le DT, Chu HD, Le NQ. Улучшение питательного качества растительных белков с помощью генной инженерии.Curr Genomics. 2016 июн; 17 (3): 220-9. [Бесплатная статья PMC: PMC4869009] [PubMed: 27252589]
- 5.
- Hoffman JR, Falvo MJ. Белок — какой лучше? J Sports Sci Med. 2004 сентябрь; 3 (3): 118-30. [Бесплатная статья PMC: PMC3
4] [PubMed: 24482589] - 6.
- Джуд С., Капур А.С., Сингх Р. Аминокислотный состав и химическая оценка качества белка зерновых культур при поражении насекомыми. Растительная еда Hum Nutr. 1995 сентябрь; 48 (2): 159-67. [PubMed: 8837875]
- 7.
- ЛаПелуса А., Кошик Р. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 5 декабря 2020 г. Физиология, белки. [PubMed: 32310450]
- 8.
- Ву Г. Аминокислоты: метаболизм, функции и питание. Аминокислоты. 2009 Май; 37 (1): 1-17. [PubMed: 1
95]
- 9.
- de Koning TJ. Нарушения синтеза аминокислот. Handb Clin Neurol. 2013; 113: 1775-83. [PubMed: 23622400]
- 10.
- Guedes RL, Prosdocimi F, Fernandes GR, Moura LK, Ribeiro HA, Ortega JM.Пути биосинтеза аминокислот и ассимиляции азота: большая делеция генома в ходе эволюции эукариот. BMC Genomics. 2011 22 декабря; 12 Дополнение 4: S2. [Бесплатная статья PMC: PMC3287585] [PubMed: 22369087]
- 11.
- D’Souza G, Waschina S, Pande S, Bohl K, Kaleta C, Kost C. биосинтетические гены у бактерий. Эволюция. 2014 сентябрь; 68 (9): 2559-70. [PubMed: 24
8]
- 12.
- Сигенобу С., Ватанабе Х., Хаттори М., Сакаки И., Исикава Х.Последовательность генома внутриклеточного бактериального симбионта тлей Buchnera sp. APS. Природа. 2000, 7 сентября; 407 (6800): 81-6. [PubMed: 109
]
- 13.
- ROSE WC. Потребности в аминокислотах взрослого человека. Nutr Abstr Rev.1957 июл; 27 (3): 631-47. [PubMed: 13465065]
- 14.
- Benjamin O, Lappin SL. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 19 июля 2020 г., Квашиоркор. [PubMed: 29
3] 20 аминокислот, входящих в состав белков | Улучшение жизни с помощью аминокислот | О нас | Глобальный веб-сайт Ajinomoto Group
Как известно, различные аминокислоты являются основными компонентами, из которых состоят белки.Аминокислоты составляют важную часть человеческого тела и диеты. Они чрезвычайно важны для правильного функционирования человеческого тела; следовательно, важно понимать, сколько аминокислот составляют белки. Давайте перейдем к выяснению, сколько аминокислот действительно составляют белки.
Сколько аминокислот помогает вырабатывать белки?
В природе идентифицировано около 500 аминокислот, но только 20 аминокислот составляют белки, обнаруженные в организме человека. Давайте узнаем обо всех этих 20 аминокислотах и типах различных аминокислот.
Типы всех аминокислот
Все 20 аминокислот подразделяются на две разные аминокислотные группы. Незаменимые и заменимые аминокислоты вместе составляют 20 аминокислот. Из 20 аминокислот 9 являются незаменимыми аминокислотами, а остальные — заменимыми аминокислотами. Давайте посмотрим на каждую аминокислоту в соответствии с их классификацией.
Незаменимые аминокислоты
BCAA (валин, лейцин и изолейцин)
Аминокислоты с разветвленной цепью (BCAA) представляют собой группу из трех аминокислот (валин, лейцин и изолейцин), которые имеют молекулярную структуру с разветвлением.BCAA богаты мышечными белками, стимулируют рост мышц в организме и обеспечивают энергию во время упражнений.
Лизин
Лизин — одна из наиболее часто упоминаемых незаменимых аминокислот. Такие продукты, как хлеб и рис, как правило, содержат мало лизина. Например, по сравнению с идеальным аминокислотным составом в пшенице мало лизина. Университет Организации Объединенных Наций провел исследование людей в развивающихся странах, которые зависят от пшеницы как источника белка, и обнаружил нехватку лизина в их рационе.Недостаток лизина и других аминокислот может привести к серьезным проблемам, таким как задержка роста и тяжелые заболевания.
Треонин
Незаменимая аминокислота, которая используется для создания активного центра ферментов.
Фенилаланин
Незаменимая аминокислота, которая используется для производства многих типов полезных аминов.
метионин
Незаменимая аминокислота, которая используется для производства множества различных веществ, необходимых организму.
Гистидин
Незаменимая аминокислота, используемая для производства гистамина.
Триптофан
Незаменимая аминокислота, используемая для производства многих типов полезных аминов.
Незаменимые аминокислоты
Глютамин
Глютамин — одна из самых распространенных аминокислот в организме. Глютамин защищает желудок и желудочно-кишечный тракт. В частности, глутамин используется для выработки энергии в желудочно-кишечном тракте. Глютамин способствует метаболизму алкоголя для защиты печени.
Аспартат
Аспартат — одна из аминокислот, наиболее пригодных для получения энергии.Аспартат — одна из аминокислот, наиболее близко расположенных к циклу трикарбоновых кислот (ТСА) в организме, который производит энергию. Цикл TCA подобен двигателю, который приводит в движение автомобили. Каждая клетка нашего тела производит энергию.
Глутамат
Бульон комбу, используемый в японской кулинарии, содержит глутамат. Глутамат является основой умами, а свободный глутамат содержится в комбу, помидорах и сыре. Внутри организма глутамат используется как важный источник незаменимых аминокислот.
Аргинин
Аргинин играет важную роль в открытии вен для улучшения кровотока. Оксид азота, открывающий вены, сделан из аргинина. Аргинин — полезная аминокислота для удаления избытка аммиака из организма. Аргинин повышает иммунитет.
Аланин
Аланин поддерживает функцию печени. Аланин используется для производства глюкозы, необходимой организму. Аланин улучшает метаболизм алкоголя.
Proline
Пролин — одна из аминокислот, содержащихся в коллагене, который составляет ткань кожи.Пролин — одна из важнейших аминокислот естественного увлажняющего фактора (NMF), который сохраняет кожу влажной.
Цистеин
Цистеин уменьшает количество производимой черной пигментации меланина. Цистеин много в волосах на голове и теле. Цистеин увеличивает количество желтого меланина, производимого вместо черного меланина.
Аспарагин
Аминокислота, обнаруженная из спаржи. И аспарагин, и аспартат расположены близко к циклу трикарбоновой кислоты (TCA), который производит энергию.
Серин
Аминокислота, используемая для производства фосфолипидов и глицериновой кислоты.
Глицин
Незаменимая аминокислота, вырабатываемая в организме. В организме много глицина. Он действует как передатчик в центральной нервной системе и помогает регулировать такие функции организма, как движение и сенсорное восприятие. Глицин составляет одну треть коллагена.
Тирозин
Тирозин используется для получения многих типов полезных аминов. Тирозин относится к группе ароматических аминокислот вместе с фенилаланином и триптофаном.
Контент, который может вам понравиться
Что такое аминокислоты?
Аминокислоты — незаменимые соединения, общие для всех живых существ, от микробов до людей. Все живые тела содержат одни и те же 20 типов аминокислот. Что такое …
Факты об аминокислотах
Часто задаваемые вопросы об аминокислотахОбщие вопросы об аминокислотахВ чем разница между аминокислотой и пептидом? Белки состоят из сотен…
Незаменимые аминокислоты: таблица, сокращения и структура
Аминокислота AlaАланин, обнаруженный в белке в 1875 году, составляет 30% остатков в шелке. Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, сопротивление растяжению и гибкость. В биосинтезе белков участвует только l-стереоизомер.
Аминокислота ArgУ человека аргинин вырабатывается при переваривании белков.Затем он может быть преобразован организмом в оксид азота, химическое вещество, которое, как известно, расслабляет кровеносные сосуды.
Благодаря своему сосудорасширяющему действию аргинин был предложен для лечения людей с хронической сердечной недостаточностью, высоким уровнем холестерина, нарушением кровообращения и высоким кровяным давлением, хотя исследования по этим направлениям все еще продолжаются. Аргинин также может быть получен синтетическим путем, и родственные аргинину соединения можно использовать для лечения людей с дисфункцией печени из-за их роли в стимулировании регенерации печени.Хотя аргинин необходим для роста, но не для поддержания организма, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.
Аминокислота AsnВ 1806 году аспарагин был очищен из сока спаржи, что сделало его первой аминокислотой, выделенной из природного источника. Однако только в 1932 году ученые смогли доказать, что аспарагин присутствует в белках. Только l-стереоизомер участвует в биосинтезе белков млекопитающих.Аспарагин важен для удаления токсичного аммиака из организма.
Аминокислота AspОбнаруженная в белках в 1868 году аспарагиновая кислота обычно содержится в белках животных, однако только l-стереоизомер участвует в биосинтезе белков. Растворимость этой аминокислоты в воде обусловлена наличием рядом с активными центрами ферментов, таких как пепсин.
Аминокислота CysЦистеин особенно богат белками волос, копыт и кератином кожи, который был выделен из мочевого камня в 1810 году и из рога в 1899 году.Впоследствии он был химически синтезирован, а структура решена в 1903–1904 годах.
Серосодержащая тиоловая группа в боковой цепи цистеина является ключевой для его свойств, обеспечивая образование дисульфидных мостиков между двумя пептидными цепями (как в случае с инсулином) или образование петли в одной цепи, влияя на окончательную структуру белка. Две молекулы цистеина, связанные между собой дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот.Цистеин вырабатывается в организме из серина и метионина и присутствует только в l-стереоизомере в белках млекопитающих.
Аминокислота Gln
Люди с генетическим заболеванием цистинурия не могут эффективно реабсорбировать цистин в кровоток. Следовательно, в их моче накапливается высокий уровень цистина, где он кристаллизуется и образует камни, которые блокируют почки и мочевой пузырь.Глутамин был впервые выделен из свекольного сока в 1883 году, выделен из белка в 1932 году и впоследствии химически синтезирован в следующем году.Глютамин — самая распространенная в нашем организме аминокислота, которая выполняет несколько важных функций. У людей глутамин синтезируется из глутаминовой кислоты, и этот этап преобразования жизненно важен для регулирования уровня токсичного аммиака в организме, образуя мочевину и пурины.
Аминокислота GluГлутаминовая кислота была выделена из пшеничного глютена в 1866 году и химически синтезирована в 1890. Обычно встречается в животных белках, только l-стереоизомер встречается в белках млекопитающих, которые люди могут синтезировать из обычных промежуточных продуктов. α-кетоглутаровая кислота.Мононатриевая соль l-глутаминовой кислоты, глутамат натрия (MSG) обычно используется в качестве приправы и усилителя вкуса. Карбоксильная боковая цепь глутаминовой кислоты способна действовать как донор и акцептор аммиака, который токсичен для организма, обеспечивая безопасную транспортировку аммиака в печень, где он превращается в мочевину и выводится почками. Свободная глутаминовая кислота также может разлагаться до диоксида углерода и воды или превращаться в сахара.
Аминокислота GlyГлицин был первой аминокислотой, выделенной из белка, в данном случае желатина, и единственной, которая не является оптически активной (без d- или l-стереоизомеров).Структурно простейшая из α-аминокислот, она очень инертна при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
His-аминокислотаГистидин был выделен в 1896 году, и его структура была подтверждена химическим синтезом в 1911 году. Гистидин является прямым предшественником гистамина, а также важным источником углерода в синтезе пуринов.При включении в белки боковая цепь гистидина может действовать как акцептор и донор протонов, передавая важные свойства при объединении с ферментами, такими как химотрипсин, и ферментами, участвующими в метаболизме углеводов, белков и нуклеиновых кислот.
Для младенцев гистидин считается незаменимой аминокислотой, взрослые могут в течение короткого периода времени обходиться без диетического питания, но по-прежнему считается незаменимой.
Иле-аминокислотаИзолейцин был выделен из патоки свекловичного сахара в 1904 году.Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые она включена.
У людей, страдающих редким наследственным заболеванием, называемым болезнью мочи кленового сиропа, есть дефектный фермент в пути разложения, который является общим для изолейцина, лейцина и валина. Без лечения метаболиты накапливаются в моче пациента, вызывая характерный запах, который и дал название состоянию.
Leu АминокислотаЛейцин был выделен из сыра в 1819 году и из мышц и шерсти в его кристаллическом состоянии в 1820 году.В 1891 году он был синтезирован в лаборатории.
Только l-стереоизомер присутствует в белке млекопитающих и может расщепляться на более простые соединения ферментами организма. Некоторые связывающие ДНК белки содержат области, в которых лейцины расположены в конфигурации, называемые лейциновыми застежками-молниями.
Аминокислота LysЛизин был впервые выделен из казеина молочного белка в 1889 году, а его структура была выяснена в 1902 году. Лизин важен для связывания ферментов с коферментами и играет важную роль в функционировании гистонов.
Многие зерновые культуры содержат очень мало лизина, что привело к его дефициту у некоторых групп населения, которые сильно зависят от них в продуктах питания, а также у вегетарианцев и людей, сидящих на низкожирной диете. Следовательно, были предприняты усилия по разработке штаммов кукурузы, богатых лизином.
Met аминокислотаМетионин был выделен из казеина молочного белка в 1922 году, и его структура была решена путем лабораторного синтеза в 1928 году. Метионин является важным источником серы для многих соединений в организме, включая цистеин и таурин.Связанный с содержанием серы, метионин помогает предотвратить накопление жира в печени и помогает выводить токсины и шлаки метаболизма.
Метионин — единственная незаменимая аминокислота, которая не присутствует в значительных количествах соевых бобов и поэтому производится коммерчески и добавляется во многие продукты из соевого шрота.
Phe аминокислотаФенилаланин был впервые выделен из природного источника (ростки люпина) в 1879 году и впоследствии химически синтезирован в 1882 году.Организм человека обычно способен расщеплять фенилаланин до тирозина, однако у людей с наследственным заболеванием фенилкетонурией (ФКУ) фермент, который выполняет это преобразование, неактивен. Если не лечить, фенилаланин накапливается в крови, вызывая задержку умственного развития у детей. Примерно 10 000 детей рождаются с этим заболеванием, поэтому диета с низким содержанием фенилаланина в раннем возрасте может облегчить его последствия.
Pro аминокислотаВ 1900 году пролин был синтезирован химическим путем.На следующий год он был выделен из казеина из молочного белка, и его структура оказалась такой же. Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только как l-стереоизомер в белках млекопитающих. Когда пролин включается в белки, его особая структура приводит к резким изгибам или перегибам в пептидной цепи, что в значительной степени способствует окончательной структуре белка. Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Аминокислота SerСерин был впервые выделен из белка шелка в 1865 году, но его структура не была установлена до 1902 года. Люди могут синтезировать серин из других метаболитов, включая глицин, хотя только l-стереоизомер присутствует в белках млекопитающих. Серин важен для биосинтеза многих метаболитов и часто важен для каталитической функции ферментов, в которые он включен, включая химотрипсин и трипсин.
Нервные газы и некоторые инсектициды действуют путем объединения с остатком серина в активном центре ацетилхолинэстеразы, полностью ингибируя фермент.Активность эстеразы важна для расщепления нейромедиатора ацетилхолина, в противном случае повышается опасно высокий уровень, что быстро приводит к судорогам и смерти.
Аминокислота ThrТреонин был выделен из фибрина в 1935 году и синтезирован в том же году. Только l-стереоизомер появляется в белках млекопитающих, где он относительно инертен. Хотя он играет важную роль во многих реакциях у бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Аминокислота TrpСтруктура триптофана, выделенная из казеина (молочного белка) в 1901 году, была установлена в 1907 году, но только l-стереоизомер присутствует в белках млекопитающих. В кишечнике человека бактерии расщепляют пищевой триптофан, выделяя такие соединения, как скатол и индол, которые придают фекалиям неприятный аромат. Триптофан превращается в витамин B3 (также называемый никотиновой кислотой или ниацином), но не в достаточной степени, чтобы поддерживать наше здоровье. Следовательно, мы также должны принимать витамин B3, несоблюдение этого правила приводит к его дефициту, называемому пеллагрой.
Аминокислота TyrВ 1846 году тирозин был выделен в результате разложения казеина (сырного белка), после чего он был синтезирован в лаборатории и его структура была определена в 1883 году. Присутствует только в l-стереоизомере в белки млекопитающих, люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норадреналина, гормонов щитовидной железы, включая тироксин, а также пигмента волос и кожи меланина.В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Страдающие серьезным генетическим заболеванием фенилкетонурия (ФКУ) неспособны превращать фенилаланин в тирозин, в то время как у пациентов с алкаптонурией метаболизм тирозина нарушен, и моча становится отчетливой и темнеет на воздухе.
Val аминокислотаСтруктура валина была установлена в 1906 году после его первого выделения из альбумина в 1879 году.В белке млекопитающих присутствует только l-стереоизомер. Валин может разлагаться в организме на более простые соединения, но у людей с редким генетическим заболеванием, называемым болезнью мочи кленового сиропа, неисправный фермент прерывает этот процесс и может оказаться фатальным при отсутствии лечения.
Потребности человека в аминокислотах | Журнал питания
Немногие вопросы в науке о питании вызывают такие давние и глубокие споры, как потребности в белках и аминокислотах. Те, кому посчастливилось прочитать описание Грэма Ласка «Нормальной диеты» в его Elements of the Science of Nutrition (Lusk 1928), будут слишком осведомлены о дебатах, которые бушевали в начале 20-го века (и до этого) по поводу вопросы о пользе больших или малых количеств животного или растительного белка в рационе человека.Ласк записывает отчет о разговоре между Ласком и Читтенденом о том, отражает ли восторг и удовлетворение Ласка большим кусочком холодного ростбифа, потребленного на борту корабля после сурового пребывания в Британии военного времени, пополнение «квоты на улучшение» его запасов протеина. (Взгляд Ласка) или вызывающий аппетит стимул морского воздуха (взгляд Читтендена). Ласк писал, что оба мнения — подходящие темы для психоанализа. Студенты, изучающие историю науки, глядя на текущие дебаты о потребностях в аминокислотах, могут сегодня получить такой же ответ.
В центре дискуссии находятся три вопроса: 1 ) достоверность значений потребности в аминокислотах, впервые собранных для отчета ФАО / ВОЗ о потребностях в белках 1973 года и впоследствии использованных в отчете ФАО / ВОЗ / УООН 1985 года, 2 ) валидность модели оценки MIT, предложенной в качестве замены модели оценки взрослых FAO (Young et al. 1989), и 3 ) степени, в которой оценка белков по аминокислотам является возможным или даже действительным способом оценки белка качество питания человека (Millward 1994).Здесь уместно рассмотреть эти вопросы, учитывая последнюю статью, опубликованную в журнале The Journal of Nutrition в поддержку модели оценки аминокислот MIT (McLarney et al. 1996). В этом отчете Янг и его коллеги представляют межвидовое сравнение рекомендаций ФАО / ВОЗ / УООН 1985 года по потребностям человека в аминокислотах с рекомендациями для других видов млекопитающих и птиц (McLarney et al. 1996). Они показывают, что при сравнении значений на разных стадиях развития человеческие ценности выше для младенцев и ниже для взрослых по сравнению со средними значениями для нечеловеческих видов.На основании этого сравнения они пришли к выводу, что трудно избежать вывода о том, что текущие значения потребности человека в аминокислотах кажутся аномальными, если сравнивать их с данными других видов животных, особенно в случае значений для взрослых особей. В конце своей статьи они рекомендуют модель MIT в качестве альтернативы ценностям взрослых ФАО 1985 года, утверждая, что модель MIT «приводит человеческие данные в более точное соответствие с моделями потребности в аминокислотах и темпами их изменения с развитием, поскольку у других видов.”
Как и в предыдущие эпохи, это важный вопрос, решение которого имеет последствия для международной политики в области пищевых продуктов и питания. Янг и Пеллетт (1990) использовали шкалу оценки MIT для выявления дефицита лизина в рационе на основе злаков, который, по их словам, требует добавления животных белков для его устранения. Для многих читателей аргументы Янга будут убедительными, поскольку они исходят от человека, который, вероятно, внес наибольшее количество высококачественных опубликованных работ в истории о потребностях человека в белках и аминокислотах.Но таковы были аргументы Либиха о роли белка в качестве топлива для мышц, и Либих ошибался. Итак, на мой взгляд, Янг и коллеги.
Читая научную литературу, я соглашусь с Ридсом (1988) в том, что за очевидными исключениями (например, потребность в аргинине для растущих кошек и растущих и взрослых собак, потребность котят в таурине и потребность в высоких аминокислотах в организме видов птиц для роста пера), между видами млекопитающих существует несколько существенных различий в основах аминокислотного и белкового метаболизма.Исходя из этого, межвидовое сравнение видов млекопитающих представляет научный интерес. Однако такое упражнение имеет ценность только в том случае, если сравнение сравнивает подобное с подобным и использует достоверные данные.
Что касается сравнения подобного с подобным, учитывая основные концепции потребностей в аминокислотах для роста и поддержания, которые были поняты с самых ранних экспериментов Осборна и Менделя (1916), межвидовые сравнения имеют ценность только тогда, когда сравнения принимают во внимание заметно различаются темпами роста у разных видов.Хорошо известно, что новорожденные свиньи растут более чем в 10 раз быстрее, чем новорожденные младенцы до отъема (т. Е. 286 г / день, чтобы набрать 4 кг за 14 дней, по сравнению с 22 г / день, чтобы набрать 4 кг за 180 дней) и в 60 раз. быстрее после отлучения (т.е. 571 г / день для достижения 90 кг за 148 дней по сравнению с 10 г / день для достижения 70 кг за 17,5 лет). Это означает, что, как отмечают Саид и Хегстед (1970) в их оценке потребностей крыс в аминокислотах, у младенцев после первого года жизни потребности в незаменимых аминокислотах для роста становятся незначительными по сравнению с потребностями в поддержании.Из-за этого мне ни в коем случае не ясно, какую ценность можно получить, сравнивая человеческие ценности для детей дошкольного и старшего возраста (ранний рост и рост) с другими видами, которые растут быстрее, чем человеческие младенцы. Для быстрорастущих видов, таких как свиньи или крысы, потребности в аминокислотах почти полностью связаны с ростом тканей, тогда как для людей после первого года потребности в аминокислотах почти полностью связаны с поддержанием. Хотя в другом месте (Young and El-Khoury 1995) Янг утверждает, что модели роста не обязательно должны иметь какое-либо отношение к содержанию аминокислот в тканях, это факт (принимая по существу некоторые аминокислоты), что модель потребности роста должна обеспечивать, по крайней мере, содержание роста тканей.Единственный способ, которым он может отличаться, — это дополнительная диета из-за неэффективности использования или любой не связанной с ростом метаболической потребности. У быстро растущих крыс картина потребности в незаменимых аминокислотах, описанная Benevenga et al. (1994) (вопреки утверждениям Янга и Эль-Хури, 1995), за одним исключением, очень похож на белок смешанного тела крысы, о котором сообщают Davis et al. (1994). Таким образом, после уравнивания каждого паттерна для треонина относительные соотношения всех других аминокислот варьировались от 0.От 8 до 1,3, за исключением серных аминокислот, для которых значения потребности крыс выше ожидаемых (соотношение 2,3), предположительно отражая рост волос. В случае выращивания свиней, структура потребности Фуллера в аккреции (Fuller et al. 1989) даже ближе к составу смешанных белков тела с относительными соотношениями в пределах от 0,8 до 1,1. Это означает, что 1 ) может быть мало споров о потребности в аминокислотах для роста, за исключением эффективности использования, которая будет определять любую дополнительную потребность; и 2 ), поскольку люди растут со скоростью, приближающейся к темпам роста животных, только во время догоняющего роста или у недоношенных детей, потребности большинства других видов в значительной степени не имеют отношения к потребностям человека после первых 6–12 мес жизни. .Что необходимо, так это особый акцент, насколько это возможно, на требованиях к техническому обслуживанию. Опять же, если подобное нужно сравнивать с подобным, тогда необходимо учитывать выбранный допуск белка, потому что паттерны оценки, исследованные McLarney et al. (1996) (миллиграммы аминокислоты на грамм допустимого количества белка) зависят от выбора значения белка в знаменателе. Схема взрослого населения ФАО / ВОЗ / УООН 1985 года, процитированная Янгом, основана на безопасной норме 1985 года (0,75 г белка), значение, которое в любом случае было получено произвольно (см. Millward et al.1989). Все значения в схеме оценки ФАО / ВОЗ 1973 г. были на 36% выше, поскольку те же значения потребности в аминокислотах были связаны с более низкой потребностью в безопасном белке (0,55 г / кг). Схема MIT основана на 0,6 г белка, средней потребности 1985 года.
Что касается надежности данных, вначале McLarney et al. (1996) заявляют, что они будут использовать наборы значений, представленные в основном Национальным исследовательским советом как «наиболее широко принятые цифры и, следовательно, полезные для данной цели», даже после указания на другие более свежие значения (например,g., значения для крыс; Benevenga et al. 1994) может дать более точные оценки. Фактически, для наиболее важных данных в данном контексте, то есть для зрелых значений, приведенные данные (индейка, собака, крыса и свинья), как правило, плохие, за исключением данных для крыс. Таким образом, как указывают авторы, данные по индейке являются прогнозируемыми. Признано, что данные NRC для взрослых собак основаны на очень ограниченных данных (Schaeffer et al. 1989) и фактически получены из одного доктора философии. диссертации, и, как сообщают авторы в другом месте (Young and El Khoury 1995), набор данных по кабану обычно считается основанным на очень слабых данных.
Что касается надежности человеческих данных, есть несколько критических замечаний, которые могут быть сделаны в отношении этих данных как описания человеческих потребностей. Схема подсчета баллов для младенцев основана на составе грудного молока, который был рекомендован ФАО после указания на то, что грудное молоко содержит более высокие уровни триптофана и S-аминокислот, чем экспериментальные оценки значений потребностей младенцев в аминокислотах. Дошкольные ценности очень трудно оценить, потому что они никогда не публиковались полностью.Кроме того, изучение имеющихся данных (например, для лизина) поднимает вопрос о том, получены ли результаты из измерений у детей, демонстрирующих аномальный рост для их возраста из-за предшествующего недоедания (см. Millward 1994). Данные о детях старшего возраста были отвергнуты ФАО / ВОЗ как недостоверные в их отчете за 1991 год (FAO / WHO 1991).
Напротив, данные о взрослых, которые в настоящее время находятся в центре внимания в текущих дебатах, представляют собой результаты большого объема конкретной работы нескольких исследователей по взрослым мужчинам и женщинам, направленной на установление минимальных требований с конкретными протоколами, предназначенными для этого ( как обсуждалось Миллуордом и Риверсом 1988 г.).Кроме того, окончательные значения, выбранные ФАО / ВОЗ / УООН (1985), взятые из более раннего отчета (ФАО / ВОЗ 1973), в котором сравнивались значения для мужчин, представленные Роуз (1957), и набор значений, опубликованных Хегстедом (1963) после При внимательном рассмотрении всех опубликованных до 1963 года данных были в основном самые высокие значения, «чтобы подчеркнуть верхний диапазон индивидуальных требований». В основном это были значения, указанные Роуз. Янг отверг всю работу (сосредоточив в своем анализе исключительно на исследованиях Роуза) на том основании, что 1 ) использовалась чрезмерная энергия, 2 ) не учитывались разные потери и 3 ) азотный баланс не может быть подтвержден.Фактически, первый пункт верен только для исследований Роуза, которые были признаны Хегстедом (1963) как худшие в количественном отношении по сравнению с более поздними исследованиями, но которые в любом случае обычно приводили к более высоким значениям , чем большинство других отчетов, в которых использовалась энергия поддержания веса. поступления. Пункт 2 будет иметь значение, как указывает Хегстед (1963). Фактически, Фуллер и Гарлик (1994) пересчитали значения из значений регрессии Хегстеда, предполагая необходимость 0,3 г N для неизмеренных потерь, и это привело к удвоению большинства значений.С другой стороны, в случае лизина в нескольких исследованиях положительное удерживание было принято в качестве критерия адекватности и в целом подтверждены значения ФАО (например, Clark et al. 1963). Что касается пункта 3 выше, несмотря на хорошо известные трудности, связанные со всеми исследованиями баланса, их полный отказ (в пользу исследований баланса углерода 13 C) является советом отчаяния и логически означает отказ от всех значений потребности в белке. Таким образом, данные о людях на начальном этапе вряд ли точно отражают истинное изменение метаболических потребностей в аминокислотах в процессе развития, поскольку они не изучались систематически.
Из вышесказанного следует, что на самом деле существует большая трудность в проведении разумного межвидового сравнения, учитывая как трудности определения сопоставимых физиологических состояний у разных видов, которые соответствуют развитию человека, так и отсутствие однозначных данных. Большая часть работы была проведена на крысах, свиньях и взрослых людях, с конкретными исследованиями на взрослых крысах и лишь ограниченными исследованиями на взрослых свиньях. Хегстед (1973) сравнил свои собственные данные о крысах с человеческими ценностями ФАО, и они показаны в таблице 1.
Таблица 1. Потребность в аминокислотах для взрослых крыс и человека1
. Взрослая крыса . Человек . мг / г диетического протеина Гистидин 14 22 4444Лейцин 35 25 Лизин 21 22 Ароматические аминокислоты 34 25 Треонин 30 13 Триптофан 7 6 Валин 31 18 . Взрослая крыса . Человек . мг / г диетического белка Гистидин 14 22 4444904Лейцин 35 25 Лизин 21 22 Ароматические аминокислоты 34 25 Треонин 30 13 Триптофан 7 6 Валин 31 18 Потребность взрослых крыс и человека в аминокислотах 1
. Взрослая крыса . Человек . мг / г диетического протеина Гистидин 14 22 4444Лейцин 35 25 Лизин 21 22 Ароматические аминокислоты 34 25 Треонин 30 13 Триптофан 7 6 Валин 31 18
Таблица 2. Взрослая крыса . Человек . мг / г диетического белка Гистидин 14 22 4444904Лейцин 35 25 Лизин 21 22 Ароматические аминокислоты 34 25 Треонин 30 13 Триптофан 7 6 Валин 31 18 Можно сделать два комментария об этом комм. паризон.Во-первых, оба набора ценностей отличаются от тех, которые цитирует Янг и его коллеги. Значения для крыс отличаются от значений NRC (1978) как по структуре аминокислот, так и по общему количеству незаменимых аминокислот, однако трудно понять, с какими данными NRC мог работать, кроме данных Хегстеда. Во-вторых, в отличие от выводов, сделанных Янгом и его коллегами, на основе этого сравнения заключение, к которому пришел Хегстед (1973), кажется более подходящим: «Совершенно очевидно, что есть очень очевидные сходства между схемами потребности в аминокислотах у человека. крысы и человек.Относительные потребности различных аминокислот также схожи ».
Кроме того, поддерживаемые значения были получены для растущих крыс и свиней, и их можно сравнивать, зная, что эти значения представляют собой уровни потребления аминокислот при физиологически необычных обстоятельствах. Учитывая, что на практике текущая дискуссия сосредоточена в основном на потребностях в лизине, я сравнил поддерживающие потребности в лизине для крыс, свиней и людей в таблице 2 как мг / кг 0,75 . Ясно, что базис для экспоненты 0.75 для межвидовых сравнений потребностей в лизине не было строго установлено, но если предположить, что такое сравнение достоверно, человеческие ценности совершенно ничем не примечательны и действительно выше, чем «нефизиологические значения», полученные на растущих крысах или свиньях. В таблице 2 также показаны потребности в лизине как доли от общих потребностей в незаменимых аминокислотах.
Таблица 2.Межвидовое сравнение потребности в лизине
909 904 .Виды . Требования к техническому обслуживанию . Содержание тела . . . . . мг / кг 0,75 % Всего IAA 2-6 % Всего IAA Крыса 904 9049 8,6 Крыса 2-2 32,9 10,5 Свинья 2–3 36,0 14,7 904 904 904 904 904 — Человек 2-5 34,7 14,4 Все виды 19,1 2-7 Требования к техническому обслуживанию . Содержание тела . . . . . мг / кг 0,75 % Всего IAA 2-6 % Всего IAA Крыса 904 9049 8,6 Крыса 2-2 32,9 10,5 Свинья 2–3 36,0 14,7 4,0 — Человек 2-5 34,7 14,4 Все виды 19,1 2-7 Межвидовое сравнение потребности в лизине
909 904 .Виды . Требования к техническому обслуживанию . Содержание тела . . . . . мг / кг 0,75 % Всего IAA 2-6 % Всего IAA Крыса 904 9049 8,6 Крыса 2-2 32,9 10,5 Свинья 2–3 36,0 14,7 904 904 904 904 904 — Человек 2-5 34,7 14,4 Все виды 19,1 2-7 Требования к техническому обслуживанию . Содержание тела . . . . . мг / кг 0,75 % Всего IAA 2-6 % Всего IAA Крыса 904 9049 8,6 Крыса 2-2 32,9 10,5 Свинья 2–3 36,0 14,7 904 904 904 904 904 904 — Человек 2-5 34,7 14,4 Все виды 19,1 2-7 Однако наиболее поучительным является межвидовое сравнение метаболического поведения с точки зрения адаптивных изменений в окислении аминокислот и последующего сохранения аминокислот в ответ на низкое потребление, поскольку это будет определять питательную ценность различных источников пищи. Это потому, что теперь совершенно ясно, что для многих незаменимых аминокислот и, в частности, для лизина их потребность заключается в первую очередь в удовлетворении окислительных потерь.Действительно, на основе метаболической модели (Millward and Pacy 1995, Millward and Rivers 1988), в которой метаболическая потребность в незаменимых аминокислотах является функцией 1 ) потребностей для роста, 2 ) потребностей для обязательных метаболических потребностей и 3 ) потребности в регулятивных окислительных потерях со скоростью, которая отражает обычное потребление белка, определение простой неквалифицированной потребности в поддержании, независимо от исходного состояния питания, невозможно. В рамках этой модели все, что может быть определено, — это минимальное потребление, к которому могут приспособиться адаптивные снижения скорости окисления без ущерба для функций или состава организма.Это верно даже с учетом потребности в постпрандиальном отложении белка в рамках дневного цикла постабсорбционных потерь и постпрандиальных прибылей. Поскольку амплитуда этого суточного цикла изменчива и потому, что, как обсуждалось в другом месте (Millward 1992, Millward and Pacy 1995), может происходить рециклинг аминокислот (т. Е. Аминокислоты, такие как треонин и лизин, высвобождаемые в результате постабсорбтивного сетевого протеолиза, могут быть рециркулированы для увеличения количества белка после приема пищи. ), это позволяет использовать белок пшеницы для отложения белка после еды с эффективностью, близкой к эффективности молока (Fereday et al.1994 и 1997). При адаптивном снижении скорости окисления лизина и других ограничивающих аминокислот баланс может поддерживаться при низком потреблении, как Young et al. (1975) показали (см. Millward 1994).
В этом контексте межвидовые данные по крысам и свиньям полностью согласуются с очень низкими обязательными потребностями в лизине по сравнению с другими аминокислотами, такими как треонин и серные аминокислоты. Исследования на молодых крысах (Benevenga et al. 1994), взрослых крысах (Said and Hegsted 1970, Yokogoshi and Yoshida 1981, Yoshida and Moritoki 1974) и растущих свиньях (Fuller et al.1989) очень четко показали, что при поддержании потребности в лизине самая низкая из всех незаменимых аминокислот, поскольку удаление лизина из рациона оказывает гораздо меньшее влияние на баланс азота по сравнению с удалением серосодержащих аминокислот и треонина. у свиней и по сравнению с удалением треонина, серных аминокислот и изолейцина у крыс. В самом деле, как указал Хегстед (1973), из-за этого кривая баланса-поступления для лизина чрезвычайно пологая, а это означает, что измерение величины потребности очень сложно, поскольку она зависит от точного критерия адекватности.Хотя несколько ранних сообщений о крысах, сохраняющих массу тела в течение 6-месячных периодов при употреблении диет с очень низким содержанием лизина [например, зеина, Осборна и Менделя (1916) или даже диеты без лизина (Bender 1961)], вероятно, объясняются копрофагией, учитывая явных доказательств метаболической потребности в лизине с точки зрения быстрого появления симптомов у людей, потребляющих диету без лизина (Rose 1957), нет никаких доказательств чего-либо, кроме очень низкой метаболической потребности в этой аминокислоте. Йошида больше всего сделал для исследования концепции, согласно которой аминокислоты, ограничивающие скорость при поддержании, отличаются от аминокислот, ограничивающих скорость роста.Он показал, что у взрослых крыс, которых кормили ограниченным количеством рациона из риса или пшеницы, ограничивающими аминокислотами были треонин и аминокислоты серы, которые при добавлении в рацион из злаков восстанавливали азотный баланс и преобразовывали потерю веса тела в рост (Yoshida, 1983). ). Это может объяснить, почему попытки показать в испытаниях добавок, что лизин является лимитирующей аминокислотой в пшенице у взрослых людей, были настолько разочаровывающими (Scrimshaw et al. 1973).
Хотя природа относительной метаболической потребности в отдельных аминокислотах никоим образом не ясна, работа Фуллера на свиньях указала на потерю аминокислот в подвздошной кишке в качестве частичного объяснения, на которое приходится около 60% потребностей свиней в поддержании аминокислотного содержания (Wang и Фуллер 1989).В таблице 3 сравниваются потери в подвздошной кишке свиней и людей.
Таблица 3. Потери незаменимых аминокислотIleal у свиней и людей по сравнению со значениями требований ФАО для взрослых особей
. Свинья 40 кг 3-1 . Взрослый человек, 66 кг 3-2 . Требование ФАО 3-3 . г / д 0,114 0,660 Лейцин 1,0 0,21 0,924 Лизин 0,61 0,258 0,61 0,258 0,61 0,258 0,61 0,258 4,792 0,858 Ароматические аминокислоты 1,14 0,255 0,924 Треонин 1,41 0.280 0,462 Валин 0,73 0,19 0,660
Таблица 3. Незаменимые потери аминокислот. Свинья 40 кг 3-1 . Взрослый человек, 66 кг 3-2 . Требование ФАО 3-3 . г / д 0,114 0,660 Лейцин 1,0 0,21 0,924 Лизин 0,61 0,258 0,61 0,258 0,61 0,258 0,61 0,258 4,792 0,858 Ароматические аминокислоты 1,14 0,255 0,924 Треонин 1,41 0.280 0,462 Валин 0,73 0,19 0,660 свиней и людей по сравнению со значениями требований ФАО для взрослых
904 . Свинья 40 кг 3-1 . Взрослый человек, 66 кг 3-2 . Требование ФАО 3-3 . г / д 1,0 0,21 0,924 Лизин 0,61 0,258 0,792 Аминокислоты серы 0.73 0,116 0,858 Ароматические аминокислоты 1,14 0,255 0,924 Треонин 1,41 0,280 5904 9133 0,660 . Свинья 40 кг 3-1 . Взрослый человек, 66 кг 3-2 . Требование ФАО 3-3 . г / день 1,0 0,21 0,924 Лизин 0.61 0,258 0,792 Аминокислоты серы 0,73 0,116 0,858 Ароматические аминокислоты 1,14 0,255 0,255 0,94 0,462 Валин 0,73 0,19 0,660 Эти данные показывают, что в каждом случае треонин является самым большим компонентом, и, хотя структуры в определенной степени различаются, что наиболее важно, абсолютные значения у человека намного ниже, чем у свиней.Исходя из этого, значения потребностей человека, показанные в таблице 3, ничем не примечательны, как и многие исследования баланса азота у мужчин и женщин, в которых сообщается, что потребности в лизине варьируются от 17 до всего лишь 1 мг / кг в день (см. Irwin and Hegsted 1971).
В совокупности это неизбежно ограниченное межвидовое сравнение приводит меня к выводу, что 1 ) минимальные метаболические потребности в лизине низкие; 2 ) адаптивное снижение окисления лизина и его рециркуляция в ответ на снижение потребления является обширным; и 3 ) значения потребности в аминокислотах ФАО и особенно потребности в лизине, полученные в результате испытаний баланса азота у человека, совершенно ничем не примечательны.Кроме того, на основе хорошо проведенных исследований, показывающих, что потребности в лизине для роста намного выше, чем потребности для поддержания [например, отношения лизин-триптофан в моделях роста и поддержания 8,2 и 3,4 у крыс (Said and Hegsted 1970) и 5,7 и 1,8 у свиней (Fuller et al. 1989)], неизбежен вывод о том, что минимальные требования к содержанию лизина для людей, как у крыс, так и у свиней, намного ниже, чем относительные требования к приросту тканей. Таким образом, в периоды очень быстрого нормального и догоняющего роста у недоношенных и доношенных детей структура потребности в аминокислотах должна включать гораздо более высокое содержание лизина, чем у детей старшего возраста и взрослых.Тот факт, что это противоречит гораздо более низкому изменению потребности в лизине от очень молодых к взрослым средним значениям NRC для нечеловеческих видов (58–33 мг / г), собранным Янгом и его коллегами (McLarney et al. 1996), приводит меня к мысли. ставить под сомнение ценности NRC, а не человеческие ценности.
Как утверждается в другом месте (Millward 1990, 1992 и 1994, Millward et al. 1990), модель оценки MIT основана на предположении, что потребности в аминокислотах для поддержания могут быть предсказаны на основе аминокислотного состава белков организма, а это допущение невозможно. сделано ранее, насколько мне известно, и которое является необоснованным, и которое не нашло поддержки, кроме признания того, что значения для требований к лейцину могут быть выше, чем в схеме ФАО / ВОЗ / УООН (например,g., Fuller and Garlick 1994, Waterlow 1996). Вопреки тому, что было опубликовано, это не тот случай, чтобы на международном заседании экспертной группы «подавляющее большинство группы приняло временную схему работы, предложенную Янгом и др.» (Clugston et al. 1996), потому что, как впоследствии сообщалось (Millward and Waterlow 1996), это утверждение появилось во время редактирования после встречи.
Янг еще не опубликовал надежных исследований стабильных изотопов лизина, и, на мой взгляд, никаких других однозначных значений опубликовано не было.Исследования метода окисления индикаторов, проведенные Zello et al. (1992), которые поддерживают гораздо более высокие значения потребности в лизине, что согласуется с позицией Янга, не предпринимают попыток учесть какую-либо адаптацию в окислении лизина в ответ на сниженное потребление. Более того, хотя они представлены как более простые, чем многие другие исследования, на самом деле они сложны и, на мой взгляд, никоим образом не однозначны. Таким образом, увеличение экскреции 13 CO 2 из индикаторной аминокислоты (инфузированный фенилаланин), которое определяет снижение потребления тестируемой аминокислоты (лизина) с пищей ниже требуемой, точно предсказывает только истинное увеличение окисления фенилаланина. если нет изменений в истинном обогащении предшественников, которым, согласно моему пониманию биохимии, является тирозин, а не фенилаланин, как предполагают авторы.
Как заключено в другом месте (Millward 1994), учитывая 1 ) низкие минимальные обязательные потребности в незаменимых аминокислотах, 2 ) тот факт, что их метаболическая потребность отражает степень, в которой происходят адаптивные изменения в окислении и 3 ) растущее количество доказательств доступности незаменимых аминокислот, включая лизин, полученных в результате синтеза аминокислот de novo микробами толстой кишки из спасенной мочевины (см. Fuller and Garlick 1994, Yeboah et al. 1996, Gibson et al.1997), на мой взгляд, определение необходимых для взрослого человека потребностей в аминокислотах для оценки качества белка в настоящее время невозможно или, вероятно, будет полезно в будущем. Однако, учитывая, что шкала белков, основанная на простой и привлекательной концепции, представляет собой глубоко укоренившийся фундамент оценки качества питания, я понимаю, что немногие легко примут мои сегодняшние выводы так же, как аналогичные взгляды других, высказанные по поводу четверть века назад (например, Саид и Хегстед 1970, Йошида и Моритоки 1974) постоянно игнорировались, как и многие опубликованные исследования, показывающие четкие доказательства способности адаптироваться к рациону на основе злаков с низким потреблением лизина.В исследовании Edwards et al. (1971), демонстрируя, как поддержание массы тела и баланса азота у североамериканских студентов, которым давали только 46 г белка (∼0,6 г / кг) пшеницы (76%) и картофеля (20% белка) в течение 60 дней, что обеспечивало бы примерно 17 мг / кг лизина — одно из таких сообщений. На мой взгляд, насущный научный вопрос заключается не в том, какова идентичность модели оценки для определения степени, в которой рационы на основе растений являются питательно адекватными для питания человека, потому что оценка не даст ответа на этот вопрос.Скорее, мы должны сосредоточиться на долгосрочных испытаниях кормления с исследуемыми источниками диетического белка, чтобы лучше понять сложность адаптивных реакций человеческого аминокислотного и белкового метаболизма на изменения в потреблении, а также степень любых неблагоприятных функциональных последствий. такой адаптации.
ЦИТИРОВАННАЯ ЛИТЕРАТУРА
1Baker
D. H.
Becker
D. F.
Norton
H.W.
Jensen
A. H.
Hartnen
B. G.
Количественная оценка потребности взрослых свиней в триптофане, метионине и лизине для поддержания.
J. Nutr.
89
1966
441
447
2Bender
,A. E.
(1961
)Определение пищевой ценности белков химическим анализом
. В:Прогресс в удовлетворении потребностей младенцев и детей дошкольного возраста в белке,
стр.407
—415
.NRC опубл. 843, Национальная академия наук
,Вашингтон, округ Колумбия
,3Беневенга
Н. Дж.
Гал
М. Дж.
Креншоу
Т. Д.
Финк
М. Д.
Требования к белку и аминокислотам для поддержания жизнедеятельности и потребности в аминокислотах для роста лабораторных крыс.
J. Nutr.
124
1994
451
453
4Кларк
H.E.
Да
N. J.
Vermillion
E. J.
Goodwin
A. F.
Mertz
E. T.
Влияние определенных факторов на удерживание азота и лизина требования взрослых людей. III. Источник дополнительного азота.
J. Nutr.
79
1963
131
139
5Clugston
,G.
,Dewey
,K.G.
,Fjeld
,C.
,Millward
,D. J.
,Reeds
,P.
,Scrimshaw
,N. S.
,Tontisirin
,K
,Waterlow
,J. C.
иYoung
,V. R.
(1996
)Отчет рабочей группы о потребностях в белках и аминокислотах
.евро. J. Clin. Nutr.
50
🙁доп.1
)S193
—S195
.6Davis
T. A.
Nguyen
H. V.
Garcia-Bravo
R.
Fiorotto
M. L.
Jackson
E. M.
Lewis
D. S.
Lee
D. R.
Reeds
P. J.
Аминокислотный состав грудного молока не уникален.
J. Nutr.
124
1994
1126
1132
7Эдвардс
С.H.
Booker
L. K.
Rumph
C. H.
Wright
W. G.
Ganapathy
S. N.
Использование пшеницы взрослым человеком: метаболизм азота , аминокислоты и липиды плазмы.
Am. J. Clin. Nutr.
24
1971
181
193
8ФАО / ВОЗ
(1973
)Потребности в энергии и белках. Отчет Совместного специального комитета экспертов ФАО / ВОЗ
.Серия технических отчетов No. 522,
Всемирная организация здравоохранения
,Женева, Швейцария
,9ФАО / ВОЗ
(1991
)Оценка качества белка в рационе человека
.Документ о пищевых продуктах и питании 51,
ФАО
,Рим, Италия
.10ФАО / ВОЗ / УООН
(1985
)Потребности в энергии и белке
.Отчет совместной экспертной консультации. Серия технических отчетов №724,
Всемирная организация здравоохранения
,Женева, Швейцария
,11Фередей
,A.
,Gibson
,N.
,Cox
,M.
,Halliday
,D .
,Pacy
P.J.
иMillward
,D. J.
(1994
)Постпрандиальное использование протеина пшеницы у здоровых взрослых людей
.Proc. Nutr. Soc.
53
:201a
(абс.) .12Fereday
,A.
,Gibson
,N.
,Cox
,M.
,Halliday
,D.
,Pacy
,P. J.
&Millward
,D. J.
(1997
)Постпрандиальное использование белка пшеницы из одного приема пищи у здоровых взрослых людей
.Proc. Nutr. Soc.
(в печати) .13Fuller
M.
Garlick
P.J.
Потребности человека в аминокислотах. Можно ли разрешить спор?
Анну. Rev. Nutr.
14
1994
217
241
14Фуллер
M. F.
Milne
A.
Harris
C. I.
Reid
T.
Keenan
R.
Потери аминокислот в илеостомической жидкости при безбелковой диете.
Am. J. Clin.Nutr.
59
1994
70
73
15Фуллер
M. F.
McWilliam
R.
Wang
T. C.
Giles
L.Оптимальный аминокислотный рацион для растущих свиней; требования к поддержанию и увеличению тканевого белка.
руб. J. Nutr.
62
1989
255
267
16Gibson
,N.R.
,Ah-Sing
,E.
,Badalloo
,A.
,Forrester
,T.
,Jackson
,A.
иMillward
,D. J
(1997
)Перенос 15 N из мочевины в циркулирующий запас незаменимых и незаменимых аминокислот у младенца человека
.Proc. Nutr. Soc.
(в печати) .17Hegsted
D. M.
Различия в потребностях в питательных веществах — аминокислотах.
Фед. Proc.
22
1963
1424
1430
18Hegstead
,D. M.
(1973
)Потребности в аминокислотах крыс и людей
. В:Proteins in Human Nutrition
(Porter
,J.W.G.
иRolls
,B.A.
ред.).Academic Press
,London, UK
19Irwin
M. I.
иHegsted
D.М.
Обзор исследований потребностей человека в аминокислотах.
J. Nutr.
101
1971
539
566
20Ласк
,г.
(1928
)Элементы науки о питании,
4-е изд., Стр.447
486.W. B. Saunders
,Philadelphia, PA
.21McLarney
M. J.
Pellet
P.L.
Young
V. R.
Структура аминокислот в организме человека: межвидовое сравнение с использованием опубликованных рекомендаций по потребностям в аминокислотах.
J. Nutr.
126
1996
1871
1882
22Millward
D. J.
Потребность в аминокислотах у взрослого человека.
Am. J. Clin. Nutr.
51
1990
492
493
23Millward
,D.J.
(1992
)Метаболическая основа потребности в аминокислотах
. В:Protein-Energy Interactions
(Scrimshaw
,N. S.
иSchurch
,B.
ред.), Стр.31
—57
.I / D / E / C / G Nestle Foundation, Лозанна
,Швейцария
.24Millward
D. J.
Можем ли мы определить потребности в незаменимых аминокислотах и оценить качество белка у взрослых?
Дж.Nutr.
124
1994
1509
1516
25Millward
D. J.
Jackson
A. A.
Price
G.
Rivers
J.P.
Потребности человека в аминокислотах и белках: современные дилеммы и неопределенности.
Нутр. Res. Ред.
2
1989
109
132
26Millward
D. J.
Pacy
P.J.
Использование белка после приема пищи и оценка качества белка у человека.
Clin. Sci.
88
1995
597
606
27Millward
D. J.
Price
G. M.
Pacy
P.J.H.
Холлидей
D.
Требования к поддерживающему белку: необходимость концептуальной переоценки.
Proc. Nutr. Soc.
49
1990
473
487
28Millward
D.J.
Риверс
J.P.W.
Пищевая роль незаменимых аминокислот и метаболическая основа для удовлетворения их потребностей.
евро. J. Clin. Nutr.
42
1988
367
393
29Millward
D. J.
Waterlow
J. C.
Письмо в редакцию.
евро. J. Clin. Nutr.
50
1996
832
833
30Национальный исследовательский совет
(1978
)Потребности лабораторных животных в питательных веществах.
National Academy Press
,Вашингтон, округ Колумбия
.31Osborne
T. B.
Mendel
L. B.
Минимум аминокислот для поддержания и роста, как показано дальнейшими экспериментами с лизином и триптофаном.
J. Biol. Chem.
25
1916
1
8
32Ридс
,P.J.
(1988
)Азотный обмен и потребности в белке
.В:Comparative Nutrition
(Blaxter
,K.
иMcDonald
,J.
ред.), Стр.1
—19
.Джон Либби
,Лондон, Великобритания
33Роуз
W. C.
Потребности взрослого человека в аминокислотах.
Нутр. Abstr. Ред.
27
1957
631
647
34Саид
A. K.
Hegsted
D.M.
Ответ взрослых крыс на низкие уровни незаменимых аминокислот в рационе.
J. Nutr.
100
1970
1363
1376
35Schaeffer
,M. C.
,Rogers
,Q. R.
иMorris
,J. G.
(1989
)Белок в питании собак и кошек
. В:Питание собак и кошек
(Burger
,I.Реки H.
и,J.P.W.
ред.), Стр.159
—206
.Cambridge University Press
,Cambridge, UK
,36Scrimshaw
N. S.
Taylor
Y.
Young
V. R.
Адекватное и ограниченное добавление лизина к пшеничной клейковине потребление энергии у юношей.
Am. J. Clin. Nutr.
26
1973
965
972
37Scrimshaw
N.S.
Young
V. R.
Добавление лизина к пшеничной клейковине при адекватном и ограниченном потреблении энергии у молодых мужчин.
Am. J. Clin. Nutr.
26
1973
965
972
38Ван
T. C.
Fuller
M. F.
Оптимальный аминокислотный рацион для растущих свиней; 1. Эксперименты по делеции аминокислот.
руб. J. Nutr.
62
1989
77
89
39Waterlow
,J.C.
(1996
)Потребности взрослого человека в незаменимых аминокислотах
.евро. J. Clin. Nutr.
50
(доп.1
):S151
—S180
,40Yeboah
,N.
,Ah-Sing
,E.
,Badalloo
, ,Forrester
,T.
,Jackson
,A.
иMillward
,D. J.
(1996
)Перенос 15 N из мочевины в циркулирующий пул лизина в человеческий младенец
.Proc. Nutr. Soc.
55
:37A
(абс.) .41Yokogoshi
H.
Yoshida
A.
Последовательность ограничивающих аминокислот для использования эндогенных аминокислот у крыс, получавших безбелковые диета.
Нутр. Rep. Int.
23
1981
517
523
42Йошида
,A.
(1983
)Специфичность аминокислот для пищевой оценки белков
.Proc. Int. Доц. Cereal Chem. Симпозиум по аминокислотному составу и биологической ценности белков злаков
(Lasztity
,R.
иHidvegi
,M.
ред.), Стр.163
—182
.Akademiai Kiado, Budapest
,Hungary
.43Yoshida
A.
Moritoki
K.
Азотсберегающее действие метионина и треонина у крыс, получавших безбелковую диету.
Нутр. Rep. Int.
9
1974
159
168
44Янг
V. R.
Bier
D. M.
Pellet
P. L.
Теоретическая основа для увеличения тока оценки потребности в аминокислотах у взрослого человека с экспериментальной поддержкой.
Am. J. Clin. Nutr.
50
1989
80
92
45Янг
V.R.
Fajardo
L.
Murray
E.
Rand
W. M.
Scrimshaw
N. S.
Потребность человека в белке: сравнительный ответ азотного баланса в рамках вспомогательного обслуживания. поддерживающий диапазон потребления белков пшеницы и говядины.
J. Nutr.
105
1975
534
544
46Янг
V. R.
Эль-Хури
A.E.
Можно ли определить потребность в аминокислотах для поддержания питания взрослых людей на основе аминокислотного состава смешанных белков организма?
Proc. Natl. Акад. Sci. США
92
1995
300
304
47Янг
V. R.
Pellet
P. L.
Современные концепции, касающиеся потребностей взрослых в незаменимых аминокислотах и их значение для международного развития. планирование питания.
Food Nutr. Бык.
12
1990
289
300
48Zello
,G.A.
,Pencharz
,P. B.
иBall
,R.O.
( 1992)Потребность в лизине у молодых взрослых мужчин
.г. J. Physiol.
264
:E677
—E685
.© 1997 Американское общество служб питания
незаменимых и незаменимых аминокислот для человека | Журнал питания
РЕФЕРАТ
Здесь мы сравнили традиционное определение питательных веществ незаменимых и незаменимых аминокислот для людей с категоризацией, основанной на метаболизме и функции аминокислот.Эти три точки зрения приводят к несколько разным толкованиям. С точки зрения питания совершенно очевидно, что некоторые аминокислоты являются абсолютной диетической необходимостью для поддержания нормального роста. Тем не менее, в литературе можно найти реакцию роста на дефицит незаменимых аминокислот. С точки зрения метаболизма, есть только три незаменимые аминокислоты (лизин, треонин и триптофан) и две незаменимые аминокислоты (глутамат и серин). Кроме того, рассмотрение метаболизма аминокислот in vivo приводит к определению третьего класса аминокислот, называемых условно незаменимыми, синтез которых может осуществляться млекопитающими, но может быть ограничен множеством факторов.Эти факторы включают наличие в рационе соответствующих прекурсоров, а также зрелость и здоровье человека. С функциональной точки зрения все аминокислоты незаменимы, и был выдвинут аргумент в пользу идеи о критической важности заменимых и условно незаменимых аминокислот для физиологической функции.
На протяжении как минимум 60 лет принято разделять аминокислоты на две категории: незаменимые (или незаменимые) и несущественные (или несущественные).Эта категоризация обеспечивает удобный и в целом полезный способ просмотра аминокислотного питания. Однако, несмотря на долговечность этой конвенции, по мере того, как становилось все больше информации, различия между незаменимыми и незаменимыми аминокислотами, по крайней мере на метаболическом уровне, становились все более размытыми. Действительно, У. К. Роуз, который отвечал за первоначальное определение этих двух терминов, не был особенно очарован тем, как они применялись другими, и написал следующее (Womack and Rose, 1947):
«Мы подчеркнули несколько раз… классификация аминокислот, таких как аргинин или глутаминовая кислота, как незаменимых или незаменимых, является чисто вопросом определения.”
Я хочу рассмотреть этот« вопрос определения », исследуя термины с точки зрения питания, метаболизма и функциональности.
Пищевая ценность незаменимых и незаменимых аминокислот
Важно помнить, что термины «незаменимый» и «необязательный» изначально были определены не только с точки зрения диеты, но и в отношении роли аминокислот в поддержке отложения и роста белка. На самом деле, насколько я могу судить, исходное определение незаменимой аминокислоты в пищевой ценности (Borman et al.1946) был следующим: «Тот, который не может быть синтезирован организмом животных из материалов , обычно доступных клеткам со скоростью , соизмеримой с требованиями для нормального роста . «
» Ключевые фразы в этом определении и фразы, выделенные авторами курсивом, — «обычно доступны», «со скоростью» и «нормальный рост». Каждый из них является важным определителем.
Фраза «обычно доступная» важна, потому что ряд незаменимых в питательном отношении аминокислот, например.g., аминокислоты с разветвленной цепью, фенилаланин и метионин, могут быть синтезированы путем трансаминирования их аналогичных α-кетокислот. Однако эти кетокислоты обычно не входят в рацион и, следовательно, «обычно не доступны для клеток». Фраза «со скоростью» важна, потому что существуют обстоятельства, при которых скорость синтеза аминокислоты может быть ограничена, например, доступностью соответствующих количеств метаболического азота. Действительно, скорость синтеза приобретает особое значение, когда мы рассматриваем группу аминокислот, например аргинин, цистеин, пролин и, возможно, глицин, которые часто называют условно незаменимыми.Например, Вомак и Роуз (1947) подчеркнули важное замечание о том, что степень, в которой аргинин может считаться незаменимым, во многом зависит от количества его естественных предшественников, пролина и глутамата, в рационе. Наконец, фраза «нормальный рост» важна в двух отношениях. Во-первых, он служит для того, чтобы подчеркнуть, что определения изначально были построены в контексте роста. Например, можно показать (Таблица 1), что прием пищи, полностью лишенной глутамата, который в некотором смысле может рассматриваться как доработка незаменимых аминокислот, приводит к небольшой, но статистически значимой более медленной скорости роста.Во-вторых, ограничение определения существенности для роста не включает в себя важность некоторых аминокислот для путей удаления, отличных от отложения белка, что я буду обсуждать позже.
ТАБЛИЦА 1Влияние рациона без глутамата + глутамина на прибавку массы тела у крыс и свиней
ТАБЛИЦА 1Влияние рациона без глутамата + глутамина на прибавку массы тела у крыс и свиней
Биосинтез аминокислот
Также возможно определить существенность и несущественность аминокислот в химических и метаболических терминах.Изучение аминокислот, которые обычно считаются важными в питательном отношении, показывает, что каждая из них имеет определенную структурную особенность, синтез которой не может быть катализирован ферментами млекопитающих (таблица 2). В связи с этим очень важно отметить, что потеря способности осуществлять эти биосинтеза появилась на ранней стадии эволюции и является общей чертой метаболизма эукариотических организмов в целом, а не только млекопитающих. Однако с этой точки зрения важным термином является синтез de novo.Это связано с тем, что некоторые незаменимые аминокислоты могут быть синтезированы из предшественников, которые очень похожи по структуре. Например, метионин можно синтезировать как путем переаминирования его аналога кетокислоты, так и путем реметилирования гомоцистеина. В этом смысле млекопитающее способно синтезировать лейцин, изолейцин, валин, фенилаланин и метионин. Однако это не новый синтез, потому что кетокислоты с разветвленной цепью и гомоцистеин первоначально были получены из аминокислот с разветвленной цепью и метионина соответственно.Согласно этому ограниченному метаболическому определению существенности, треонин и лизин (и, возможно, триптофан) являются единственными действительно незаменимыми аминокислотами.
ТАБЛИЦА 2Структурные особенности, которые делают аминокислоты незаменимыми компонентами рациона млекопитающих
Аминокислоты . Конструктивная особенность . Лейцин, изолейцин, валин Разветвленная алифатическая боковая цепь Лизин Первичный амин Треонин Треонин Треонин Вторичный спирт Вторичный метанол 39Индольное кольцо Фенилаланин Ароматическое кольцо Гистидин Имидазольное кольцо
ТАБЛИЦА 2Аминокислота . Конструктивная особенность . Лейцин, изолейцин, валин Разветвленная алифатическая боковая цепь Лизин Первичный амин Треонин Треонин Треонин Вторичный спирт 3 Вторичный метанол39Индольное кольцо Фенилаланин Ароматическое кольцо Гистидин Имидазольное кольцо Структурные особенности, которые превращают аминокислоты в незаменимые компоненты в рационе аминокислот 27 904 902 904 902 904 902 902 902 902 .
Конструктивная особенность . Лейцин, изолейцин, валин Разветвленная алифатическая боковая цепь Лизин Первичный амин Треонин Треонин Треонин Вторичный спирт Вторичный метанол 39Индольное кольцо Фенилаланин Ароматическое кольцо Гистидин Имидазольное кольцо Аминокислота . Конструктивная особенность . Лейцин, изолейцин, валин Разветвленная алифатическая боковая цепь Лизин Первичный амин Треонин Треонин Треонин Вторичный спирт Вторичный метанол 39Индольное кольцо Фенилаланин Ароматическое кольцо Гистидин Имидазольное кольцо Обратное относится к заменяемым аминокислотам.Строго говоря, действительно заменимая аминокислота — это аминокислота, которая может быть синтезирована de novo из не аминокислотного источника азота (например, ионов аммония) и подходящего источника углерода. Согласно этому метаболическому определению, единственными действительно метаболически незаменимыми аминокислотами являются глутаминовая кислота и серин. Если это так, то эти две аминокислоты являются конечными предшественниками других заменимых аминокислот. Этот вывод приводит к предсказанию, что вклад эндогенного синтеза в системные потоки глутамата и серина должен быть выше, чем его вклад в потоки других заменимых аминокислот.Похоже, это так (таблица 3). Интересно, что существует обратная взаимосвязь между вкладом эндогенного синтеза в плазменный поток данной заменимой аминокислоты и степенью, с которой кишечник метаболизирует пищевые аминокислоты при первом прохождении (см. Reeds et al.1996, Stoll et al. 1998).
ТАБЛИЦА 3Вклад эндогенного синтеза в системный поток заменимых аминокислот у людей
Аминокислота . Флюс синтеза . . . Федеральное правительство . Постное состояние . % Глутамат 1 98 98 Серин 4904 76 78 Аланин 1 45 46 Глицин 1 35 35 35 35 2 Пролин 2 0 7
ТАБЛИЦА 3Аминокислота . Флюс синтеза . . . Федеральное правительство . Постное состояние . % Глутамат 1 98 98 Серин 4904 76 78 Аланин 1 45 46 Глицин 1 35 35 35 35 2 Пролин 2 0 7 Вклад эндогенного синтеза в системный поток заменимых аминокислот у людей
Аминокислоты . Флюс синтеза . . . Федеральное правительство . Постное состояние . % Глутамат 1 98 98 Серин 4904 76 78 Аланин 1 45 46 Глицин 1 35 35 35 35 2 Пролин 2 0 7 Аминокислота . Флюс синтеза . . . Федеральное правительство . Постное состояние . % Глутамат 1 98 98 Серин 4904 76 78 Аланин 1 45 46 Глицин 1 35 35 35 35 2 Пролин 2 0 7 Условно незаменимые аминокислоты
Хотя азот аминокислот, которые могут синтезировать млекопитающие, в конечном итоге происходит из глутамата или серина, есть некоторые аминокислоты, которые синтезируются более сложными путями, чем простое переаминирование соответствующей кетокислоты.Эти аминокислоты часто называют «условно незаменимыми», этот термин используется для обозначения измеримых ограничений скорости их синтеза. Когда этот предел достигнут, соответствующая аминокислота становится важным компонентом диеты. Ограничения могут быть результатом ряда факторов.
Во-первых, синтез этих аминокислот (таблица 4) требует предоставления другой аминокислоты, либо в качестве донора углерода, либо в качестве донора вспомогательной группы, такой как серная группа цистеина.Таким образом, способность организма синтезировать данную условно незаменимую аминокислоту определяется доступностью ее предшественника аминокислоты, что подчеркивал Роуз в своих исследованиях взаимодействия глутамата, пролина и аргинина в питании. В некоторых случаях, например, для поддержания поступления глицина у млекопитающих, вскармливаемых молоком, потребность в синтезе условно незаменимых аминокислот (Джексон и др., 1981) требует увеличения синтеза его предшественника, в данном случае серина. .
ТАБЛИЦА 4Прекурсоры условно незаменимых аминокислот
Продукт . Прекурсор углерода . Другой прекурсор . Аргинин Глутамат / глутамин / пролин Аммиак и аспартат № ) Глицин Серин
ТАБЛИЦА 4Продукт . Прекурсор углерода . Другой прекурсор . Аргинин Глутамат / глутамин / пролин Аммиак и аспартат № ) Глицин Серин Прекурсоры условно незаменимых аминокислот
Продукт . Прекурсор углерода . Другой прекурсор . Аргинин Глутамат / глутамин / пролин Аммиак и аспартат № ) Глицин Серин Продукт . Прекурсор углерода . Другой прекурсор . Аргинин Глутамат / глутамин / пролин Аммиак и аспартат № ) Глицин Серин Во-вторых, некоторые аминокислоты могут быть синтезированы только в ограниченном количестве тканей.Например, синтез пролина и аргинина в решающей степени зависит от метаболизма в кишечнике (Wakabayashi et al. 1994, Wu et al. 1997). Более того, в случае этих двух аминокислот имеющиеся данные свидетельствуют о том, что диетические, в отличие от системных, предшественники аминокислот являются обязательными (Beaumier et al. 1995, Berthold et al. 1995, Brunton et al. 1999, Murphy et al. 1996 г., Столл и др. 1999 г.). Из этого следует, что изменения либо в кишечном метаболизме, либо в способе питания могут иметь решающее значение для способности организма синтезировать эти аминокислоты.Об этом ярко свидетельствуют проблемы гомеостаза аргинина и аммиака, которые сопровождают полное парентеральное питание (Brunton et al. 1999).
В-третьих, большинство данных свидетельствует о том, что даже в присутствии обильных количеств соответствующих предшественников количества условно незаменимых аминокислот, которые могут быть синтезированы, могут быть весьма ограниченными (Beaumier et al. 1995, Berthold et al. 1995, Castillo et al. al. 1993, Fukagawa et al. 1996, Jaksic et al. 1987), поэтому можно утверждать, что существуют обстоятельства, особенно стрессовые обстоятельства, при которых метаболические потребности в аминокислотах возрастают до значений, превышающих биосинтетические возможности организм.Похоже, так обстоит дело с пролиновым питанием обожженных людей (Jaksic et al. 1991). Более того, у незрелых людей, таких как дети с низкой массой тела при рождении, возможно, что синтез условно незаменимых аминокислот может быть ограничен явным отсутствием ферментативной активности (Gaull et al. 1972).
Эти комментарии, однако, должны быть умеренными с осторожностью, потому что кажется вероятным, что метаболизм некоторых условно незаменимых аминокислот сильно разделен на части и, следовательно, измерения изотопов в пуле плазмы могут дать количественное неверное представление о масштабе биосинтез.Это, по-видимому, относится к метаболизму пролина, аргинина и цистеина, поскольку оценки скорости их синтеза на основе параллельных измерений потребления и протеолиза организма не согласуются с оценками, основанными на включении изотопов из меченых предшественников (см. Beaumier et al. 1995 и Berthold et al. 1995 для аргинина; Jaksic et al. 1987 и Berthold et al. 1995 для пролина). Кроме того, есть данные, позволяющие предположить, что вновь синтезированные условно незаменимые аминокислоты могут использоваться в исходных клетках и, следовательно, не уравновешиваются с пулом плазмы (Miller et al.1996). Тем не менее, даже с учетом этих неопределенностей, кажется, что синтез этих аминокислот может стать ограничивающим для роста и других физиологических функций, и что можно определить абсолютные, а не относительные диетические потребности.
Аминокислоты и физиологическая функция
Как я подчеркивал здесь ранее, первоначальные определения терминов «незаменимый» и «необязательный» были сосредоточены на росте или, вернее, на отложении белка.Когда определения применяются таким образом, возникает относительно небольшая путаница, по крайней мере, в отношении незаменимых аминокислот. Количественная оценка минимальных потребностей в незаменимых аминокислотах для поддержки роста относительно проста, потому что они являются просто продуктом скорости отложения белка и аминокислотного состава отложенных белков. В этом отношении существует хороший консенсус в отношении того, что относительные потребности отдельных аминокислот для поддержки отложения белка очень похожи среди видов млекопитающих (Таблица 5).Другими словами, потребности в аминокислотах для поддержки отложения белка у младенца человека отличаются от потребностей других млекопитающих только в той степени, в которой их соответствующие скорости отложения белка различаются.
ТАБЛИЦА 5Состав незаменимых аминокислот смешанного белка тела незрелых млекопитающих
ТАБЛИЦА 5Состав незаменимых аминокислот смешанного белка тела незрелых млекопитающих
У людей обязательные потребности в аминокислотах для отложения чистого белка очень незначительная часть общей потребности в аминокислотах (Dewey et al.1996), и> 90% от общей потребности в аминокислотах, даже для маленького ребенка, связано с поддержанием запасов белка в организме (то есть азотного равновесия). Сформулировать потребности в аминокислотах для «поддержания» сложно и до сих пор остаются предметом споров (см. Young and Borgonha 2000).
Не менее важной, чем технические и экспериментальные трудности, связанные с измерением потребности в поддерживающих аминокислотах (Fuller and Garlick, 1994), является проблема идентификации процессов, которые потребляют аминокислоты, близкие к азотному равновесию.Часть этих потребностей, конечно, напрямую связана с метаболизмом белков и отражает два связанных фактора: аминокислоты, высвобождаемые в результате разложения тканевых белков, вряд ли будут повторно использоваться с полной эффективностью, и что присутствие конечных концентраций свободных аминокислот неизбежно приводит к некоторой степени катаболизма. Также появляется все больше доказательств того, что значительная часть потребностей в некоторых незаменимых аминокислотах может отражать <100% эффективную переработку кишечных секретов (Fuller et al.1994, Fuller and Reeds, 1998. Этот аспект потребности в основных или поддерживающих аминокислотах поддается прямому измерению, хотя некоторые технические аспекты этих измерений, особенно связанные с метаболической функцией кишечного белка, создают трудности (см. Fuller and Reeds, 1998). . Однако по мере накопления большего количества информации становится все более очевидным, что аминокислоты участвуют (и, следовательно, потребляются) в ряде физиологических функций, которые напрямую не связаны с самим метаболизмом белков.
Прежде чем перейти к обсуждению этих путей, необходимо подчеркнуть два дополнительных момента. Во-первых, при потреблении белка, достаточном для поддержания белкового равновесия в организме, ограничивающим питательным веществом может быть сам метаболический азот, а не какая-либо отдельная аминокислота. Другими словами, из-за дефицита азота способность организма синтезировать аминокислоты может быть снижена до такой степени, что потребление заменимых аминокислот может стать ограниченным. Это может быть особенно применимо к условиям, связанным с потреблением небольших количеств так называемых белков высокого качества (т.е., белки, которые хорошо сбалансированы по отложению белков и, следовательно, с высоким соотношением незаменимая аминокислота / незаменимая аминокислота). Во-вторых, теперь есть данные, показывающие, что взрослый человек способен снижать катаболизм любой отдельной аминокислоты, близкий к нулю, если эта аминокислота сильно ограничивает (Raguso et al. 1999). Однако скорость катаболизма аминокислоты, наблюдаемая в этом случае, намного ниже, чем скорость катаболизма, наблюдаемая, когда белок в целом является ограничивающим диетическим питательным веществом.Одно из объяснений этого наблюдения состоит в том, что в условиях безбелкового питания пул свободных аминокислот происходит исключительно за счет протеолиза тканей, так что все аминокислоты одинаково ограничивают. Следствием этого является то, что использование любой отдельной аминокислоты для поддержки небелкового процесса автоматически ограничивает способность организма рециркулировать все остальные аминокислоты обратно в белковые запасы организма. Возникают вопросы: каковы эти небелковые пути потребления и каково их количественное влияние на потребность в аминокислотах в целом? Краткий ответ на оба вопроса прост: на текущий момент недостаточно информации, чтобы дать точные ответы.Тем не менее, можно предположить, какие пути могут быть наиболее важными на уровне общей физиологической функции.
Для развития этих гипотез полезно рассмотреть те функции, которые необходимы для поддержания здоровья. Это не новый подход, поскольку его полезность была явно оценена некоторыми основоположниками науки о питании. Например, Войт (1902), цитируемый Луском (1922), написал следующее:
«Поэтому я придерживаюсь своей« старой »точки зрения, точки зрения чистого метаболизма … тем более объединяющее развитие станет возможным по мере изучения того, что вещества разрушаются при разных обстоятельствах… и сколько различных материалов необходимо подавать, чтобы поддерживал тело в рабочем состоянии.»
На мой взгляд, для« поддержания в рабочем состоянии »критически важны четыре системы: кишечник для поддержания абсорбционной и защитной функций; иммунная система и другие аспекты защиты; скелетная мускулатура; и центральная нервная система. Внутри каждой системы можно определить критические метаболические роли некоторых конкретных аминокислот (таблица 6).
ТАБЛИЦА 6Участие аминокислот в физиологической и метаболической функции
Система . Функция . Товар . Прекурсор . Кишечник Выработка энергии АТФ Глу, аспид, глутамин Пролиферация Нуклеиновые кислоты Глутамин 904 904 Глутамин
904 904 Глутамин
904 904 Глутамин
Cys, Glu, Gly Оксид азота Arg Mucins Thr, Cys, Ser, Pro 40 44446 Gly, Arg, Met Пероксидная защита Таурин (?) Cys Нервная система Синтез передатчика Adrenergic4 Попробуйте 9 0440 Глутаминергический Глу Глицинергический Гли 904 904 904 904 904 Nitric 904 904 904 904 Nitric4 904 904 904 904 904 Native40 904 904 904 904 904 Nitric 40 ) Cys Иммунная система Пролиферация лимфоцитов (?) Глутамин, Arg, Asp Пероксидантная защита Пероксидантная защита Глутатион Глутатион Глутатион Глутатион Регулирование артериального давления Оксид азота Arg Пероксидантная защита (?) Глутатион красных клеток Cys, Glu, Gly Система .
ТАБЛИЦА Участие 6Функция . Товар . Прекурсор . Кишечник Выработка энергии АТФ Глу, аспид, глутамин Пролиферация Нуклеиновые кислоты Глутамин 904 904 Глутамин
904 904 Глутамин
904 904 Глутамин
Cys, Glu, Gly Оксид азота Arg Mucins Thr, Cys, Ser, Pro 40 44446 Gly, Arg, Met Пероксидная защита Таурин (?) Cys Нервная система Синтез передатчика Adrenergic4 Попробуйте 9 0440 Глутаминергический Глу Глицинергический Гли 904 904 904 904 904 904 Nitric 904 904 904 904 904 904 904 904 Nitric 904 ) Cys Иммунная система Пролиферация лимфоцитов (?) Глутамин, Arg, Asp Пероксидантная защита Пероксидантная защита Глутатион Глутатион Глутатион Глутатион Регулирование артериального давления Оксид азота Arg Пероксидантная защита (?) Глутатион красных клеток Cys, Glu, Gly аминокислот метаболизм Функция микросхемы
Система . Функция . Товар . Прекурсор . Кишечник Выработка энергии АТФ Глу, аспид, глутамин Пролиферация Нуклеиновые кислоты Глутамин 904 904 Глутамин
904 904 Глутамин
904 904 Глутамин
Cys, Glu, Gly Оксид азота Arg Mucins Thr, Cys, Ser, Pro 40 44446 Gly, Arg, Met Пероксидная защита Таурин (?) Cys Нервная система Синтез передатчика Adrenergic4 Попробуйте 9 0440 Глутаминергический Глу Глицинергический Гли 904 904 904 904 904 Nitric 904 904 904 904 Nitric4 904 904 904 904 904 Native40 904 904 904 904 904 Nitric 40 ) Cys Иммунная система Пролиферация лимфоцитов (?) Глутамин, Arg, Asp Пероксидантная защита Пероксидантная защита Глутатион Глутатион Глутатион Глутатион Регулирование артериального давления Оксид азота Arg Пероксидантная защита (?) Глутатион красных клеток Cys, Glu, Gly Система .
Функция . Товар . Прекурсор . Кишечник Выработка энергии АТФ Глу, аспид, глутамин Пролиферация Нуклеиновые кислоты Глутамин 904 904 Глутамин
904 904 Глутамин
904 904 Глутамин
Cys, Glu, Gly Оксид азота Arg Mucins Thr, Cys, Ser, Pro 40 44446 Gly, Arg, Met Пероксидная защита Таурин (?) Cys Нервная система Синтез передатчика Adrenergic4 Попробуйте 9 0440 Глутаминергический Глу Глицинергический Гли 904 904 904 904 904 904 Nitric 904 904 904 904 904 904 904 904 Nitric 904 ) Cys Иммунная система Пролиферация лимфоцитов (?) Глутамин, Arg, Asp Пероксидантная защита Пероксидантная защита Глутатион Глутатион Глутатион Глутатион Регулирование артериального давления Оксид азота Arg Пероксидантная защита (?) Глутатион красных клеток Cys, Glu, Gly Возможно, самое интересное рассмотрение Т 6 состоит в том, что, за исключением участия фенилаланина и триптофана в поддержании адренергической и серотонинергической систем нейротрансмиттеров, а также метионина в качестве донора метильной группы для синтеза креатина, необходимые предшественники являются несущественными или условно незаменимыми аминокислотами.Таким образом, возникает соблазн утверждать, что способность поддерживать синтез этих аминокислот имеет достаточно высокий функциональный приоритет, что в условиях, в которых белок (азот) ограничен, незаменимые аминокислоты используются для поддержания этих путей. В таблице 7 я попытался сравнить оценки оборота или потерь некоторых критических конечных продуктов с кинетикой их аминокислот-предшественников. Это сравнение предполагает, что некоторые пути, например, производство таурина и оксида азота, имеют небольшое количественное влияние на питание прекурсоров, тогда как другие имеют гораздо большее значение.Таким образом, синтез креатина (оцениваемый по экскреции креатинина) и обмен глутатиона (оцениваемый по измерениям в плазме и эритроцитах) имеют существенное влияние на утилизацию некоторых предшественников, особенно если скорость синтеза продукта сравнивается с потребление или чистый синтез предшественника. Продолжающийся синтез этих двух конечных продуктов, один из которых участвует в трансдукции энергии как в мускулатуре, так и в центральной нервной системе, а другой является критическим фактором в механизмах детоксикации, по-видимому, оказывает существенное потенциальное влияние на состояние питания человека.Действительно, данные, полученные у свиней с обедненным белком (Jahoor et al. 1995) и у бессимптомных ВИЧ-инфицированных пациентов (Jahoor et al. 1999), демонстрируют, что поступление белка и цистеина может заметно изменить способность организма поддерживать синтез глутатиона. .
ТАБЛИЦА 7Потенциальный вклад синтеза функционально важных конечных продуктов в потребности в аминокислотах у взрослых людей
. глутамат . Глицин . цистеин . аргинин . метионин . Кинетика прекурсора [мкмоль / (кг · сут)] Плазменный поток 9018 904 39 4200 440 904 904 904 904 904 9018 9018 9018 904 904 904 904 39439 42004 31800 4 528 3 Чистый синтез 358 5 2730 5 96 8 Производство конечного продукта [мкмоль / (кг · г)] Креатин 9 170 Таурин 10 7 9043 9 Оксид азота 11 15 Глутатион 12 550 550 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 .глутамат . Глицин . цистеин . аргинин . метионин . Кинетика прекурсора [мкмоль / (кг · сут)] Плазменный поток 9018 904 39 4200 440 904 904 904 904 904 9018 9018 9018 904 904 904 904 39439 42004 31800 4 528 3 Чистый синтез 358 5 2730 5 96 8 Производство конечного продукта [мкмоль / (кг · г)] Креатин 9 170 Таурин 10 7 9043 9 Оксид азота 11 15 Глутатион 12 550 550 904 905 904 904 904 904 904 904 904 904 904 905 Возможный вклад синтеза функционально важных конечных продуктов в потребности в аминокислотах у взрослых людей. глутамат . Глицин . цистеин . аргинин . метионин . Кинетика прекурсора [мкмоль / (кг · сут)] Плазменный поток 9018 904 39 4200 440 904 904 904 904 904 9018 9018 9018 904 904 904 904 39439 42004 31800 4 528 3 Чистый синтез 358 5 2730 5 96 8 Производство конечного продукта [мкмоль / (кг · г)] Креатин 9 170 Таурин 10 7 9043 9 Оксид азота 11 15 Глутатион 12 550 550 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 904 .глутамат . Глицин . цистеин . аргинин . метионин . Кинетика прекурсора [мкмоль / (кг · сут)] Плазменный поток 9018 904 39 4200 440 904 904 904 904 904 9018 9018 9018 904 904 904 904 39439 42004 31800 4 528 3 Чистый синтез 358 5 2730 5 96 8 Производство конечного продукта [мкмоль / (кг · г)] Креатин 9 170 Таурин 10 7 9043 9 Оксид азота 11 15 Глутатион 12 550 550 904 904 904 904 904 904 904 904 904 обязательно Вкратце, я попытался изучить термины «незаменимый» и «необязательный» применительно к аминокислотам с трех точек зрения.Традиционный взгляд на питание, в котором особое внимание уделяется росту, четко отличает аминокислоты, которые должны поступать с пищей, от аминокислот, которые не обязательно должны поступать из этого источника. Метаболическая точка зрения приводит к несколько более сложной интерпретации; это показывает, что могут быть значительные ограничения на синтез некоторых аминокислот, что делает их потенциальными ограничениями для роста. Наконец, функциональная точка зрения не только указывает на важность всех аминокислот для определенных физиологических функций, но также приводит к выводу, что в условиях, когда белок является основным ограничением питания, способность поддерживать синтез некоторых традиционно заменимых аминокислот. может иметь решающее значение для постоянного здоровья и функциональной целостности человека.Очевидно, что сейчас все готово для дальнейшего, более детального количественного исследования этих важных вопросов. Я с нетерпением жду расширения наших знаний о функциях аминокислот, которое выходит за рамки традиционного внимания к белку.ЦИТИРОВАННАЯ ЛИТЕРАТУРА
Berthold
,H. K.
,Reeds
,P. J.
иKlein
,P. D.
(1995
)Изотопные доказательства дифференциальной регуляции синтеза аргинина и пролина у человека
.Метаболизм
44
:466
—473
.Beaumier
,L.
,Castillo
,L.
,Ajami
,AM
иYoung
,VR
(1995
)Промежуточная кинетика нитратного цикла и нормальная кинетика цикла мочевины и «терапевтическое» потребление аргинина людьми
.г. J. Physiol.
269
:E884
—E896
.Borman
,A.
,Wood
,TR
,Balck
,HC
,Anderson
,EG
,Oesterling
,MJ
,, Womack,, Womack &Rose
,WC
(1946
)Роль аргинина в росте с некоторыми наблюдениями за эффектами аргининовой кислоты
.J. Biol. Chem.
166
:585
—594
.Brunton
,JA
,Bertolo
,RF
,Pencharz
,PB
иBall
,RO
(1999
)Пролин не улучшает энтеральное питание, но не устраняет дефицит пролина при энтеральном кормлении новорожденные поросята
.г. J. Physiol.
277
:E223
—E231
.Кастильо
,Л.
,Бомье
,Л.
,Ajami
,AM
иYoung
,VR
(1996
)Синтез оксида азота во всем организме у здоровых мужчин, определенный из [ 15 N] аргинина до — [ 15 N] цитруллин маркировка
.Proc. Natl. Акад. Sci. США
93
:11460
—11465
.Castillo
,L.
,Chapman
,T. E.
,Sanchez
,M.
,Yu
,YM
,Burke
,JF
,Ajami
,AM
,Vogt
,J.
иYoung
,VR
(as5) кинетика аргинина и цитруллина у взрослых, получающих адекватную диету без аргинина.Proc. Natl. Акад. Sci. США
90
:7749
—7753
.Дэвис
,Т. А.
,Фиоротто
,М.L.
иReeds
,P. J.
(1993
)Аминокислотный состав тела и молочного белка изменяется в течение периода сосания у крыс
.J. Nutr.
123
:947
—956
.Dewey
,KG
,Beaton
,G.
,Fjeld
,C.
,Lonnerdal
,B.
иReeds
,P.
(1996)Потребность младенцев и детей в белке
.евро. J. Clin. Nutr.
50
(доп.1
):S119
—S147
.Fukagawa
,N. K.
,Ajami
,A. M.
иYoung
,V. R.
(1996
)Кинетика метионина и цистеина в плазме у взрослых людей в ответ на внутривенное введение глютатиона 9000.
г. J. Physiol.
270
:E209
—E214
.Фуллер
,M.F.
иGarlick
,P. J.
(1994
)Потребности человека в аминокислотах: можно ли разрешить спор?
.Annu. Ред. Nutr
14
:217
—241
.Fuller
,MF
,Milne
,A.
,Harris
,CI
,Reid
,TM
иKeenan
,R.
( 1994 9000) потери кислоты в илеостомической жидкости при безбелковой диете.г. J. Clin. Nutr.
59
:70
—73
.Fuller
,M. F.
иReeds
,P. J.
(1998
)Эндогенный азот в кишечнике
.Annu. Rev. Nutr.
18
:385
—411
.Gaull
,G.
,Sturman
,J. A.
иRaiha
,N.C.
(1972
)Развитие серного обмена у млекопитающих: отсутствие цистатионазы в тканях плода человека
.Педиатр. Res.
6
:538
—547
.Hepburn
,F. N.
иBradley
,W. B.
(1964
)Потребность в глутаминовой кислоте и аргинине для высокой скорости роста крыс, получавших аминокислотный рацион
.J. Nutr.
84
:305
—312
.Хорват
,К.
,Джами
,М.
,Хилл
,I.D.
,Papadimitriou
,JC
,Magder
,LS
иChanasongcram
,S.
(1996
)Изокалорийная безглютаминовая диета и морфология и функция тонкой кишки
.J. Парентеральное энтеральное питание.
20
:128
—134
.Джексон
,А. А.
,Шоу
,Дж. К.
,Барбер
,А.
иGolden
,M. H.
(1981
)Метаболизм азота у недоношенных детей, вскармливаемых человеческим донорским грудным молоком: возможная важность глицина
.Педиатр. Res.
15
:1454
—1461
.Jahoor
,F.
,Jackson
,A.
,Gazzard
,B.
,Philips
,G.
,Sharpstone
,D.
,, FrazerМ.E.
иHeird
,W.
(1999
)Дефицит глутатиона эритроцитов при бессимптомной ВИЧ-инфекции связан со снижением скорости синтеза
.г. J. Physiol.
276
:E205
—E211
.Jahoor
,F.
,Wykes
,L. J.
,Reeds
,P. J.
,Henry
,J. F.
,del Rosario
,M.P.
иFrazer
,M. E.
(1995
)Свиньи с дефицитом белка не могут поддерживать пониженный гомеостаз глутатиона при воздействии стресса воспаления
.J. Nutr.
125
:1462
—1472
.Jaksic
,T.
,Wagner
,DA
,Burke
,JF
иYoung
,VR
(1987
)Плазменная регуляция кинетики пролина и синтеза пролина человек
.Метаболизм
36
:1040
—1046
.Jaksic
,T.
,Wagner
,DA
,Burke
,JF
иЯнг
,VR
(1991
)Пациенты с ожогами пролина и здоровые контрольные мужчины предметы
.г. J. Clin. Нутр
54
:408
—413
.Луск
,г.
(1922
)Метаболизм пролина у взрослых мужчин с ожогами и здоровых контрольных субъектов
.The Science of Nutrition
Johnson Reprint Corporation
New York
, 1976 г.Mahan
,DC
иShields
,RG
, Jr (1998
)Состав незаменимых и несущественных аминокислот свиней от рождения до 145 кг массы тела, и сравнение с другими исследованиями
.J. Anim. Sci.
76
:513
—521
.Мэтьюз
,Д. Е.
иКэмпбелл
,Р. Г.
(1992
)Влияние потребления белка с пищей на глутамин и азотный обмен глутамина у людей
.г. J. Clin. Nutr.
55
:963
—970
.Meier
,P.
,Teng
,C.
,Battaglia
,F.C.
иMeschia
,G.
(1981
)Скорость накопления аминокислотного азота и общего азота в плоде ягненка
.Proc. Soc. Exp. Биол. Med.
167
:463
—468
.Miller
,RG
,Keshen
,TH
,Jahoor
,F.
,Shew
,SB
иJaksic
,T.
(1996
, отсек 5) эндогенно синтезированных аминокислот у новорожденных.J. Surg. Res.
63
:199
—203
.Murphy
,J. M.
,Murch
,S. J.
иBall
,R.O.
(1996
)Пролин синтезируется из глутамата во время внутрижелудочной инфузии свиней, но не во время внутривенной инфузии.
J. Nutr.
126
:878
—886
.Нейсмит
,Д.J.
,Rana
,S. K.
&Emery
,P. W.
(1987
)Метаболизм таурина во время репродукции у женщин
.Hum. Nutr. Clin. Nutr.
41
:37
—45
.Pellet
,P. L.
иKaba
,H.
(1972
)Аминокислоты туши крысы в условиях определения чистого использования белка
.J. Nutr.
102
:61
—68
.Raguso
,C. A.
,Pereira
,P.
иYoung
,VR
(1999
)Исследование с помощью трассирующих индикаторов обязательных окислительных потерь аминокислот у здоровых молодых людей
.г. J. Clin. Nutr.
70
:474
—483
.Трости
,P. J.
,Burrin
,D.G.
,Jahoor
,F.
,Wykes
,L.
,Henry
,J.
иFrazer
,ME
(1996
)Энтеральный глутамат метаболизируется при первом прохождении через желудочно-кишечный тракт детенышей свиней
.г. J. Physiol.
270
:E413
—E418
.Ридс
,P. J.
,Burrin
,D. G.
,Stoll
,B.
,Jahoor
,F.
,Wykes
,L.
,Henry
,J.
иFrazer
,ME
(1997
)Энтеральный источник глутамата является предпочтительным для синтез глутатиона слизистой у откормленных поросят
.г. J. Physiol.
273
:E408
—E415
.Stoll
,B.
,Burrin
,D. G.
,Henry
,J.
,Yu
,H.
,Jahoor
,F.
иReeds
,P. J.
(1999
)Окисление субстрата через портальные дренированные внутренности откормленных поросят
.г. J. Physiol.
277
:E168
—E175
.Stoll
,B.
,Henry
,J.
,Reeds
,P. J.
,Yu
,H.
,Jahoor
,F.
иBurrin
,D. G.
(1998
)Катаболизм доминирует в кишечном метаболизме первого прохождения незаменимых аминокислот у поросят, получавших молочный белок
.J. Nutr.
128
:606
—614
.Wakabayashi
,Y.
,Yamada
,E.
,Yoshida
,T.
иTakahashi
,H.
(1995
)аргинин становится незаменимой аминокислотой массивная резекция тонкой кишки крысы
.J. Biol. Chem.
269
:32667
—32671
.Widdowson
,E. M.
,Southgate
,D.A.T.
иHey
,E. N.
(1979
)Состав тела плода и младенца
.Visser
,H.K.A.
ред.Питание плода и младенца
:169
—177
Martinus Njihoff Publishers London
,England
.Williams
,A. P.
(1978
)Аминокислотный, коллагеновый и минеральный состав недожвачных телят
.J. Agri. Sci. (Камб.).
90
:617
—624
.Womack
,M.
иRose
,W. C.
(1947
)Роль пролина, гидроксипролина и глутаминовой кислоты в росте
.J. Biol. Chem.
171
:37
—50
.Wu
,G.
,Davis
,PK
,Flynn
,NE
,Knabe
,DA
иDavidson
,JT
( 9000) синтез аргинина играет важную роль в поддержании гомеостаза аргинина у растущих свиней после отъема.J. Nutr.
127
:2342
—2349
.Ву
,г.
,Отт
,Т.L.
,Knabe
,D. A.
иBazer
,F. W.
(1999
)Аминокислотный состав плода свиньи
.J. Nutr.
129
:1031
—1038
.Янг
,V.
иR & Borgonha
,S.
(2000
)Требования к азоту и аминокислотам: схема аминокислотных требований Массачусетского технологического института
.J. Nutr.
130
:1841S
—1849
S.Yu
,YM
,Yang
,RD
,Matthews
,DE
,0004 Wen, ,JF
,Bier
,DM
иYoung
,VR
(1985
)Количественные аспекты азотистого обмена глицина и аланина у молодых мужчин после абсорбции: влияние уровня азота и потребления незаменимых аминокислот
.J. Nutr.
115
:399
—410
.© 2000 Американское общество диетологии
Строительные блоки белка в организме
Есть два типа аминокислот: незаменимые и заменимые. Человеческое тело не производит эти белки, хотя они жизненно важны для поддержания жизни человека. Это означает, что вы должны получать их с белком, содержащимся в растительной и животной пище.
Восемь незаменимых аминокислот:
- Изолейцин
- лейцин
- Лизин
- метионин
- фенилаланин
- Треонин
- Триптофан
- Валин
Кроме этих восьми, есть гистидин . Технически он принадлежит к списку незаменимых аминокислот. Однако детский организм не вырабатывает достаточное количество гистидина и, следовательно, должен получать добавки с пищей.
Продукты, богатые изолейциномМолоко и молочные продукты
Продукты, богатые лейцином
Яйца
Курица
Говядина
Свинина
Орехи и семена
Бобовые, горох, фасоль и арахисовое маслоСыр пармезан
Продукты, богатые лизином
Соевые бобы
Куриная грудка
Тунец
Говядина
Орехи
Соевые бобыПостная говядина
Продукты, богатые метионином
Свинина
Сыр пармезан
Индейка и курица
Тунец, приготовленный
Яйца
Белая фасольРыба и моллюски
Продукты, богатые фенилаланином
Сыр Пармезан
Белая фасоль
Яйца
Индейка и курица
Постная говядина
БаранинаСыр Пармезан
Продукты, богатые треонином
Молочные продукты
Постная говядина и баранина
Яйца
Бобы пинто
Соевые бобы
Белые бобыИндейка и курица
Продукты, богатые триптофаном
Сыр пармезан
Постная говядина и баранина
Рыба и моллюски
Орехи
Белая фасоль
Соевые бобыСемена и орехи
Продукты, богатые валином
Ягненок
Курица и индейка
Рыба и крабы
Фасоль
Говядина
Соевые бобыМолочные продукты, сыр и яйца
Продукты, богатые гистидином
Семена и орехи
Рыба
Свинина
Говядина
Фасоль
Курица и индейкаРыба
Свинина
Фасоль
Яйца и молочные продукты
Семена и орехи
Индейка и курица
Соевые бобыНе все эти источники равны.Некоторые содержат большее количество белка с более высокой биологической ценностью, особенно белки животных. Конечно, это не означает, что вы не можете получить необходимые белки и аминокислоты из вегетарианской диеты. Это означает, что вам нужно комбинировать разные источники, которые дополняют друг друга. Например, фасоль и тосты дополняют друг друга, помогая вашему организму более эффективно усваивать белки, содержащиеся в фасоли.
Различные характеристики выведения аминокислот с мочой у людей и использование аминокислотных добавок для снижения усталости и ухудшения здоровья у взрослых | Журнал питания
- 1.
Boirie Y. Физиопатологический механизм саркопении. J Nutr Здоровье Старения. 2009; 13: 717–23.
CAS Статья PubMed Google Scholar
- 2.
Jagoe RT, Engelen MPKJ. Мышечное истощение и изменения метаболизма мышечных белков при хронической обструктивной болезни легких. Eur Respir J. 2003; 22: 52s – 63s.
CAS Статья Google Scholar
- 3.
Oehler R, Roth E.Метаболизм глутамина. В: Кинобер Л.А., редактор. Метаболические и терапевтические аспекты аминокислот в лечебном питании. Издание второе. Нью-Йорк: CRC Press; 2004. с. 169–82.
Google Scholar
- 4.
Udenfriend S, Wyngaarden JB. Предшественники адреналина и норадреналина in vivo. Biochim Biophys Acta. 1956; 20: 48–52.
CAS Статья PubMed Google Scholar
- 5.
де Конинг Т.Дж., Снелл К., Дюран М., Бергер Р., Опрос-Б-Т, Сёртиз Р. L-серин в болезни и развитии. Биохим Дж. 2003; 371: 653–61.
Артикул PubMed PubMed Central Google Scholar
- 6.
Poortmans JR, Carpentier LO, Pereira-Lancha LO, Lancha Jr A. Оборот белков, потребности в аминокислотах и рекомендации для спортсменов и активных групп населения. Braz J Med Biol Res. 2012; 45: 875–90.
CAS Статья PubMed PubMed Central Google Scholar
- 7.
Филипс СМ. Потребность в белке и добавки в силовых видах спорта. Питание. 2004. 20: 689–95.
CAS Статья PubMed Google Scholar
- 8.
Waterlow JC, Jackson AA. Питание и белковый обмен в человеке. Br Med Bull. 1981; 37: 5–10.
CAS Статья PubMed Google Scholar
- 9.
Corsetti R, Barassi A, Perego S, Sansoni V, Rossi A, Damele CAL, d’Eril GM, Banfi G, Lombardi G.Изменения экскреции аминокислот с мочой в зависимости от маркеров мышечной активности во время профессиональных соревнований по велоспорту: в поисках маркеров усталости. Аминокислоты. 2016; 48: 183–92.
CAS Статья PubMed Google Scholar
- 10.
Dunstan RH, Sparkes DL, Dascombe BJ, Evans CA, Macdonald MM, Crompton MJ, Franks J, Murphy G, Gottfries J, Carlton B. Sweat способствовал потере аминокислот у лошадей стандартной породы и применению добавок стратегии для поддержания кондиции во время тренировок.Comp Exercise Physiol. 2015; 11: 201–12.
Артикул Google Scholar
- 11.
Данстан Р.Х., Спаркс Д.Л., Даскомб Б.Дж., Макдональд М.М., Эванс, Калифорния, Стивенс С.Дж., Кромптон М.Дж., Готфрис Дж., Фрэнкс Дж., Мерфи Дж. И др. Пот способствует потере аминокислот у спортсменов-мужчин во время упражнений при 32-34 ° C. PLoS One. 2016; 11: 1–16.
Артикул Google Scholar
- 12.
Dunstan RH.Измененный аминокислотный гомеостаз и развитие утомляемости пациентов лучевой терапии рака груди: пилотное исследование. Clin Biochem. 2011; 44: 208–15.
- 13.
Niblett SN. Гематологические аномалии и аномалии мочевыделения у пациентов с синдромом хронической усталости. Exp Biol Med. 2007; 232: 1041–9.
CAS Статья Google Scholar
- 14.
Liappis N, Hungerland H. Количественное исследование свободных аминокислот в эккринном поте человека при нормальных условиях.Am J Clin Nutr. 1972; 25: 661–3.
CAS PubMed Google Scholar
- 15.
Армстронг, доктор медицины, Став У. Исследование уровней свободных аминокислот в плазме. II. Нормальные значения для детей и взрослых. Обмен веществ. 1973; 22: 561–9.
CAS Статья PubMed Google Scholar
- 16.
Weschler LB. Концентрация электролитов пота, полученная из окклюзионных покрытий, ложно высока, потому что пот сам вымывает электролиты кожи.J Appl Physiol. 2008; 105: 1376–7.
Артикул PubMed Google Scholar
- 17.
Scott IR, Harding CR, Barrett JG. Богатый гистидином белок гранул кератогиалина. Источник свободных аминокислот, урокановой кислоты и пирролидонкарбоновой кислоты в роговом слое. Biochim Biophys Acta. 1982; 719: 110–7.
CAS Статья PubMed Google Scholar
- 18.
Kingsbury KJ, Kay L, Hjelm M. Контрастные образцы свободных аминокислот в плазме крови у элитных спортсменов: связь с усталостью и инфекцией. Br J Sports Med. 1998. 32: 25–32.
CAS Статья PubMed PubMed Central Google Scholar
- 19.
Пэддон-Джонс Д. Атрофия и нарушение синтеза мышечного белка при длительном бездействии и стрессе. J Clin Endocrinol Metabol. 2006; 91: 4836–41.
CAS Статья Google Scholar
- 20.
Данстан Р.Х., Спаркс Д.Л., Робертс Т.К., Кромптон М.Дж., Готфрис Дж., Даскомб Б.Дж. Разработка комплексной аминокислотной добавки fatigue reviva ™ для перорального приема: первоначальная оценка концепции продукта и влияние на симптомы слабого здоровья в группе мужчин. Нутр Дж. 2013; 12: 115.
CAS Статья PubMed PubMed Central Google Scholar
- 21.
Данстан Р.Х., Спаркс Д.Л., Робертс Т.К., Даскомб Б.Дж. Предварительные оценки комплексной аминокислотной добавки Reviva TM для снижения утомляемости в группе профессиональных спортсменов-мужчин и в группе мужчин, набранных из числа населения.Food Nutr Sci. 2014; 5: 231–5.
Артикул Google Scholar
- 22.
Данстан Р.Х., МакГрегор Н.Р., Батт Х.Л., Робертс Т.К., Клайнберг И.Дж., Ниблетт С.Н., Роткирх Т.Б., Баттфилд I. Характеристика дифференциального гомеостаза аминокислот среди подгрупп населения: основа для определения конкретных потребностей в аминокислотах. J Nutr Environ Med. 2000; 10: 211–23.
CAS Статья Google Scholar
- 23.
Watanabe N, Stewart R, Jenkins R, Bhugra DK, Furukawa TA. Эпидемиология хронической усталости, соматических заболеваний и симптомов распространенных психических расстройств: перекрестное исследование из второго британского национального исследования психиатрической заболеваемости. J Psychosom Res. 2008. 64: 357–62.
Артикул PubMed Google Scholar
- 24.
Ли Г, Се Ф, Ян С., Ху Х, Цзинь Б., Ван Дж, Ву Дж, Инь Д., Се В. Недостаточное здоровье: определение, критерии диагностики и потенциальная распространенность в центральном регионе Китая.BMC Public Health. 2013; 13.
- 25.
Эванс К., Данстан Р. Х., Роткирх Т., Робертс Т. К., Райхелт К. Л., Косфорд Р., Дид Дж., Эллис Э. Б., Спаркс Д.Л. Нарушение экскреции аминокислот у детей с аутизмом. Nutr Neurosci. 2008; 11: 9–17.
CAS Статья PubMed Google Scholar
- 26.
Чалдер Т., Береловиц Г., Павликовска Т., Уоттс Л., Уэссели С., Райт Д., Уоллес Е.П. Развитие шкалы утомляемости. J Psychosom Res.1993; 37: 147–53.
CAS Статья PubMed Google Scholar
- 27.
МакГрегор Н.Р., Данстан Р.Х., Зербес М., Батт Х.Л., Робертс Т.К., Клайнберг И.Дж. Предварительное определение связи между выражением симптомов и метаболитами в моче у субъектов с синдромом хронической усталости. Biochem Mol Med. 1996. 58: 85–92.
CAS Статья PubMed Google Scholar
- 28.
Данстан Р.Х., МакГрегор Н.Р., Батт Г.Л., Робертс Т.К. Биохимические и микробиологические аномалии при синдроме хронической усталости: разработка лабораторных тестов и возможная роль токсичных химикатов. J Nutr Environ Med. 1999; 9: 97–108.
CAS Статья Google Scholar
- 29.
Ричардс Р.С., Робертс Т.К., МакГрегор Н.Р., Данстан Р.Х., Батт Х.Л. Параметры крови, указывающие на окислительный стресс, связаны с выражением симптомов синдрома хронической усталости.Redox Rep. 2000; 5: 35–41.
CAS Статья PubMed Google Scholar
- 30.
Коды пищевых стандартов Австралии и Новой Зеландии [http://www.comlaw.gov.au/Search/Australia%20New%20Zealand%20Food%20Standards]. По состоянию на 13 июня 2013 г.
- 31.
Закон о пищевых продуктах 2003 г. № 43 [http://www.legislation.nsw.gov.au/viewtop/inforce/act+43+2003+FIRST+0+N/]. По состоянию на 13 июня 2013 г.
- 32.
Food Regulation 2010 [http: // www.законодательство.nsw.gov.au/viewtop/inforce/subordleg+250+2010+cd+0+N]. По состоянию на 13 июня 2013 г.
- 33.
Clemens RA, Kopple JD, Swendseid ME. Метаболические эффекты диет с дефицитом гистидина, скармливаемых растущим крысам через желудочный зонд. J Nutr. 1984; 114: 2138–46.
CAS PubMed Google Scholar
- 34.
Куперман Дж. М., Лопес Р. Роль гистидина при анемии дефицита фолиевой кислоты. Exp Biol Med. 2002; 227: 998–1000.
CAS Google Scholar
- 35.
Виру А., Виру А. Биохимический мониторинг спортивной тренировки. 1-е изд. Champaign: Human Kinetics Publishers; 2001.
Google Scholar
- 36.
Хараламби Г., Берг А. Изменения мочевины в сыворотке и аминного азота в зависимости от продолжительности упражнений. Eur J Phys Occup Physiol. 1976; 36: 39–48.
CAS Статья Google Scholar
- 37.
Hedges REM, Clement JG, Thomas DL, O’Connell TC.Обмен коллагена в средней части диафиза бедренной кости у взрослых: смоделировано на основе измерений антропогенных радиоуглеродных индикаторов. Am J Phys Anthropol. 2007. 133: 808–16.
Артикул PubMed Google Scholar
- 38.
Wang W, Wu Z, Dai Z, Yang Y, Wang J, Wu G. Метаболизм глицина у животных и людей: последствия для питания и здоровья. Аминокислоты. 2013; 45: 463–77.
Артикул PubMed Google Scholar
- 39.
Кори JG. Метаболизм пуриновых и пиримидиновых нуклеотидов. В: Devlin TM, редактор. Учебник биохимии с клиническими корреляциями. 3-е изд. Нью-Йорк: Вили-Лисс; 1992. стр. 529–73.
Google Scholar
- 40.
Fessas PH, Koniavitis A, Zeis A. Экскреция бета-аминоизомасляной кислоты с мочой при талассемии. J Clin Pathol. 1969; 22: 154–7.
CAS Статья PubMed PubMed Central Google Scholar
- 41.
Энхьяргал Т., Цереннадмид С. Выведение с мочой бета-аминоизомасляной кислоты при гематологических заболеваниях (аннотация). Риншо Бёри Jpn J Clin Pathol. 2004; 52: 17–21.
CAS Google Scholar
- 42.
Мацумото AM. Андропауза: клинические последствия снижения уровня тестостерона в сыворотке с возрастом у мужчин. J Gerontol. 2002; 57A: M76–99.
CAS Статья Google Scholar
- 43.
Новак А., Брод М., Эльберс Дж. Андропауза и качество жизни: результаты фокус-групп пациентов и клинических экспертов. Maturitas. 2002; 43: 231–7.
CAS Статья PubMed Google Scholar
- 44.
Бейн Дж. Заместительная терапия тестостероном для пожилых мужчин. Может Фам Врач. 2001; 47: 91–7.
CAS PubMed PubMed Central Google Scholar
- 45.
Ногейра Аде С., Вале Р.Г., Гомеш А.Л., Дантас Э.Влияние мышечных воздействий на уровень повреждения соединительной ткани. Res Sports Med. 2011; 19: 259–70.
PubMed Google Scholar
- 46.
Prockop DJ, Sioerdsma D. Значение гидроксипролина в моче у человека. Clin Invest. 1961; 40: 843–9.
CAS Статья Google Scholar
- 47.
Кьяер М., Хансен М. Тайна женской соединительной ткани. J Appl Physiol.2008; 105: 1026–7.
Артикул PubMed Google Scholar
- 48.
Джейсон Л.А., Ричман Дж. А., Радемейкер А. В., Джордан К. М., Плиоплис А. В., Тейлор Р. Р., Маккриди В., Хуанг С. Ф., Плиоплис С. Исследование синдрома хронической усталости на уровне сообщества. Arch Intern Med. 1999; 159: 2129–37.
CAS Статья PubMed Google Scholar
- 49.
Уэссели С. Эпидемиология синдрома хронической усталости.Epidemiologic Rev.1995; 17: 139–51.
CAS Статья Google Scholar
- 50.
Будес П. Комплаенс в терапевтических испытаниях: обзор. Контрольные клинические испытания. 1998. 19: 257–68.
CAS Статья PubMed Google Scholar
- 51.
Селла М., Чалдер Т. Измерение утомляемости в клинических условиях и в общественных местах. J Psychosom Res.





Добавить комментарий