Аминокислоты — Википедия. Что такое Аминокислоты
Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). [1] Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
История
Большинство из около 500 известных аминокислот были открыты после 1953 года, например во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречается в природе в свободном виде, а остальные только как промежуточные элементы обмена веществ.
Открытие аминокислот в составе белков
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен[2] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[de] |
| Глутамин | Gln, Q | |||
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен [en] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шелка | А. Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель[3], С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и др. |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и др. |
Жирным шрифтом выделены незаменимые аминокислоты
Физические свойства
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Общие химические свойства
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
- NH2 —CH2COOH
 N+H3 —CH2COO—
N+H3 —CH2COO—
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой
аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
D-Аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[4], что может быть использовано для определения возраста млекопитающих. Рацемизация аспартата также отмечена при старении коллагена; предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутримолекулярном ацилировании атома азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты [5].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов.[6] Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих[7].
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.[8]
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путём нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O).[9][10] Это так называемые 21-я и 22-я аминокислоты.[11]
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым[12]. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
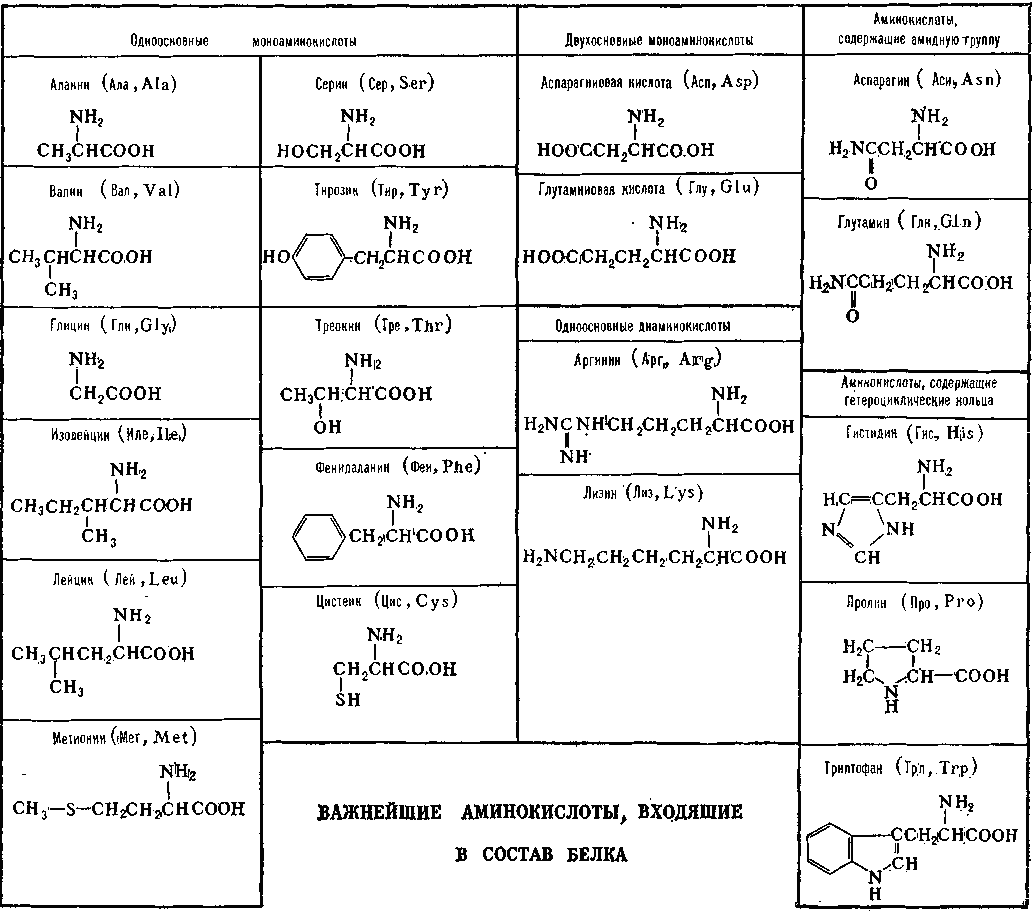
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Классификация
| Аминокислота | 3-буквы[13] | 1-буква[13] | аминокислот | мнемоническое правило[14] | Полярность[15] | радикалу | Mr | Vw (Å3) | pI | шкала гидрофобности[16] | частота в белках (%)[17] |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75.067 | 48 | 6.06 | −0.4 | 7.03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89.094 | 67 | 6.01 | 1.8 | 8.76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117.148 | 105 | 6.00 | 4.2 | 6.73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131.175 | 124 | 6.05 | 4.5 | 5.49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131.175 | 124 | 6.01 | 3.8 | 9.68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6.30 | −1.6 | 5.02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105.093 | 73 | 5.68 | −0.8 | 7.14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119.119 | 93 | 5.60 | −0.7 | 5.53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Неполярные | Серосодержащие | 121.154 | 86 | 5.05 | 2.5 | 1.38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149.208 | 124 | 5.74 | 1.9 | 2.32 |
| Аспарагиновая кислота | Asp | D | GAU, GAC | asparDic acid | Полярные заряженные отрицательно | заряженные отрицательно | 133.104 | 91 | 2.85 | −3.5 | 5.49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132.119 | 96 | 5.41 | −3.5 | 3.93 |
| Глутаминовая кислота | Glu | E | GAA, GAG | gluEtamic acid | Полярные заряженные отрицательно | заряженные отрицательно | 147.131 | 109 | 3.15 | −3.5 | 6.32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146.146 | 114 | 5.65 | −3.5 | 3.9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146.189 | 135 | 9.60 | −3.9 | 5.19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10.76 | −4.5 | 5.78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные заряженные положительно | Гетероциклические | 155.156 | 118 | 7.60 | −3.2 | 2.26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165.192 | 135 | 5.49 | 2.8 | 3.87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181.191 | 141 | 5.64 | −1.3 | 2.91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические, Гетероциклические | 204.228 | 163 | 5.89 | −0.9 | 6.73 |
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
- Ароматические: фенилаланин, триптофан, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[15]
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан,
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
Аминокислоты:
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.[18]
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты.[19]
См. также
Примечания
- ↑ 1 2 (November 1983) «New Naturally Occurring Amino Acids». Angewandte Chemie International Edition in English 22 (11): 816–28. DOI:10.1002/anie.198308161.
- ↑ Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
- ↑ Карпов В. Л. От чего зависит судьба гена // Природа. — 2005. — № 3. — С. 34—43.
- ↑ Helfman, P M; J L Bada (1975). «Aspartic acid racemization in tooth enamel from living humans». Proceedings of the National Academy of Sciences 72 (8): 2891 -2894. Проверено 2011-09-05.
- ↑ CLOOS P; FLEDELIUS C. Collagen fragments in urine derived from bone resorption are highly racemized and isomerized: a biological clock of protein aging with clinical potential (1 февраля 2000). Проверено 5 сентября 2011. Архивировано 2 февраля 2012 года.
- ↑ J. van Heijenoort. Formation of the glycan chains in the synthesis of bacterial peptidoglycan // Glycobiology. — 2001-3. — Т. 11, вып. 3. — С. 25R–36R. — ISSN 0959-6658.
- ↑ Herman Wolosker, Elena Dumin, Livia Balan, Veronika N. Foltyn. D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration // The FEBS journal. — 2008-7. — Т. 275, вып. 14. — С. 3514–3526. — ISSN 1742-464X. — DOI:10.1111/j.1742-4658.2008.06515.x.
- ↑ H. Brötz, M. Josten, I. Wiedemann, U. Schneider, F. Götz. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics // Molecular Microbiology. — 1998-10. — Т. 30, вып. 2. — С. 317–327. — ISSN 0950-382X.
- ↑ Linda Johansson, Guro Gafvelin, Elias S.J. Arnér. Selenocysteine in proteins—properties and biotechnological use // Biochimica et Biophysica Acta (BBA) — General Subjects. — 2005-10. — Т. 1726, вып. 1. — С. 1–13. — ISSN 0304-4165. — DOI:10.1016/j.bbagen.2005.05.010.
- ↑ Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706–712. — ISSN 1369-5274. — DOI:10.1016/j.mib.2005.10.009.
- ↑ Alexandre Ambrogelly, Sotiria Palioura, Dieter Söll. Natural expansion of the genetic code // Nature Chemical Biology. — 2007-1. — Т. 3, вып. 1. — С. 29–35. — ISSN 1552-4450. — DOI:10.1038/nchembio847.
- ↑ Andrei S. Rodin, Eörs Szathmáry, Sergei N. Rodin. On origin of genetic code and tRNA before translation // Biology Direct. — 2011-02-22. — Т. 6. — С. 14. — ISSN 1745-6150. — DOI:10.1186/1745-6150-6-14.
- ↑ 1 2 Cooper, Geoffrey M. The cell : a molecular approach. — 3rd ed. — Washington, D.C.: ASM Press, 2004. — xx, 713 pages с. — ISBN 0878932143, 9780878932146, 0878930760, 9780878930760.
- ↑ Р. Б. Соловьев, учитель биологии. Несколько мнемонических правил
- ↑ 1 2 Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп.. — М.: Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- ↑ J. Kyte, R. F. Doolittle. A simple method for displaying the hydropathic character of a protein // Journal of Molecular Biology. — 1982-05-05. — Т. 157, вып. 1. — С. 105–132. — ISSN 0022-2836.
- ↑ Lukasz P. Kozlowski. Proteome-pI: proteome isoelectric point database // Nucleic Acids Research. — 2017-01-04. — Т. 45, вып. D1. — С. D1112–D1116. — ISSN 1362-4962. — DOI:10.1093/nar/gkw978.
- ↑ Fumio Sanda, Takeshi Endo. Syntheses and functions of polymers based on amino acids (англ.) // Macromolecular Chemistry and Physics. — Vol. 200, iss. 12. — ISSN 1521-3935. — DOI:10.1002/(sici)1521-3935(19991201)200:12%3C2651::aid-macp2651%3E3.0.co;2-p.
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
Литература
- Эксперименты Миллера-Юри и обсуждения:
- Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
- Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
- Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с.
- Аминокислоты, пептиды, белки. Под ред. Ю. В. Митина
Ссылки
Аминокислоты — Википедия
Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). [1] Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
История
Большинство из около 500 известных аминокислот были открыты после 1953 года, например во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречается в природе в свободном виде, а остальные только как промежуточные элементы обмена веществ.[1]
Открытие аминокислот в составе белков
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен[2] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[de] |
| Глутамин | Gln, Q | |||
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен[en] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шелка | А. Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель[3], С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и др. |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и др. |
Жирным шрифтом выделены незаменимые аминокислоты
Физические свойства
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Общие химические свойства
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
- NH2 —CH2COOH N+H3 —CH2COO—
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3→ NH2 —CH2COOH + NH4Cl
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
D-Аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[4], что может быть использовано для определения возраста млекопитающих. Рацемизация аспартата также отмечена при старении коллагена; предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутримолекулярном ацилировании атома азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты[5].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов.[6] Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих[7].
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.[8]
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путём нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O).[9][10] Это так называемые 21-я и 22-я аминокислоты.[11]
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым[12]. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Классификация
| Аминокислота | 3-буквы[13] | 1-буква[13] | аминокислот | мнемоническое правило[14] | Полярность[15] | радикалу | Mr | Vw (Å3) | pI | шкала гидрофобности[16] | частота в белках (%)[17] |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75.067 | 48 | 6.06 | −0.4 | 7.03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89.094 | 67 | 6.01 | 1.8 | 8.76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117.148 | 105 | 6.00 | 4.2 | 6.73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131.175 | 124 | 6.05 | 4.5 | 5.49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131.175 | 124 | 6.01 | 3.8 | 9.68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6.30 | −1.6 | 5.02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105.093 | 73 | 5.68 | −0.8 | 7.14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119.119 | 93 | 5.60 | −0.7 | 5.53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Неполярные | Серосодержащие | 121.154 | 86 | 5.05 | 2.5 | 1.38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149.208 | 124 | 5.74 | 1.9 | 2.32 |
| Аспарагиновая кислота | Asp | D | GAU, GAC | asparDic acid | Полярные заряженные отрицательно | заряженные отрицательно | 133.104 | 91 | 2.85 | −3.5 | 5.49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132.119 | 96 | 5.41 | −3.5 | 3.93 |
| Глутаминовая кислота | Glu | E | GAA, GAG | gluEtamic acid | Полярные заряженные отрицательно | заряженные отрицательно | 147.131 | 109 | 3.15 | −3.5 | 6.32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146.146 | 114 | 5.65 | −3.5 | 3.9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146.189 | 135 | 9.60 | −3.9 | 5.19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10.76 | −4.5 | 5.78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные заряженные положительно | Гетероциклические | 155.156 | 118 | 7.60 | −3.2 | 2.26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165.192 | 135 | 5.49 | 2.8 | 3.87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181.191 | 141 | 5.64 | −1.3 | 2.91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические, Гетероциклические | 204.228 | 163 | 5.89 | −0.9 | 6.73 |
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
- Ароматические: фенилаланин, триптофан, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[15]
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан,
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
Аминокислоты:
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.[18]
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты.[19]
См. также
Примечания
- ↑ 1 2 (November 1983) «New Naturally Occurring Amino Acids». Angewandte Chemie International Edition in English 22 (11): 816–28. DOI:10.1002/anie.198308161.
- ↑ Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
- ↑ Карпов В. Л. От чего зависит судьба гена // Природа. — 2005. — № 3. — С. 34—43.
- ↑ Helfman, P M; J L Bada (1975). «Aspartic acid racemization in tooth enamel from living humans». Proceedings of the National Academy of Sciences 72 (8): 2891 -2894. Проверено 2011-09-05.
- ↑ CLOOS P; FLEDELIUS C. Collagen fragments in urine derived from bone resorption are highly racemized and isomerized: a biological clock of protein aging with clinical potential (1 февраля 2000). Проверено 5 сентября 2011. Архивировано 2 февраля 2012 года.
- ↑ J. van Heijenoort. Formation of the glycan chains in the synthesis of bacterial peptidoglycan // Glycobiology. — 2001-3. — Т. 11, вып. 3. — С. 25R–36R. — ISSN 0959-6658.
- ↑ Herman Wolosker, Elena Dumin, Livia Balan, Veronika N. Foltyn. D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration // The FEBS journal. — 2008-7. — Т. 275, вып. 14. — С. 3514–3526. — ISSN 1742-464X. — DOI:10.1111/j.1742-4658.2008.06515.x.
- ↑ H. Brötz, M. Josten, I. Wiedemann, U. Schneider, F. Götz. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics // Molecular Microbiology. — 1998-10. — Т. 30, вып. 2. — С. 317–327. — ISSN 0950-382X.
- ↑ Linda Johansson, Guro Gafvelin, Elias S.J. Arnér. Selenocysteine in proteins—properties and biotechnological use // Biochimica et Biophysica Acta (BBA) — General Subjects. — 2005-10. — Т. 1726, вып. 1. — С. 1–13. — ISSN 0304-4165. — DOI:10.1016/j.bbagen.2005.05.010.
- ↑ Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706–712. — ISSN 1369-5274. — DOI:10.1016/j.mib.2005.10.009.
- ↑ Alexandre Ambrogelly, Sotiria Palioura, Dieter Söll. Natural expansion of the genetic code // Nature Chemical Biology. — 2007-1. — Т. 3, вып. 1. — С. 29–35. — ISSN 1552-4450. — DOI:10.1038/nchembio847.
- ↑ Andrei S. Rodin, Eörs Szathmáry, Sergei N. Rodin. On origin of genetic code and tRNA before translation // Biology Direct. — 2011-02-22. — Т. 6. — С. 14. — ISSN 1745-6150. — DOI:10.1186/1745-6150-6-14.
- ↑ 1 2 Cooper, Geoffrey M. The cell : a molecular approach. — 3rd ed. — Washington, D.C.: ASM Press, 2004. — xx, 713 pages с. — ISBN 0878932143, 9780878932146, 0878930760, 9780878930760.
- ↑ Р. Б. Соловьев, учитель биологии. Несколько мнемонических правил
- ↑ 1 2 Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп.. — М.: Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- ↑ J. Kyte, R. F. Doolittle. A simple method for displaying the hydropathic character of a protein // Journal of Molecular Biology. — 1982-05-05. — Т. 157, вып. 1. — С. 105–132. — ISSN 0022-2836.
- ↑ Lukasz P. Kozlowski. Proteome-pI: proteome isoelectric point database // Nucleic Acids Research. — 2017-01-04. — Т. 45, вып. D1. — С. D1112–D1116. — ISSN 1362-4962. — DOI:10.1093/nar/gkw978.
- ↑ Fumio Sanda, Takeshi Endo. Syntheses and functions of polymers based on amino acids (англ.) // Macromolecular Chemistry and Physics. — Vol. 200, iss. 12. — ISSN 1521-3935. — DOI:10.1002/(sici)1521-3935(19991201)200:12%3C2651::aid-macp2651%3E3.0.co;2-p.
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
Литература
- Эксперименты Миллера-Юри и обсуждения:
- Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
- Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
- Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с.
- Аминокислоты, пептиды, белки. Под ред. Ю. В. Митина
Ссылки
АМИНОКИСЛОТА — это… Что такое АМИНОКИСЛОТА?
аминокислота — аминокислота … Орфографический словарь-справочник
аминокислота — цистин, цитруллин, пролин, глутамин, тирозин, треонин, аргинин, метионин, цистеин, гистидин, фенилаланин, триптофан, аспарагин, изолейцин, серин, орнитин, глицин, гликокол, лейцин, лизин, валин, аланин Словарь русских синонимов. аминокислота сущ … Словарь синонимов
Аминокислота — ж. см. аминокислоты Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
аминокислота — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN amino acid … Справочник технического переводчика
аминокислота — amino acid аминокислота. Oрганическая (карбоновая) кислота, содержащая одну или несколько аминогрупп, в зависимости от положения аминогруппы в углеродной цепи различают α , β , γ аминокислоты и т.д.; А. являются мономерами белков, причем в их… … Молекулярная биология и генетика. Толковый словарь.
аминокислота — Amino Acid Аминокислота Органическое соединение, в молекуле которого одновременно содержатся карбоксильная и аминная группы; в 20 природных аминокислотах обе группы связаны с одним и тем же атомом C. Аминокислоты объединяются амидными… … Толковый англо-русский словарь по нанотехнологии. — М.
аминокислота — aminorūgštis statusas T sritis chemija formulė H₂NRCOOH atitikmenys: angl. amino acid rus. аминокислота … Chemijos terminų aiškinamasis žodynas
аминокислота — аминокислота, аминокислоты, аминокислоты, аминокислот, аминокислоте, аминокислотам, аминокислоту, аминокислоты, аминокислотой, аминокислотою, аминокислотами, аминокислоте, аминокислотах (Источник: «Полная акцентуированная парадигма по А. А.… … Формы слов
Аминокислота — … Википедия
аминокислота — Nh3 группасы булган органик кислоталарның берсе; аксым составындагы матдә … Татар теленең аңлатмалы сүзлеге
Что такое аминокислоты и для чего они нужны? :: SYL.ru
Большинство людей знает, что в организме человека есть аминокислоты. Они поддерживают наше здоровье и играют важную роль в функционировании организма в целом. Но что такое аминокислоты и какие именно являются жизненно необходимыми? Попробуем разобраться в этом вопросе подробнее.
Что такое аминокислоты?
Если говорить простыми словами, то подобные вещества представляют собой строительный материал, необходимый для синтеза тканевых белков, пептидных гормонов и других физиологических соединений. То есть аминокислоты и белки – вещи очень тесно связанные, так как именно без аминокислот образование белков невозможно. Кроме того, они выполняют и другие функции:
- Участвуют в работе головного мозга. Они могут играть роль нейромедиаторов – химических веществ, которые передают импульс с одной клетки на другую.
- Способствуют нормальной работе витаминов и минералов.
- Снабжают энергией ткани мышц.
Их функции
Самая основная функция – образование белков. Аминокислоты создают элемент, без которого нормальная жизнедеятельность невозможна. Эти вещества содержатся в продуктах (творог, мясо, яйца, рыба), но также присутствуют и в добавках. В зависимости от последовательности аминокислот белки могут иметь разные биологические свойства. Ведь они являются регуляторами процессов, протекающих в клетках.
Они также поддерживают азотистое равновесия – от этого также зависит нормальное функционирование человеческого организма. Отметим, что не все аминокислоты содержатся в продуктах или создаются нашим организмом. Есть и такие, которые можно получить только извне – их называют незаменимыми.
Основные группы
Всего в природе ученые смогли обнаружить 28 аминокислот (из них 19 заменимых и 9 незаменимых). Большинство растений и бактерий способны самостоятельно создавать нужные им вещества из существующих неорганических соединений. В теле человека также синтезируется большинство нужных аминокислот – их называют заменимыми. К ним относятся:
- Аргинин, апанин, глицин, серин, цистеин, таурин, аспарагин, глутамин, аспаригиновая кислота, тирозин, цитруллин, орнитин.
- Существуют также частично заменимые аминокислоты – гистидин и аргинин.
Все эти элементы могут использоваться организмом для производства белка. Как мы уже знаем, существуют и незаменимые аминокислоты. Они не могут создаваться организмом человека. Однако они также необходимы для его нормального функционирования. К ним относятся: изолейцин, метионин, лизин, валин, треонин, фенилаланин, триптофан, лейцин.
Они поступают в человеческий организм с пищей. Отметим, что процесс создания белков в организме идет постоянно. И если хотя бы одна незаменимая аминокислота отсутствует, то синтез на время приостанавливается. В результате недостатка белка рост организма приостанавливается. В результате этого масса тела падает, а обмен веществ нарушается. При острой недостаточности аминокислот организм может и погибнуть.

Незаменимые
Мы уже знаем, какие аминокислоты относятся к этой категории. Рассмотрим их подробнее:
- Валин – это один из самых важных компонентов, который восстанавливает разрушенные мышечные ткани организма и поддерживает обмен азота в теле. Благодаря ему уровень серотонина поддерживается на нормальном уровне. При этом мышечная координация повышается. Это основной компонент для построения новых мышц, и без него функционирование организма невозможно. Молекулы аминокислот находятся в таких продуктах, как куриное филе, яйца, говядина, грецкие орехи, лосось.
- Гистидин – еще один важный компонент, который также восстанавливает мышечные ткани. В отличие от валина, он присутствует в миелиновых оболочках, защищающих нервные клетки. Какие функции выполняет? Это вещество также защищает организм от действия радиации и выводит из него тяжелые металлы. Из гистидина синтезируется мышечный антиоксидант – карнозин. Для пополнения запаса этой аминокислоты рекомендуют употреблять в пищу тунца, чечевицу, арахис, куриное филе.

- Изолейцин – пожалуй, один из самых важных элементов. Он принимает участие в создании гемоглобина, а также благодаря ему у человека поддерживается нормальный уровень сахара в крови. Эта аминокислота укрепляет наружный слой кожи, нормализует процессы энергообеспечения и принимает участие в построении новых мышц. Содержится в сыре, курином филе, рыбе, индейке, яйцах.
- Лейцин – аминокислота, принимающая ключевое участие в укреплении и поддержке иммунной системы. Это вещество нормализует метаболические процессы, усиливает синтез белка, а также препятствует разрушению белковых молекул и распаду глюкозы, нормализует водный обмен и повышает секрецию инсулина в организме. Входит аминокислота в состав BCAA (материал для создания новых мышечных тканей). Она содержится в твороге, курином филе, говядине, то есть мясных и молочных продуктах.
- Лизин – материал для создания костных тканей, который также принимает участие в усвоении кальция. Это его основная роль. Но также лизин участвует в синтезе гормонов, антител, восстановлении тканей. Он хорошо влияет на работу сердца, усиливает сопротивляемость организма вирусам и снижает уровень триглицеридов, содержащихся в крови. Источниками этой аминокислоты является мясо птицы и говядины, а также горох и фасоль.

- Метионин – незаменимая аминокислота, участвующая в жировом обмене и влияющая на синтез других аминокислот – цистеина и таурина. Кроме этого ей приписывают следующие положительные эффекты: улучшение выносливости мышц, понижение уровня плохого холестерина, улучшение эффективности переработки пищи, улучшение работы печени, отвод тяжелых металлов из организма и защита от радиации. Как и ранее, лучшими источниками этого элемента является мясо курицы и индейки, телятина. Но также он присутствует в твороге, арахисе, бобовых культурах.
- Треонин – элемент для поддержки белкового метаболизма. Он принимает участие в образовании эластина и коллагена, не позволяет жирам откладываться в печени и оказывает хорошее воздействия на сердечно-сосудистую и нервную систему. Треонин содержится в уже знакомых нам продуктах: мясе, рыбе, молочных продуктах, орехах, бобовых.
- Триптофан – важная аминокислота, основная задача которой – создание серотонина. Подобный элемент называют «источником радости», он поднимает настроение и подавляет депрессию, может излечить человека от бессонницы. Также его присутствие в организме облегчает ПМС у женщин. Содержится в мясе, рыбе, сырах, бобовых, молочных продуктах.
- Фенилаланин – элемент, который улучшает память человека, снижает болевые ощущения и улучшает настроение, подавляет аппетит. Находится эта аминокислота в молекулах белков, которые составляют сухожилья, мышцы и связки. Лучшими источниками фенилаланина являются яйца, мяса, орехи, фасоль и другие бобовые культуры.
- Аланин – участвует в метаболизме, а также повышает сокращение мышц и является источником энергии для нервной системы. Благодаря аланину уровень сахара в крови стабилизируется, иммунная система работает лучше. Хорошими источниками этой аминокислоты является любое мясо, сыр и молоко.
Заменимые аминокислоты
Какие аминокислоты относятся к заменимым?
- Аргинин – обладает большим количеством положительных свойств, что делает этот элемент востребованным и ценным. Его положительные свойства: препятствует росту злокачественных образований, нормализует азотный баланс, улучшает эффективность процесса дезинтоксикации печени, способствует выработке сперматозоидов и инсулина, улучшает кровоток в мышечных тканях, повышает иммунитет. Источники: куриные яйца, свинина, семечки тыквы, грецкие и другие орехи.
- Аспарагин – способствует улучшению работы нервной системы, повышает иммунитет благодаря повышению антител и иммуноглобулинов. Среди продуктов лучшими источниками являются морепродукты, птица, бобовые, молоко.
- Цитруллин – важная для мышц и организма в целом аминокислота, укрепляющая иммунную систему, повышающая энергообеспечение. Она усиливает выносливость, улучшает эректильную функцию. Содержится в основном в арбузах, бобовых, арахисе.
- Цистеин – принимает участие в формировании тканей волос и кожи. Также формирует и поддерживает структуру пептидов и белков. Содержится в овсе, мясе, рыбе.
- Диметилглицин – входит в состав нейромедиаторов, определенных гормонов и ДНК. Содержится в мясе, бобовых, зернах, печени.

- Глютамин – позволяет нормально работать мышечным тканям, укрепляет иммунную систему, участвует в синтезе белка мышц, ускоряет процессы восстановления, нормализует уровень сахара и даже улучшает работу головного мозга. Содержится в мясе курицы, рыбе, молоке, капусте, петрушке.
- Глутатион – антиоксидант, положительно влияющий на жировой обмен и защищающий организм от токсинов, вирусов, болезней. Содержится в луке, чесноке, орехах, семечках, сельдерее, яичных желтках.
- Глицин – благодаря ему возможен синтез желчных и нуклеиновых кислот и заменимых аминокислот. Кроме этой основной функции есть и второстепенные: улучшение качества сна, восстановление поврежденных тканей, улучшение работы ЦНС, противовоспалительные действия. Набор продуктов, в которых содержится эта аминокислота, стандартен: молоко, мясо, яйца, рыба.
- Аминомасляная кислота (гамма) – важный элемент, являющийся нейромедиатором головного мозга и ЦНС. Обладает полезными свойствами, благодаря которым пользуется популярностью среди бодибилдеров: вырабатывает гормоны роста, улучшает процесс сжигания жиров, улучшает качество сна. Содержится в кофе, чае, грибах.
- Глутаминовая кислота – нейромедиатор, передающий импульсы в нервную систему. Хорошо влияет на углеводный обмен, является источником энергии для головного мозга. Содержится в любом мясе, горошке, молочных продуктах.
- Густамин – является нейротрансмиттером нервной системы, повышает половое влечение и проницаемость кровеносных сосудов.
- Орнитин – также способствует выработке гормонов роста, улучшает процесс сжигания жиров и хорошо влияет на печень. Из-за этого часто употребляется бодибилдерами. Содержится в мясе, яйцах, рыбе, молочных продуктах.
- Пролин – укрепляет суставы, связки, сердечно-сосудистую систему.
- Серин – улучшает работу иммунной системы, влияет на жировой обмен.
- Таурин – способствует нормализации натрия, магния, калия, хорошо влияет на головной мозг и обменные процессы организма.
- Тирозин – способствует выработке мелатонина, влияет на щитовидную железу, подавляет аппетит. Считается, что тирозин является творческой аминокислотой, поскольку позволяет думать масштабнее и открывает в человеке творческие способности. Содержится в миндале, бананах, семечках, кунжуте, авокадо.
- Карнитин – также относится к аминокислотам из-за схожей химической структуры. С его помощью жирные кислоты эффективно перерабатываются в энергию, он хорошо влияет на работу сердца и печени, повышает выносливость, замедляет старение, понижает уровень холестерина. Его большое содержание замечено в баранине, молочных продуктах, свинине, телятине, индейке.
Содержание в продуктах
Как вы уже поняли, есть основные категории продуктов, где содержится большое количество аминокислот: мясо (чаще всего мясо птиц), яйца, молочные продукты, бобовые и зелень. Однако почти в любых продуктах есть небольшое содержание тех или иных элементов. Поэтому крайне важно разнообразить свой рацион.
Применение аминокислот в медицине
 Учитывая, что такое аминокислоты и какова их роль, очень важно, чтобы в организме их было в достаточном количестве. Людям, которые страдают недостатком этих элементов, назначают специальные диеты и препараты, содержащие в себе конкретные аминокислоты. Помните о том, что прием медицинских препаратов возможен только с назначением врача:
Учитывая, что такое аминокислоты и какова их роль, очень важно, чтобы в организме их было в достаточном количестве. Людям, которые страдают недостатком этих элементов, назначают специальные диеты и препараты, содержащие в себе конкретные аминокислоты. Помните о том, что прием медицинских препаратов возможен только с назначением врача:- Лейцин содержится в различных БАДах, препаратах для лечения печени и анемии. Он также используется как усилитель вкуса Е641.
- Фенилалинин применяется для лечения болезни Паркинсона, используется в производстве жевательной резинки и напитков с газами.
- Лизин – средство обогащения продуктов питания и кормов животных.
- Триптофан назначается при чувстве страха, депрессии, сильных физических нагрузках.
- Изолейцин используется для лечения неврозов, его назначают при стрессах, слабости. Также многие антибиотики содержат в своем составе этот элемент.
- Гистидин всегда есть в составе препаратов для лечения язв, артритов. Также он содержится во всевозможных витаминных комплексах.
Назначение
Специальные добавки, содержащие большое количество аминокислот, могут назначать мужчинам и женщинам, которые часто подвергаются физическим нагрузкам. Спортсмены, занимающиеся бодибилдингом, спринтом, разным единоборствам и фитнесом, чаще всего употребляют специальные добавки на основе аминокислот. Но также и людям с разными заболеваниям назначают либо специальные диеты, либо препараты с содержанием необходимых аминокислот.
Необходимость
Теперь вы знаете, что такое аминокислоты, и понимаете их основные функции. Мы назвали все известные на данный момент элементы, которые принимают участие в синтезе белков. Можно сказать, что все белки состоят из аминокислот разного типа. Они необходимы для нормального функционирования организма. Сочетание и последовательность указанных выше аминокислот образуют новые элементы в организме. Например, цитозин, гуанин, тимин и аденин принимают участие в создании дезоксирибонуклеиновой кислоты – ДНК. Аминокислоты – ключевые элементы, без которых образование белка невозможно.
Заключение
Эти элементы есть в любом человеческом организме, и если их количество недостаточно, то у человека наблюдаются проблемы со здоровьем. Белки, аминокислоты, нуклеотиды – это те соединения, которые жизненно необходимы. Их запасы в организме постоянно нужно пополнять. Поэтому важно следить за своим рационом и употреблять пищу, которая содержит различные аминокислоты.
АМИНОКИСЛОТЫ — это… Что такое АМИНОКИСЛОТЫ?
АМИНОКИСЛОТЫорганические (карбоновые) кислоты, содержащие, как правило, одну или две аминогруппы (— Nh3). В зависимости от положения аминогруппы в углеродной цепи по отношению к карбоксилу различают а-, b-, y-и т. д. А. в природе широко распространены a -А., имеющие (кроме глипина) один или два асимметрических атома углерода и, в основном, L-конфигурацию. В построении молекул белка участвуют обычно ок. 20 L= a —А. (пролин — a -аминокислота). Специфич. последовательность чередования А. в пептидных цепях, определяемая генетическим кодом, обусловливает первичную структуру белка. Высшие растения и хемосинтезирующие организмы все необходимые им А. синтезируют из аммонийных солей и нитратов (в растит, клетке они восстанавливаются до NН3) и кето- или оксикислот — продуктов дыхания и фотосинтеза. Человек и животные синтезируют большинство г. н. заменимых А. из обычных безазотистых продуктов обмена и аммонийного азота; незаменимые аминокислоты должны поступать с пищей. Занимают центр, место в обмене азотистых веществ (входят в состав белков, пептидов, участвуют в биосинтезе пуринов, пиримидинов, витаминов, медиаторов, алкалоидов и др. соединений). В организме окислит, распад А. путём дезаминирования (особенно интенсивно идёт в почках и печени) гл. обр. глутаминовой к-ты, образовавшейся путём пере-аминирования, приводит к образованию кето- и оксикислот — промежуточных продуктов цикла трикарбоновых к-т. Далее они превращаются в углеводы, новые А. и т. п. или окисляются до СО2 и Н2О с выделением энергии. При этом азот в виде аммонийных солей, мочевины и мочевой к-ты выводится из организма. У растений связанный азот используется более полно и азотистые отходы практически отсутствуют. В тканях живых организмов встречаются А. (св. 100), не входящие в состав белков. Среди них важные промежуточные продукты обмена веществ (орнитин, цистатионин и др.), а также редкие А., биол. функции к-рых неясны. В микробиол. пром-сти используют способность мутантных штаммов нек-рых микроорганизмов продуцировать отд. А. (глутамииовую к-ту, лизин и др.). А., а также их смеси, применяют в медицине, животноводстве (для обогащения кормов), как исходные продукты для пром. синтеза полиамидов, красителей. Мн. А. получены абиогенным путём в условиях, моделирующих атмосферу первобытной Земли.
.(Источник: «Биологический энциклопедический словарь.» Гл. ред. М. С. Гиляров; Редкол.: А. А. Бабаев, Г. Г. Винберг, Г. А. Заварзин и др. — 2-е изд., исправл. — М.: Сов. Энциклопедия, 1986.)
аминокисло́ты низкомолекулярные органические соединения, содержащие одну или две карбоксильные группы (—СООН) и одну или две аминогруппы (—NH2). Аминокислоты широко представлены в клетках и тканях живых организмов. Общая формула важнейших природных аминокислот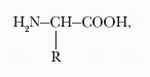
где радикал R может быть водородом (как в случае простейшей аминокислоты глицина), метильной группой – СН3 (как у аланина) или обладать более сложным строением.
Поскольку аминокислоты амфотерны, т.е. обладают свойствами и кислот, и оснований, они вступают в реакции друг с другом. Атом углерода карбоксильной группы одной аминокислоты соединяется с атомом азота аминогруппы другой с образованием т.н. пептидной связи, при этом отщепляется вода.
Если соединяются две аминокислоты, образуется дипептид, если три – трипептид, если 20 и более аминокислот – полипептид (см. Пептиды). В живых организмах встречается ок. 150 аминокислот, но только 20 из них участвуют в построении полипептидных цепей белков – трансляции. Последовательность аминокислот в синтезирующейся полипептидной цепи определяется генетическим кодом.
Из 20 необходимых для построения белков аминокислот в организме животных и человека синтезируются из более простых веществ лишь т.н. заменимые аминокислоты. Остальные – незаменимые аминокислоты – должны поступать с пищей. У разных животных набор незаменимых аминокислот различен. Для человека это 8 аминокислот – валин, лейцин, лизин, метионин и др. Отсутствие или недостаток одной или нескольких незаменимых аминокислот в организме человека приводит к нарушениям обмена веществ и различным заболеваниям. Растения и хемосинтезирующие микроорганизмы сами синтезируют все необходимые аминокислоты.
Помимо построения белков аминокислоты (в т.ч. не входящие в белки) служат исходными веществами при синтезе в клетках витаминов, азотистых оснований, медиаторов и других биологически активных соединений.
Аминокислоты используются в медицине, в качестве пищевых добавок, для обогащения кормов и для других целей. В промышленных масштабах их получают путём микробиологического синтеза (см. Биотехнология).
При изучении возможных путей возникновения жизни ряд аминокислот был получен при пропускании электрических разрядов через смесь газов, воссоздающих первичную атмосферу Земли. Таким образом была показана возможность абиогенного (без участия организмов) синтеза важнейших органических соединений.
.(Источник: «Биология. Современная иллюстрированная энциклопедия.» Гл. ред. А. П. Горкин; М.: Росмэн, 2006.)
.
Аминокислоты — номенклатура, получение, химические свойства. Белки » HimEge.ru
Строение аминокислот
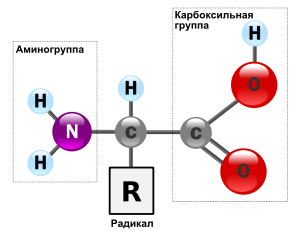
Аминокислоты — гетерофункциональные соединения, которые обязательно содержат две функциональные группы: аминогруппу — NH2 и карбоксильную группу —СООН, связанные с углеводородным радикалом.Общую формулу простейших аминокислот можно записать так:
Так как аминокислоты содержат две различные функциональные группы, которые оказывают влияние друг на друга, характерные реакции отличаются от характерных реакций карбоновых кислот и аминов.
Свойства аминокислот
Аминогруппа — NH2 определяет основные свойства аминокислот, т. к. способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота.
Группа —СООН (карбоксильная группа) определяет кислотные свойства этих соединений. Следовательно, аминокислоты — это амфотерные органические соединения. Со щелочами они реагируют как кислоты:
С сильными кислотами- как основания-амины:
Кроме того, аминогруппа в аминокислоте вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль:
Ионизация молекул аминокислот зависит от кислотного или щелочного характера среды:
Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше 200 °С. Они растворимы в воде и нерастворимы в эфире. В зависимости от радикала R— они могут быть сладкими, горькими или безвкусными.
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические. Среди природных аминокислот (около 150) выделяют протеиногенные аминокислоты (около 20), которые входят в состав белков. Они представляют собой L-формы. Примерно половина из этих аминокислот относятся к незаменимым, т. к. они не синтезируются в организме человека. Незаменимыми являются такие кислоты, как валин, лейцин, изолейцин, фенилаланин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей. Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются. При отдельных заболеваниях организм не в состоянии синтезировать и некоторые другие аминокислоты. Так, при фенилкетонурии не синтезируется тирозин. Важнейшим свойством аминокислот является способность вступать в молекулярную конденсацию с выделением воды и образованием амидной группировки —NH—СО—, например:
Получаемые в результате такой реакции высокомолекулярные соединения содержат большое число амидных фрагментов и поэтому получили название полимамидов.
К ним, кроме названного выше синтетического волокна капрона, относят, например, и энант, образующийся при поликонденсации аминоэнантовой кислоты. Для получения синтетических волокон пригодны аминокислоты с расположением амино- и карбоксильной групп на концах молекул.
Полиамиды альфа-аминокислот называются пептидами. В зависимости от числа остатков аминокислот различают дипептиды, трипептиды, полипептиды. В таких соединениях группы —NH—СО— называют пептидными.
Изомерия и номенклатура аминокислот
Изомерия аминокислот определяется различным строением углеродной цепи и положением аминогруппы, например:
Широко распространены также названия аминокислот, в которых положение аминогруппы обозначается буквами греческого алфавита: α, β, у и т. д. Так, 2-аминобутановую кислоту можно назвать также α-аминокислотой:
Способы получения аминокислот
В биосинтезе белка в живых организмах участвуют 20 аминокислот.
Более подробно про белки.
Глутаминовая кислота — Википедия
| Глутаминовая кислота | |||
|---|---|---|---|
 ( ({{{картинка2}}}) | |||
| Систематическое наименование | 2-Аминопентандиовая кислота | ||
| Сокращения | «глутамат», «Глу», «Glu», «E» | ||
| Традиционные названия | Аминоглутаровая кислота, глутаминовая кислота, глутамат | ||
| Хим. формула | C5H9NO4 | ||
| Рац. формула | C 40,82 %, H 6,17 %, N 9,52 %, O 43,5 % | ||
| Состояние | белый кристаллический порошок | ||
| Молярная масса | 147,1293 ± 0,006 г/моль | ||
| Плотность | 1,4601 1,538 (25° С) | ||
| Температура | |||
| • плавления | 160 °C | ||
| • кипения | 205 °C | ||
| • разложения | свыше 205 °C | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 2,16, 4,15, 9,58 | ||
| Растворимость | |||
| • в воде | 7.5 г/л[1] | ||
| Изоэлектрическая точка | 3,22 | ||
| Рег. номер CAS | 56-86-0 | ||
| PubChem | 611 | ||
| Рег. номер EINECS | 200-293-7 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E620 | ||
| ChEBI | 18237 | ||
| ChemSpider | 591 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Глутами́новая кислота́ (2-аминопентандио́вая кислота) — органическое соединение, алифатическая двухосновная аминокислота, входящая в состав белков всех известных живых организмов.
В биохимической литературе вместо громоздкого полного названия часто используют более компактные конвенциональные обозначения: «глутамат», «Glu», «Глу» или «E». Вне научной литературы термин «глутамат» также часто употребляется для обозначения широко распространённой пищевой добавки глутамата натрия.
В живых организмах остаток молекулы глутаминовой кислоты входит в состав белков, полипептидов, в некоторые низкомолекулярные вещества и присутствует в свободном виде. При биосинтезе белка включение остатка глутаминовой кислоты кодируется кодонами GAA и GAG.
Глутаминовая кислота играет важную роль в метаболизме азотсодержащих биохимических веществ[источник не указан 219 дней]. Она также является нейромедиаторной аминокислотой, одной из важных представителей класса «возбуждающих аминокислот»[2].
Связывание глутаминовой кислоты со специфическими рецепторами нейронов приводит к их возбуждению[источник не указан 219 дней].
Глутаминовая кислота относится к группе заменимых аминокислот, в человеческом организме cинтезируется.
Соли и сложные эфиры глутаминовой кислоты называются глутаматы.
Впервые глутаминовую кислоту получил в чистом виде в 1866 г. немецкий химик Карл Генрих Риттгаузен при обработке клейковины пшеничной муки серной кислотой[3], описал её свойства и дал ей название, от латинского слова «gluten» — «клейковина» + «амин».
Глутаминовая кислота при нормальных условиях представляет собой белое кристаллическое вещество, плохо растворимое в воде, этаноле, нерастворимое в ацетоне и диэтиловом эфире.▼ Чрезмерное потребление глутамата в эксперименте на крысах приводило к подавлению синтеза белка и резкому снижению его концентрации в сыворотке крови.
Глутамат натрия — натриевая соль глутаминовой кислоты — наиболее важный возбуждающий нейротрансмиттер в биохимических процессах в нервной системе позвоночных[4]. В химических синапсах глутамат запасается в пресинаптических пузырьках (везикулах). Нервный импульс активирует высвобождение иона глутаминовой кислоты из пресинаптического нейрона.
На постсинаптическом нейроне ион глутаминовой кислоты связывается с постсинаптическими рецепторами, такими, как, например, NMDA-рецепторы, и активирует их. Благодаря участию последних в синаптической пластичности ион глутаминовой кислоты участвует в таких функциях высшей нервной деятельности как обучение и память[5].
Одна из форм приспособляемости синапсов, называемая долговременной потенциацией, имеет место в глутаматергических синапсах гиппокампа, неокортекса и в других частях головного мозга человека.
Глутамат натрия участвует не только в классическом проведении нервного импульса от нейрона к нейрону, но и в объёмной нейротрансмиссии, когда сигнал передаётся в соседние синапсы путём кумулятивного эффекта глутамата натрия, высвобожденного в соседних синапсах (так называемая экстрасинаптическая или объёмная нейротрансмиссия)[6] В дополнение к этому, глутамат играет важную роль в регуляции конусов роста и синаптогенеза в процессе развития головного мозга, как это было описано Марком Мэтсоном[где?].
Транспортёры[7] глутамата натрия обнаружены на нейрональных[прояснить] мембранах и мембранах нейроглии. Они быстро удаляют[прояснить] глутамат из внеклеточного пространства. При повреждении мозга или заболеваниях они могут работать в противоположном[прояснить] направлении, вследствие чего глутамат натрия может накапливаться в межклеточном пространстве. Этот накопление приводит к поступлению большого количества ионов кальция в клетку через каналы NMDA-рецепторов, что, в свою очередь, вызывает повреждение и даже гибель клетки — это явление получило название эксайтотоксичности. Пути гибели клеток при этом включают:
- повреждение митохондрий избыточно высокой концентрацией внутриклеточных ионов кальция,
- Glu/Ca2+-опосредованной промоцией[прояснить] факторов транскрипции проапоптотических[прояснить] генов или снижением транскрипции анти-апоптотических генов. Эксайтотоксичность[прояснить], обусловленная повышенным высвобождением глутамата или его сниженным обратным захватом, возникает при ишемическом каскаде[прояснить][8] и ассоциирована с инсультом, а также наблюдается при таких заболеваниях, как боковой амиотрофический склероз, латиризм, аутизм, некоторые формы умственной отсталости, болезнь Альцгеймера[9].[10] В противоположность этому, снижение высвобождения глутамата наблюдается при классической фенилкетонурии, приводящей к нарушению экспрессии[прояснить] глутаматных рецепторов[11]
Глутаминовая кислота участвует биохимии эпилептического припадка. Естественная диффузия глутаминовой кислоты в нейроны вызывает спонтанную деполяризацию[прояснить], и этот паттерн[прояснить] напоминает пароксизмальную деполяризацию[прояснить][12] во время судорог. Эти изменения в эпилептическом очаге[прояснить] приводят к открытию вольтаж-зависимых[прояснить][13] кальциевых каналов, что снова стимулирует выброс глутамата и дальнейшую деполяризацию.
Роли глутаматной системы[прояснить] в настоящее время отводится большое место в патогенезе таких психических расстройств, как шизофрения и депрессия. Одной из наиболее активно изучаемых теорий этиопатогенеза шизофрении в настоящее время является гипотеза снижение функции NMDA-рецепторов: при применении антагонистов NMDA-рецепторов, таких, как фенциклидин, у здоровых добровольцев в эксперименте появляются симптомы шизофрении. В связи с этим предполагается, что снижение функции NMDA-рецепторов является одной из причин нарушений в дофаминергической[прояснить] передаче у больных шизофренией. Были также получены данные о том, что поражение NMDA-рецепторов иммунно-воспалительным механизмом («антиNMDA-рецепторный энцефалит») имеет наблюдается как острая шизофрения[источник не указан 478 дней].
Глутаматные рецепторы[править | править код]
Существуют ионотропные и метаботропные (mGLuR1-8) глутаматные рецепторы.
Ионотропными рецепторами являются NMDA-рецепторы, AMPA-рецепторы и каинатные рецепторы.
Эндогенные лиганды глутаматных рецепторов — глутаминовая кислота и аспарагиновая кислота. Для активации NMDA-рецепторов также необходим глицин. Блокаторами NMDA-рецепторов являются PCP, кетамин, и другие вещества. AMPA-рецепторы также блокируются CNQX, NBQX. Каиновая кислота является активатором каинатных рецепторов.
«Круговорот» глутамата[править | править код]
При наличии глюкозы в митохондриях нервных окончаний происходит дезаминирование глутамина до глутамата при помощи фермента глутаминазы. Также при аэробном окислении глюкозы глутамат обратимо синтезируется из альфа-кетоглутарата (образуется в цикле Кребса) при помощи аминотрансферазы.
Синтезированный нейроном глутамат закачивается в везикулы. Этот процесс является протон-сопряжённым транспортом. В везикулу с помощью протон-зависимой АТФазы закачиваются ионы H+. При выходе протонов по градиенту в везикулу поступают молекулы глутамата при помощи везикулярного транспортера глутамата (VGLUTs).
Глутамат выводится в синаптическую щель, откуда поступает в астроциты, там трансаминируется до глутамина. Глутамин выводится снова в синаптическую щель и только тогда захватывается нейроном. По некоторым данным, глутамат напрямую путём обратного захвата не возвращается.[14]
Роль глутаминовой кислоты в кислотно-щелочном балансе[править | править код]
Дезаминирование глутамина до глутамата при помощи фермента глутаминазы образует аммиак, который, в свою очередь, связывается со свободным ионом водорода и экскретируется в просвет почечного канальца, приводя к снижению ацидоза.
При превращении глутамата в α-кетоглутарат также образуется аммиак. Далее α-кетоглутарат распадается на воду и углекислый газ. Последние, при помощи карбоангидразы через угольную кислоту, превращаются в свободный ион водорода и гидрокарбонат. Ион водорода экскретируется в просвет почечного канальца за счёт совместной транспортировки с ионом натрия, а бикарбонат натрия попадает в плазму крови.
Глутаматергическая система[править | править код]
В ЦНС находится порядка 106 глутаматергических нейронов. Тела нейронов лежат в коре головного мозга, обонятельной луковице, гиппокампе, чёрной субстанции, мозжечке. В спинном мозге — в первичных афферентах дорзальных корешков.
В ГАМКергических нейронах глутамат является предшественником тормозного медиатора, гамма-аминомасляной кислоты, образующейся с помощью фермента глутаматдекарбоксилазы.
Повышенное содержание глутамата в синапсах между нейронами может перевозбудить и даже убить эти клетки, что в эксперименте приводит к заболеванию, клинически сходному с боковым амиотрофическим склерозом. Установлено, что для воспрепятствования глутаматной интоксикации нейронов глиальные клетки астроциты поглощают избыток глутамата. Он транспортируется в эти клетки с помощью транспортного белка GLT1, который присутствует в клеточной мембране астроцитов. Будучи поглощённым клетками астроглии, глутамат больше не приводит к повреждению нейронов.
Глутаминовая кислота относится к условно незаменимым аминокислотам. Глутамат в норме синтезируется организмом. Присутствие в пище свободного глутамата придаёт ей так называемый «мясной» вкус, для чего глутамат используют как усилитель вкуса.
Содержание натуральных глутаматов в пищевых продуктах:
| Продукт | Свободный глутамат[15][неавторитетный источник?] (мг/100 г) |
|---|---|
| Молоко коровье | 2 |
| Сыр пармезан | 1200 |
| Яйца птицы | 23 |
| Мясо цыплёнка | 44 |
| Мясо утки | 69 |
| Говядина | 33 |
| Свинина | 23 |
| Треска | 9 |
| Макрель | 36 |
| Форель | 20 |
| Зелёный горошек | 200 |
| Кукуруза | 130 |
| Свекла | 30 |
| Морковь | 33 |
| Лук | 18 |
| Шпинат | 39 |
| Томаты | 140 |
| Зелёный перец | 32 |
В промышленности глутаминовую кислоту получают используя штаммы культурных микроорганизмов.
В воде вещество растворяется плохо. Поэтому в пищевкусовой промышленности используют хорошо растворимую соль глутаминовой кислоты — глутамат натрия.
Фармакологический препарат глутаминовой кислоты оказывает умеренное психостимулирующее, возбуждающее и отчасти ноотропное действие.[уточнить]
Глутаминовая кислота (пищевая добавка E620) и её соли (глутамат натрия Е621, глутамат калия Е622, диглутамат кальция Е623, глутамат аммония Е624, глутамат магния Е625) используются как усилитель вкуса во многих пищевых продуктах[16].
Глутаминовую кислоту и её соли добавляют в полуфабрикаты, различные продукты быстрого приготовления, кулинарные изделия, концентраты бульонов. Она придаёт пище приятный мясной вкус.
В медицине применение глутаминовой кислоты оказывает незначительное психостимулирующее, возбуждающее и ноотропное действие, что используют в лечении ряда заболеваний нервной системы. В середине 20 века врачи рекомендовали применение глутаминовой кислоты внутрь в случае мышечно-дистрофических заболеваний. Также её назначали спортсменам с целью увеличения мышечной массы.
Глутаминовая кислота используется в качестве хирального строительного блока в органическом синтезе[17], в частности, дегидратация глутаминовой кислоты приводит к её лактаму ― пироглутаминовой кислоте (5-оксопролину), которая является ключевым предшественником в синтезах неприродных аминокислот, гетероциклических соединений, биологически активных соединений и т. д.[18][19][20][21].
- ↑ L-Glutamic acid (англ.). Chemical book.
- ↑ Moloney M. G. Excitatory amino acids. // Natural Product Reports. 2002. P. 597―616.
- ↑ R. H. A. Plimmer. The Chemical Constitution of the Protein (неопр.) / R.H.A. Plimmer; F.G. Hopkins. — 2nd. — London: Longmans, Green and Co., 1912. — Т. Part I. Analysis. — С. 114. — (Monographs on biochemistry).
- ↑ Meldrum, B. S. (2000). «Glutamate as a neurotransmitter in the brain: Review of physiology and pathology». The Journal of nutrition 130 (4S Suppl): 1007S-1015S.
- ↑ McEntee, W. J.; Crook, T. H. (1993). «Glutamate: Its role in learning, memory, and the aging brain». Psychopharmacology 111 (4): 391—401. DOI:10.1007/BF02253527 PMID 7870979
- ↑ Okubo, Y.; Sekiya, H.; Namiki, S.; Sakamoto, H.; Iinuma, S.; Yamasaki, M.; Watanabe, M.; Hirose, K.; Iino, M. (2010). «Imaging extrasynaptic glutamate dynamics in the brain». Proceedings of the National Academy of Sciences 107 (14): 6526. DOI:10.1073/pnas.0913154107.
- ↑ Shigeri, Y.; Seal, R. P.; Shimamoto, K. (2004). «Molecular pharmacology of glutamate transporters, EAATs and VGLUTs». Brain Research Reviews 45 (3): 250—265. DOI:10.1016/j.brainresrev.2004.04.004 PMID 15210307
- ↑ Discovery Could Help Scientists Stop ‘Death Cascade’ Of Neurons After A Stroke (англ.). ScienceDaily. Дата обращения 5 января 2020.
- ↑ Robert Sapolsky (2005). «Biology and Human Behavior: The Neurological Origins of Individuality, 2nd edition». The Teaching Company. «see pages 19 and 20 of Guide Book»
- ↑ Hynd, M.; Scott, H. L.; Dodd, P. R. (2004). «Glutamate-mediated excitotoxicity and neurodegeneration in Alzheimer?s disease». Neurochemistry International 45 (5): 583—595. DOI:10.1016/j.neuint.2004.03.007 PMID 15234100
- ↑ Glushakov, AV; Glushakova, O; Varshney, M; Bajpai, LK; Sumners, C; Laipis, PJ; Embury, JE; Baker, SP; Otero, DH; Dennis, DM; Seubert, CN; Martynyuk, AE (2005 Feb). «Long-term changes in glutamatergic synaptic transmission in phenylketonuria». Brain : a journal of neurology 128 (Pt 2): 300-7. DOI:10.1093/brain/awh454 PMID 15634735
- ↑ Vassiliki Aroniadou-Anderjaska, Brita Fritsch, Felicia Qashu, Maria F.M. Braga. Pathology and Pathophysiology of the Amygdala in Epileptogenesis and Epilepsy // Epilepsy research. — 2008-2. — Т. 78, вып. 2-3. — С. 102–116. — ISSN 0920-1211. — DOI:10.1016/j.eplepsyres.2007.11.011.
- ↑ James O. McNamara, Yang Zhong Huang, A. Soren Leonard. Molecular signaling mechanisms underlying epileptogenesis // Science’s STKE: signal transduction knowledge environment. — 2006-10-10. — Т. 2006, вып. 356. — С. re12. — ISSN 1525-8882. — DOI:10.1126/stke.3562006re12.
- ↑ Ашмарин И. П., Ещенко Н. Д., Каразеева Е. П. Нейрохимия в таблицах и схемах. — М.: «Экзамен», 2007
- ↑ If MSG is so bad for you, why doesn’t everyone in Asia have a headache? | Life and style | The Observer
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
- ↑ Coppola G. M., Schuster H. F., Asymmetric synthesis. Construction of chiral moleculs using amino acids, A Wiley-Interscience Publication, New York, Chichester, Brisbane, Toronto, Singapore, 1987.
- ↑ Smith M. B. Pyroglutamte as a Chiral Template for the Synthesis of Alkaloids. Chapter 4 in Alkaloids: Chemical and Biological Perspectives. Vol. 12. Ed. by Pelletier S. W. Elsevier, 1998. P. 229―287.
- ↑ Nájera C., Yus M. Pyroglutamic acid: a versatile building block in asymmetric synthesis. //Tetrahedron: Asymmetry. 1999. V. 10. P. 2245―2303.
- ↑ Panday S. K., Prasad J., Dikshit D. K. Pyroglutamic acid: a unique chiral synthon. // Tetrahedron: Asymmetry. 2009. V. 20. P. 1581―1632.
- ↑ A. Stefanucci, E. Novellino, R. Costante, and A. Mollica. PYROGLUTAMIC ACID DERIVATIVES: BUILDING BLOCKS FOR DRUG DISCOVERY // HETEROCYCLES, 2014, V. 89, No. 8, pp. 1801―1825.

 N+H3 —CH2COO—
N+H3 —CH2COO—



 (
(
Добавить комментарий