Белки, свойства белков
Белки — высокомолекулярные соединения, построенные из аминокислот и являются одними из наиболее сложных по строению и составу среди всех органических соединений.
Биологическая роль белков исключительно велика: они составляют основную массу протоплазмы и ядер живых клеток. Белковые вещества находятся во всех растительных и животных организмах. О запасе белков в природе можно судить по общему количеству живого вещества на нашей планете: масса белков составляет примерно 0,01% от массы земной коры, то есть 1016 тонн.
 Молекулы белка
Молекулы белкаБелки по по своему элементному составу отличаются от углеводов и жиров: кроме углерода, водорода и кислорода они ещё содержат азот. Кроме того, Постоянной составной частью важнейших белковых соединений является сера, а некоторые белки содержат фосфор, железо и йод.
Свойства белков
1. Разная растворимость в воде. Растворимые белки образуют коллоидные растворы.
2. Гидролиз — под действием растворов минеральных кислот или ферментов происходит разрушение первичной структуры белка и образование смеси аминокислот.
3. Денатурация — частичное или полное разрушения пространственной структуры, присущей данной белковой молекуле. Денатурация происходит под действием:
- — высокой температуры
- — растворов кислот, щелочей и концентрированных растворов солей
- — растворов солей тяжёлых металлов
- — некоторых органических веществ (формальдегида, фенола)
- — радиоактивного излучения
Строение белков
Строение белков начали изучать в 19 веке. В 1888г. русский биохимик А.Я.Данилевский высказал гипотезу о наличии в белках амидной связи. Эта мысль в дальнейшем была развита немецким химиком Э.Фишером и в его работах нашла экспериментальное подтверждение. Он предложил полипептидную теорию строения белка. Согласно этой теории молекула белка состоит из одной длинной цепи или нескольких полипептидных цепей, связанных друг с другом. Такие цепи могут быть различной длины.
Фишером проведена большая экспериментальная работа с полипептидами. Высшие полипептиды, содержащие 15-18 аминокислот, осаждаются из растворов сульфатом аммония (аммиачными квасцами), то есть проявляют свойства, характерные для белков. Было показано, что полипептиды расщепляются теми же ферментами, что и белки, а будучи введёнными в организм животного, подвергаются тем же превращениям, как и белки, а весь их азот выделяется нормально в виде мочевины (карбамида).
Исследования, проведённые в 20 веке, показали, что существует несколько уровней организации
 Белок тирозин
Белок тирозинВ организме человека тысячи различных белков и практически все они построены из стандартного набора 20 аминокислот. Последовательность аминокислотных остатков в молекуле белка называют первичной структурой белка. Свойства белков и их биологические функции определяются последовательностью аминокислот. Работы по выяснению первичной структуры белка впервые были выполнены в Кембриджском университете на примере одного из простейших белков — инсулина. В течение посте 10 лет английский биохимик Ф.Сенгер проводил анализ инсулина. В результате анализа выяснено, что молекула инсулина состоит из двух полипептидных цепей и содержит 51 аминокислотный остаток. Он установил, что инсулин имеет молярную массу 5687 г/моль, а его химический состав отвечает формуле C 254H337N65O75S6. Анализ проводился вручную с использованием ферментов, которые избирательно гидролизуют пептидные связи между определёнными аминокислотными остатками.
В настоящее время большая часть работы по определению первичной структуры белков автоматизирована. Так была установлена первичная структура фермента лизоцима.
Тип «укладки» полипептидной цепочки называют вторичной структурой. У большинства белков полипептидная цепь свёртывается в спираль, напоминающую «растянутую пружину» (называют «А-спираль» или «А-стуктура»). Еще один распространённый тип вторичной структуры — структура складчатого листа (называют «B — структура»). Так, белок шёлка — фиброин имеет именно такую структуру. Он состоит из ряда полипептидных цепей, которые располагаются параллельно друг-другу и соединяются посредством водородных связей, большое число которых делает шёлк очень гибким и прочным на разрыв.
При всём этом практически не существует белков, молекулы которых на 100% имеют «А-структуру» или «B — структуру».
 Белок фиброин — белок натурального шёлка
Белок фиброин — белок натурального шёлкаПространственное положение полипептидной цепи называют третичной структурой белкой. Большинство белков относят к глобулярным, потому что их молекулы свёрнуты в глобулы. Такую форму белок поддерживает благодаря связям между разнорзаряженными ионами (-COO— и -NH3+ и дисульфидных мостиков. Кроме того, молекула белка свёрнута так, что гидрофобные углеводородные цепи оказываются внутри глобулы, а гидрофильные — снаружи.
Способ объединения нескольких молекул белка в одну макромолекулу называют четвертичной стуктурой белка. Ярким примером такого белка может быть гемоглобин. Было установлено, что, например, для взрослого человека молекула гемоглобина состоит из 4-х отдельных полипептидных цепей и небелковой части — гема.
Свойства белков объясняет их различное строение. Большинство белков аморфно, в спирте, эфире и хлороформе нерастворимо. В воде некоторые белки могут растворяться с образованием коллоидного раствора. Многие белки растворимы в растворах щелочей, некоторые — в растворах солей, а некоторые — в разбавленном спирте. Кристаллическое состояние белов встречается редко: примером могут быть алейроновые зёрна, встречающиеся в клещевине, тыкве, конопле. Кристаллизуется также альбумин куриного яйца и гемоглобин в крови.
Гидролиз белков
При кипячении с кислотами или щелочами, а также под действием ферментов белки распадаются на более простые химические соединения, образуя в конце цепочки превращения смесь A-аминокислот. Такое расщепление называется
В продуктах гидролиза белков кроме аминокислот были найдены углеводы, фосфорная кислота, пуриновые основания. Под влиянием некоторых факторов например, нагревания,растворов солей, кислот и щелочей, действия радиации, встряхивания, может нарушиться пространственная структура, присущая данной белковой молекуле. Денатурация может носить обратимый или необратимый характер, но в любом случае аминокислотная последовательность, то есть первичная структура, остаётся неизменной. В результате денатурации белок перестаёт выполнять присущие ему биологические функции.
Для белков известны некоторые цветные реакции, характерные для их обнаружения. При нагревании мочевины образуется биурет, который с раствором сульфата меди в присутствии щелочи даёт фиолетовое окрашивание или качественная реакция на белок, которую можно провести дома). Биуретовую реакцию даёт вещества, содержащие амидную группу, а в молекуле белка эта группа присутствует. Ксантопротеиновая реакция заключается в том, что белок от концентрированной азотной кислоты окрашивается в жёлтый цвет. Эта реакция указывает на наличие в белке бензольной группы, которая имеется в таких аминокислотах, как фениланин и тирозин.
При кипячении с водным раствором нитрата ртути и азотистой кислоты, белок даёт красное окрашивание. Эта реакция указывает на наличие в белке тирозина. При отсутствии тирозина красного окрашивания не появляется.
Белки и их значение
Введение
Питательные вещества являются как источником энергии, покрывающим расходы организма, так и строительным материалом, который используется в процессе роста организма и воспроизведения новых клеток, замещающих отмирающие. Но питательные вещества в том виде, в каком они употребляются в пищу, не могут всосаться и быть использованными организмом. Только вода, минеральные соли и витамины всасываются и усваиваются в том виде, в каком они поступают.
Питательными веществами называются белки, жиры и углеводы. Эти вещества являются необходимыми составными частями пищи. В пищеварительном тракте белки, жиры и углеводы подвергаются как физическим воздействиям (измельчаются и перетираются), так и химическим изменениям, которые происходят под влиянием особых веществ — ферментов, — содержащихся в соках пищеварительных желез. Под влиянием пищеварительных соков питательные вещества расщепляются на более простые, которые всасываются и усваиваются организмом.
Белки. Строение, свойства и функции
«Во всех растениях и животных присутствует некое вещество, которое, без сомнения, является наиболее важным из всех известных веществ живой природы, и без которого жизнь была бы на нашей планете невозможна. Это вещество я наименовал протеин», — так писал еще в 1838 году голландский биохимик Жерар Мюльдер, который впервые открыл существование в природе белковых тел и сформулировал свою теорию протеина. Слово «протеин» (белок) происходит от греческого слова «протейос», что означает «занимающий первое место». И в самом деле, все живое на земле содержит белки. Они составляют около 50% сухого веса тела всех организмов. У вирусов содержание белков колеблется в пределах от 45 до 95%.
Белки являются одним из четырех основных органических веществ живой материи (белки, нуклеиновые кислоты, углеводы, жиры), но по своему значению и биологическим функциям они занимают в ней особое место. Около 30% всех белков человеческого тела находится в мышцах, около 20% — в костях и сухожилиях и около 10% — в коже. Но наиболее важными белками всех организмов являются ферменты, которые, хотя и присутствуют в теле и в каждой клетке тела в малом количестве, тем не менее, управляют рядом существенно важных для жизни химических реакций. Все процессы, происходящие в организме — переваривание пищи, окислительные реакции, активность желез внутренней секреции, мышечная деятельность и работа мозга, — регулируются ферментами. Разнообразие ферментов в теле организмов огромно. Даже в маленькой бактерии их насчитываются многие сотни.
Белки, или, как их иначе называют, протеины, имеют очень сложное строение и являются наиболее сложными из питательных веществ. Белки — обязательная составная часть всех живых клеток. В состав белков входят: углерод, водород, кислород, азот, сера и иногда фосфор. Наиболее характерно для белка наличие в его молекуле азота. Другие питательные вещества азота не содержат. Поэтому белок называют азотосодержащим веществом.
Основные азотосодержащие вещества, из которых состоят белки, — это аминокислоты. Количество аминокислот невелико — их известно только 28. Все громадное разнообразие содержащихся в природе белков представляет собой различное сочетание известных аминокислот. От их сочетания зависят свойства и качества белков.
Белки играют исключительно важную роль в живой природе. Жизнь немыслима без различных по строению и функциям белков. Белки — это биополимеры сложного строения, макромолекулы (протеины) которых состоят из остатков аминокислот, соединенных между собой амидной (пептидной) связью. Кроме длинных полимерных цепей, построенных из остатков аминокислот (полипептидных цепей), в макромолекулу белка могут входить также остатки или молекулы других органических соединений. На одном кольце каждой пептидной цепи имеется свободная, или ацилированная, аминогруппа, на другом — свободная, или амидированная, карбоксильная группа.
Конец цепи с аминогруппой называется М-концом, конец цепи с карбоксильной группой — С-концом пептидной цепи. Между СО-группой одной пептидной группировки и NH-группой другой пептидной группировки могут легко образовываться водородные связи.
Группы, входящие в состав радикала R аминокислот, могут вступать во взаимодействие друг с другом, с посторонними веществами и с соседними белковыми и иными молекулами, образуя сложные и разнообразные структуры.
В макромолекулу белка входит одна или несколько пептидных цепей, связанных друг с другом поперечными химическими связями, чаще всего через серу (дисульфидные мостики, образуемые остатками цистеина). Химическую структуру пептидных цепей принято называть первичной структурой белка, или секвенцией.
Для построения пространственной структуры белка пептидные цепи должны принять определенную, свойственную данному белку конфигурацию, которая закрепляется водородными связями, возникающими между пептидными группировками отдельных участков молекулярной цепи. По мере образования водородных связей пептидные цепи закручиваются в спирали, стремясь к образованию максимального числа водородных связей и, соответственно, к энергетически наиболее выгодной конфигурации.
Впервые такая структура на основе рентгеноструктурного анализа была обнаружена при изучении главного белка волос и шерсти — кератина — Полингом, американским физиком и химиком. Ее назвали а-структурой или а-спиралью. На один виток спирали приходится по 3,6 – 3,7 остатков аминокислот. Расстояние между витками — около 0,54 миллиардной доли метра. Строение спирали стабилизируется внутримолекулярными водородными связями.
При растяжении спираль макромолекулы белка превращается в другую структуру, напоминающую линейную.
Но образованию правильной спирали часто мешают силы отталкивания или притяжения, возникающие между группами аминокислот, или стерические препятствия, например, за счет образования пирролидиновых колец пролина и оксипролина, которые заставляют пептидную цепь резко изгибаться и препятствуют образованию спирали на некоторых ее участках. Далее отдельные участки макромолекулы белка ориентируются в пространстве, принимая в некоторых случаях достаточно вытянутую форму, а иногда сильно изогнутую, свернутую пространственную структуру.
Пространственная структура закреплена, вследствие взаимодействия радикалов R и аминокислот с образованием дисульфидных мостиков, водородных связей, ионных пар или других химических либо физических связей. Именно пространственная структура белка определяет химические и биологические свойства белков.
В зависимости от пространственной структуры, все белки делятся на два больших класса: фибриллярные (они используются природой как структурный материал) и глобулярные (ферменты, антитела, некоторые гормоны и др.).
Полипептидные цепи фибриллярных белков имеют форму спирали, которая закреплена расположенными вдоль цепи внутримолекулярными водородными связями. В волокнах фибриллярных белков закрученные пептидные цепи расположены параллельно оси волокна, они как бы ориентированы относительно друг друга, располагаются рядом, образуя нитевидные структуры, и имеют высокую степень асимметрии. Фибриллярные белки плохо растворимы или совсем нерастворимы в воде. При растворении в воде они образуют растворы высокой вязкости. К фибриллярным белкам относятся белки, входящие в состав тканей и покровных образований. Это миозин — белок мышечных тканей; коллаген, являющийся основой седиментационных тканей и кожных покровов; кератин, входящий в состав волос, роговых покровов, шерсти и перьев. К этому же классу белков относится белок натурального шелка — фиброин, — вязкая сиропообразная жидкость, затвердевающая на воздухе в прочную нерастворимую нить. Этот белок имеет вытянутые полипептидные цепи, соединенные друг с другом межмолекулярными водородными связями, что и определяет, по-видимому, высокую механическую прочность натурального шелка.
Пептидные цепи глобулярных белков сильно изогнуты, свернуты и часто имеют форму жестких шариков — глобул. Молекулы глобулярных белков обладают низкой степенью асимметрии, они хорошо растворимы в воде, причем вязкость их растворов невелика. Это, прежде всего, белки крови — гемоглобин, альбумин, глобулин и др.
Следует отметить условность деления белков на фибриллярные и глобулярные, так как существует большое число белков с промежуточной структурой.
Свойства белка могут сильно изменяться при замене одной аминокислоты другой. Это объясняется изменением конфигураций пептидных цепей и условий образования пространственной структуры белка, которая, в конечном счете, определяет его функции в организме.
Число аминокислотных остатков, входящих в молекулы отдельных белков, весьма различно: в инсулине — 51, в миоглобине — около 140. Поэтому и относительная молекулярная масса белков колеблется в очень широких пределах — от 10 тысяч до многих миллионов. На основе определения относительной молекулярной массы и элементарного анализа установлена эмпирическая формула белковой молекулы — гемоглобина крови (C738H1166O208S2 Fe)4. Меньшая молекулярная масса может быть у простейших ферментов и некоторых гормонов белковой природы. Например, молекулярная масса гормона инсулина около 6500, а белка вируса гриппа — 320000000. Вещества белковой природы (состоящие из остатков аминокислот, соединенных между собой пептидной связью), имеющие относительно меньшую молекулярную массу и меньшую степень пространственной организации макромолекулы, называются полипептидами. Провести резкую границу между белками и полипептидами трудно. В большинстве случаев белки отличаются от других природных полимеров (каучука, крахмала, целлюлозы) тем, что чистый индивидуальный белок содержит только молекулы одинакового строения и массы. Исключением является, например, желатина, в состав которой входят макромолекулы с молекулярной массой 12000 – 70000.
Строением белков объясняются их весьма разнообразные свойства. Они имеют разную растворимость: некоторые растворяются в воде, другие — в разбавленных растворах нейтральных солей, а некоторые совсем не обладают свойством растворимости (например, белки покровных тканей). При растворении белков в воде образуется своеобразная молекулярно-дисперсная система (раствор высокомолекулярного вещества). Некоторые белки могут быть выделены в виде кристаллов (белок куриного яйца, гемоглобина крови).
Белки играют важнейшую роль в жизнедеятельности всех организмов. При пищеварении белковые молекулы перевариваются до аминокислот, которые, будучи хорошо растворимы в водной среде, проникают в кровь и поступают во все ткани и клетки организма. Здесь наибольшая часть аминокислот расходуется на синтез белков различных органов и тканей, часть — на синтез гормонов, ферментов и других биологически важных веществ, а остальные служат как энергетический материал. Т.е. белки выполняют каталитические (ферменты), регуляторные (гормоны), транспортные (гемоглобин, церулоплазмин и др.) и защитные (антитела, тромбин и др.) функции.
Белки — важнейшие компоненты пищи человека и корма животных. Совокупность непрерывно протекающих химических превращений белков занимает ведущее место в обмене веществ организмов. Скорость обновления белков у живых организмов зависит от содержания белков в пище, а также его биологической ценности, которая определяется наличием и соотношением незаменимых аминокислот
Белки растений беднее белков животного происхождения по содержанию незаменимых аминокислот, особенно лизина, метионина, триптофана. Белки сои и картофеля по аминокислотному составу наиболее близки белкам животных. Отсутствие в корме незаменимых аминокислот приходит к тяжелым нарушениям азотистого обмена. Поэтому селекция зерновых культур направлена, в частности, и на повышение качества белкового состава зерна.
Классификация белков
Белки подразделяются на две большие группы: простые белки, или протеины, и сложные белки, или протеиды.
При гидролизе протеинов в кислом водном растворе получают только а-аминокислоты. Гидролиз протеидов дает, кроме аминокислот, и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — это соединения белковых веществ с небелковыми.
Протеины
Альбумины хорошо растворяются в воде. Встречаются в молоке, яичном белке и крови.
Глобулины в воде не растворяются, но растворимы в разбавленных растворах солей. К глобулинам принадлежат глобулины крови и мышечный белок миозин.
Глутелины растворяются только в разбавленных растворах щелочей. Встречаются в растениях.
Склеропротеины — нерастворимые белки. К склеропротеинам относятся кератины, белок кожи и соединительных тканей коллаген, белок натурального шелка фиброин.
Протеиды
Протеиды построены из протеинов, соединенных с молекулами другого типа (простетическими группами).
Фосфопротеиды содержат молекулы фосфорной кислоты, связанные в виде сложного эфира у гидроксильной группы аминокислоты серина. К ним относится вителлин — белок, содержащийся в яичном желтке, белок молока казеин.
Гликопротеиды содержат остатки углеводов. Они входят в состав хрящей, рогов, слюны.
Хромопротеиды содержат молекулу окрашенного вещества, обычно типа порфина. Самым важным хромопротеидом является гемоглобин — переносчик кислорода, окрашивающий красные кровяные тельца.
Нуклеопротеиды — протеины, связанные с нуклеиновыми кислотами. Они представляют собой очень важные с биологической точки зрения белки — составные части клеточных ядер. Нуклеопротеиды являются важнейшей составной частью вирусов — возбудителей многих болезней.
При соединении двух или нескольких аминокислот образуется более сложное соединение — полипептид. Полипептиды, соединяясь, образуют еще более сложные и крупные частицы и в итоге — сложную молекулу белка.
2. 1. Общая характеристика белков.
Лекция 2. Химия белков.
Белки – это высокомолекулярные органические, азотсодержащие соединения, состоящие из аминокислот.
Белки – наиболее сложные соединения живых систем. Не только каждый вид живого, но и каждый орган, каждый тип клеток обладает своим специфическим набором белков. Наконец, каждый индивидуум отличается от подобных своего вида собственным набором белков (биохимическая индивидуальность). Эта индивидуальность поддерживается всеми живущими организмами. При внедрении в организм чужих белков образуются защитные вещества (антитела) и разрушают чужие белки. Однако имеется и общность между определенными белками одного и того же вида, которая позволяет проводить обмен белками (например, переливание крови).
В количественном отношении они занимают первое место среди всех содержащихся в живой клетке макромолекул. В организме человека белки составляют примерно 1/5 часть, или 20 % массы, а в пересчете на сухой вес — 45%. Содержание белков в разных тканях различно, так в мышцах и печени содержится до 22 % белка, в мозге – 11 %, в жировой ткани – 6 %.
Свое название белки получили от белого цвета куриного яйца, на примере которого изучались их свойства. В 1838 г. Н. Мульдер назвал белки протеинами (от греч. protos — первый, важный). Это же название принято в международной номенклатуре.
Белки занимают первое место среди макромолекул не случайно, ведь там где есть белки, отмечены признаки жизни и наоборот там где есть жизнь, обнаруживаются белки.
2. 2 Функции белков в организме.
Белки, входящие в состав организма человека, отличаются большим
разнообразием состава, структуры, местом расположения и соответственно функциями.
Белки выполняют следующие функции в организме:
Каталитическая или ферментативная функция. Одна из основных функций белков. В настоящее время известно свыше 2000 различных ферментов, которые являются биологическими катализаторами и ускоряют все биохимические процессы в организме. Практически все они являются по своей химической природе белками.
Структурная или пластическая функция. Еще одна из важнейших функций белков. Мембраны всех клеток и субклеточных единиц представляют собой бислой: белки и фосфолипиды, т.е. белки играют большую роль в формировании всех клеточных структур. Эту функцию выполняют, например следующие белки: кератин – составляет основу волос и ногтей, коллаген – главный белок соединительной ткани.
Сократительная функция. Важным признаком жизни является подвижность, в основе которой лежит данная функция белков, таких как актин и миозин – белки мышц. Кроме мышечных сокращений к этой функции относят и изменение форм клеток и субклеточных частиц.
Транспортная функция. Перенос различных веществ по крови и в пределах клетки. Например, альбумины переносят по крови ВЖК, лекарственные вещества, билирубин; гемоглобин переносит кислород и углекислый газ, другие белки транспортируют липиды, стероиды, витамины и т.д.
Защитная функция. В процессе эволюции в организме выработан механизм узнавания и связывания «чужих» молекул с помощью белков-антител, которые являются белковой фракцией гамма-глобулинов; кроме этого ряд белков, например, альбумины обезвреживают ядовитые вещества (ВЖК и билирубин) в крови; белки свертывающей (фибриноген, протромбин и др.) и противосвертывающей системы предотвращают свертывание крови в нормальных условиях и наоборот образуют сгустки крови при повреждениях сосудов.
Регуляторная функция. Среди молекул-регуляторов важное место принадлежит регуляторам белковой природы, таким как гормоны, 50% которых имеют белковую природу; белки-гистоны, кислые белки играют роль в регуляции процесса трансляции в биосинтезе белка; белки крови альбумины играют большую роль в создании и поддержании онкотического и осмотического давления крови; белки входя в состав белковой и гемоглобиновой буферных систем участвуют в поддержании рН крови и т.д.
Рецепторная функция. Избирательное связывание различных регуляторов-гормонов, биогенных аминов, простогландинов, медиаторов, циклических мононуклеотидов, протекает с помощью белков-рецепторов на мембранах клетки.
Опорная или механическая функция. Прочность соединительной, хрящевой и костной ткани за счет белков – коллагена, эластина, фибронектина.
Энергетическая функция. 1 г. белка, окисляясь до конечных продуктов – мочевины, углекислого газа и воды, дает 4,1 ккал энергии.
БЕЛКИ: СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ
БЕЛКИ: СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ
1. Белки и их основные признаки
2. Биологические функции белков
3. Аминокислотный состав белков
4. Классификация белков
5. Физические свойства белков
6. Структурная организация белковых молекул (первичная, вторичная, третичная структуры)
Белки и их основные признаки
Белки или протеины (что в переводе с греческого означает «первые» или «важнейшие»), количественно преобладают над всеми макромолекулами, присутствующими в живой клетке, и составляют более половины сухого веса большинства организмов. Представления о белках как о классе соединений сформировались в XVII-XIX вв. В этот период из разнообразных объектов живого мира (семена и соки растений, мышцы, кровь, молоко) были выделены вещества, обладающие сходными свойствами: они образовывали вязкие растворы, свертывались при нагревании, при горении ощущался запах паленой шерсти и выделялся аммиак. Поскольку все эти свойства ранее были известны для яичного белка, то новый класс соединений назвали белками. После появления в начале XIX вв. Более совершенных методов анализа веществ определили элементный состав белков. В них обнаружили С, Н, О, N, S. К концу XIX вв. Из белков было выделено свыше 10 аминокислот. Исходя из результатов изучения продуктов гидролиза белков, немецкий химик Э.Фишер (1852-1919) предположил, что белки построены из аминокислот.
В результате работ Фишера стало ясно, что белки представляют собой линейные полимеры a-аминокислот, соединенных друг с другом амидной (пептидной) связью, а все многообразие представителей этого класса соединений могло быть объяснено различиями аминокислотного состава и порядка чередования разных аминокислот в цепи полимера.
Первые исследования белков проводились со сложными белковыми смесями, например: с сывороткой крови, яичным белком, экстрактами растительных и животных тканей. Позже были разработаны методы выделения и очистки белков, такие как осаждение, диализ, хроматография на целлюлозных и других гидрофильных ионообменниках, гель-фильтрация, электрофорез. Более подробно рассмотрим эти методы на лабораторной работе и семинарском занятии.
На современном этапе основными направлениями изучения белков являются следующие:
¨ изучение пространственной структуры индивидуальных белков;
¨ изучение биологических функций разных белков;
¨ изучение механизмов функционирования индивидуальных белков (на уровне отдельных атомов, атомных групп молекулы белка).
Все эти этапы взаимосвязаны, ведь одна из основных задач биохимии как раз и состоит в том, чтобы понять, каким образом аминокислотные последовательности разных белков дают им возможность выполнять различные функции.
Биологические функции белков
Ферменты — это биологические катализаторы, самый многообразный, многочисленный класс белков. Почти все химические реакции, в которых участвуют присутствующие в клетке органические биомолекулы, катализируются ферментами. Настоящему времени открыто более 2000 различных ферментов.
Транспортные белки — Транспортные белки плазмы крови связывают и переносят специфические молекулы или ионы из одного органа в другой. Например, гемоглобин, содержащийся в эритроцитах, при прохождении через легкие связывает кислород и доставляет его к периферическим тканям, где кислород освобождается. Плазма крови содержит липопротеины, осуществляющие перенос липидов из печени в другие органы. В клеточных мембранах присутствует еще один клеточный тип транспортных белков, способных связывать определенные молекулы (напр., глюкозу) и переносить их через мембрану внутрь клетки.
Пищевые и запасные белки. Наиболее известными примерами таких белков служат белки семян пшеницы, кукурузы, риса. К пищевым белкам относится яичныйальбумин — основной компонент яичного белка, казеин — главный белок молока.
Сократительные и двигательные белки. Актин и миозин — белки, функционирующие в сократительной системе скелетной мышцы, а также во многих немышечных тканях.
Структурные белки. Коллаген — главный компонент хрящей и сухожилий. Этот белок имеет очень высокую прочность на разрыв. Связки содержат эластин — структурный белок, способный растягиваться в двух измерениях. Волосы, ногти состоят почти исключительно из прочного нерастворимого белка — кератина. Главным компонентом шелковых нитей и паутины служит белок фиброин.
Защитные белки. Иммуноглобулины или антитела — это специализированные клетки, вырабатываемые в лимфоцитах. Они обладают способностью распознавать проникшие в организм бактерии вирусы или чужеродные молекулы, а затем запускать систему их нейтрализации. Фибриноген и тромбин — белки, участвующие в процессе свертывания крови, они предохраняют организм от потери крови при повреждении сосудистой системы.
Регуляторные белки. Некоторые белки участвуют в регуляции клеточной активности. К ним относятся многие гормоны, такие как инсулин (регулирует обмен глюкозы).
Классификация белков
По растворимости
Альбумины. Растворимы в воде и солевых растворах.
Глобулины. Слаборастворимы в воде, но хорошо растворимы в солевых растворах.
Проламины. Растворимы в 70-80% этаноле, нерастворимы в воде и абсолютном спирте. Богаты аргинином.
Гистоны. Растворимы в солевых растворах.
Склеропротеины. Нерастворимы в воде и солевых растворах. Повышено содержание глицина, аланина, пролина.
По форме молекул
Если исходить из отношения осей (продольной и поперечной), можно выделить два больших класса белков. У глобулярных белков отношение составляет меньше 10 и в большинстве случаев не превышает 3-4. Они характеризуются компактной упаковкой полипептидных цепей. Примеры глобулярных белков: многие ферменты, инсулин, глобулин, белки плазмы крови, гемоглобин.
Фибриллярные белки, у которых отношение осей превышает 10, состоят из пучков полипептидных цепей, спирально навитых друг на друга и связанных между собой поперечными ковалентными или водородными связями (кератин, миозин, коллаген, фибрин).
Физические свойства белков
На физических свойствах белков, таких как ионизация, гидратация, растворимость основаны различные методы выделения и очистки белков.
Так как белки содержат ионогенные, т.е. способные к ионизации аминокислотные остатки (аргинин, лизин, глутаминовая кислота и т.д.), следовательно, они представляют собой полиэлектролиты. При подкислении степень ионизации анионных групп снижается, а катионных — повышается, при подщелачивании наблюдается обратная закономерность. При определенном рН число отрицательно и положительно заряженных частиц становится одинаковым, такое состояние называется изоэлектрическим (суммарный заряд молекулы равен нулю). Значение рН, при котором белок находится в изоэлектрическом состоянии, называют изоэлектрической точкой и обозначают рI. На различной ионизации белков при определенном значении рН основан один из методов их разделения — метод электрофореза.
Полярные группы белков (ионогенные и неионогенные) способны взаимодействовать с водой, гидратироваться. Количество воды, связанное с белком достигает 30-50 г на 100 г белка. Гидрофильных групп больше на поверхности белка. Растворимость зависит от количества гидрофильных групп в белке, от размеров и формы молекул, от величины суммарного заряда. Совокупность всех этих физических свойств белка позволяет использовать метод молекулярных сит или гель-фильтрацию для разделения белков. Метод диализа используется для очистки белков от низкомолекулярных примесей и основан на больших размерах молекул белка.
Растворимость белков зависит и от наличия других растворенных веществ, например, нейтральных солей. При высоких концентрациях нейтральных солей белки выпадают в осадок, причем для осаждения (высаливания) разных белков требуется разная концентрация соли. Это связано с тем, что заряженные молекулы белка адсорбируют ионы противоположного заряда. В результате частицы теряют свои заряды и электростатическое отталкивание, в результате происходит осаждение белка. Методом высаливания можно фракционировать белки.
Первичная структура белков
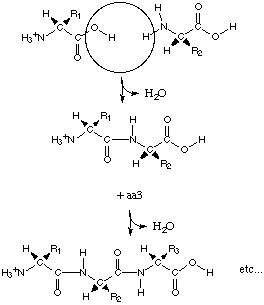 |
Первичной структурой белканазывают состав и последовательность аминокислотных остатков в белковой молекуле. Аминокислоты в белке связаны пептидными связями.
Все молекулы данного индивидуального белка идентичны по аминокислотному составу, последовательности аминокислотных остатков и длине полипептидной цепи. Установление последовательности аминокислотной последовательности белков — трудоемкая задача. Более подробно на эту тему мы поговорим на семинаре. Инсулин был первым белком, для которого установили аминокислотную последовательность. Бычий инсулин имеет молярную массу около 5700. Его молекула состоит из двух полипептидных цепей: А-цепи, содержащей 21 а.к., и В-цепи, содержащей 30 а.к., эти две цепи соединены двумя дисульфидными ( -S-S-) связями. Даже небольшие изменения первичной структуры могут значительно изменять свойства белка. Болезнь серповидноклеточная анемия является результатом изменения всего 1 аминокислоты в b-цепи гемоглобина (Glu ® Val).
Видовая специфичность первичной структуры
При изучении аминокислотных последовательностей гомологичных белков, выделенных из разных видов, было сделано несколько важных выводов. К гомологичным белкам относятся те белки, которые у разных видов выполняют одинаковые функции. Примером может служить гемоглобин: у всех позвоночных он осуществляет одну и ту же функцию, связанную с транспортом кислорода. Гомологичные белки разных видов обычно имеют полипептидные цепи одинаковой или почти одинаковой длины. В аминокислотных последовательностях гомологичных белков во многих положениях всегда находятся одни и те же аминокислоты — их называют инвариантными остатками. Вместе с тем в других положениях белков наблюдаются значительные различия: в этих положениях аминокислоты варьируются от вида к виду; такие аминокислотные остатки называютсявариабельными. Всю совокупность сходных черт в аминокислотных последовательностях гомологичных белков объединяют в понятиегомология последовательностей. Наличие такой гомологии предполагает, что животные, из которых были выделены гомологичные белки, имеют общее эволюционное происхождение. Интересным примером является сложный белок — цитохром с — митохондриальный белок, учавствующий в качестве переносчика электронов в процессах биологического окисления. М » 12500, содержит »100 а.к. Были установлены а.к. последовательности для 60 видов. 27 а.к. — одинаковы, это указывает на то, что все эти остатки играют важную роль в определении биологической активности цитохрома с. Второй важный вывод, сделанный на основе анализа аминокислотных последовательностей, состоит в том, что число остатков, по которым различаются цитохромы с любых двух видов, пропорционально филогенетическому различию между данными видами. Например, молекулы цитохрома с лошади и дрожжей различаются по 48 а.к., у утки и курицы — по 2 а.к., у курицы и индейки не различаются. Сведения с числе различий в аминокислотных последовательностях гомологичных белков из разных видов используют для построения эволюционных карт, отражающих последовательные этапы возникновения и развития различных видов животных и растений в процессе эволюции.
Вторичная структура белков
— это укладка белковой молекулы в пространстве без учета влияния боковых заместителей. Выделяют два типа вторичной структуры: a-спираль и b- структуру (складчатый слой). Остановимся более подробно на рассмотрении каждого типа вторичной структуры.
a-Спираль представляет из себя правую спираль с одинаковым шагом, равным 3,6 аминокислотных остатков. a-Спираль стабилизируется внутримолекулярными водородными связями, возникающими между атомами водорода одной пептидной связи и атомами кислорода четвертой по счету пептидной связи.
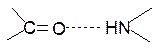
Боковые заместители расположены перпендикулярно плоскости a-спирали.
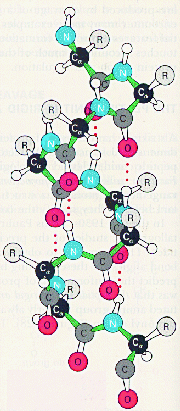 |
Т.о. свойства данного белка определяются свойствами боковых групп аминокислотных остатков: входящих в состав того или иного белка. Если боковые заместители гидрофобны, то и белок, имеющий структуру a-спираль гидрофобен. Примером такого белка является белок кератин, из которого состоят волосы.
В результате получается, что a- спираль пронизана водородными связями и является очень устойчивой структурой. При образовании такой спирали работают две тенденции:
¨ молекула стремится к минимуму энергии, т.е. к образованию наибольшего числа водородных связей;
¨ из-за жесткости пептидной связи сблизиться в пространстве могут лишь первая и четвертая пептидные связи.
В складчатом слое пептидные цепи располагаются параллельно друг другу, образуя фигуру, подобную листу, сложенному гармошкой. Пептидных цепей, взаимодействующих между собой водородными связями, может быть большое количество. Расположены цепи антипараллельно.
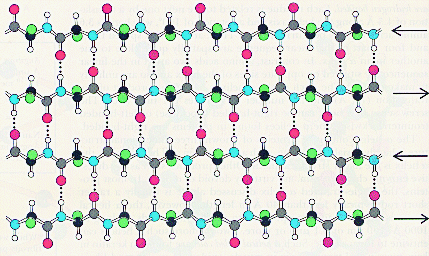 |
Чем больше пептидных цепей входит в состав складчатого слоя, тем прочнее молекула белка.
Сравним свойства белковых материалов шерсти и шелка и объясним различие в свойствах этих материалов с точки зрения строения белков, из которых они состоят.
Кератин — белок шерсти — имеет вторичную структуру a-спираль. Шерстяная нить не такая прочная, как шелковая, легко растягивается в мокром состоянии. Это свойство объясняется тем, что при приложении нагрузки водородные связи рвутся и спираль растягивается.
Фиброин — белок шелка — имеет вторичную b-структуру. Шелковая нить не вытягивается и является очень прочной на разрыв. Это свойство объясняется тем, что в складчатом слое взаимодействуют между собой водородными связями много пептидных цепей, что делает эту структуру очень прочной.
Аминокислоты различаются по способности участвовать в образовании a-спиралей и b-структур. Редко встречаются в a-спиралях глицин, аспаргин, тирозин. Пролин дестабилизирует a-спиральную структуру. Объясните, почему? В состав b-структур входит глицин, почти не встречаются пролин, глютаминовая кислота, аспаргин, гистидин, лизин, серин.
В структуре одного белка могут находиться участки b-структур, a-спиралей и нерегулярные участки. На нерегулярных участках пептидная цепь может сравнительно легко изгибаться, менять конформацию, в то время, как спираль и складчатый слой представляют собой достаточно жесткие структуры. Содержание b-структур и a-спиралей в разных белках неодинаково.
Третичная структура белков
определяется взаимодействием боковых заместителей пептидной цепи. Для фибриллярных белков трудно выделить общие закономерности в образовании третичных структур. Что касается глобулярных белков, то такие закономерности существуют, и мы их рассмотрим. Третичная структура глобулярных белков образуется путем дополнительного складывания пептидной цепи, содержащей b-структуры, a-спирали и нерегулярные участки, так , что гидрофильные боковые группы аминокислотных остатков оказываются на поверхности глобулы, а гидрофобные боковые группы спрятаны вглубь глобулы, иногда образуют гидрофобный карман.
Силы, стабилизирующие третичную структуру белка.
Электростатическое взаимодействие между разно заряженными группами, крайний случай — ионные взаимодействия.
Водородные связи, возникающие между боковыми группами полипептидной цепи.
Гидрофобные взаимодействия.
Ковалентные взаимодействия (образование дисульфидной связи между двумя остатками цистеина с образованием цистина). Образование дисульфидных связей приводит к тому, что удаленные области полипептидной молекулы сближаются и фиксируются. Дисульфидные связи разрушаются под действием восстановителей. Это свойство используется для химической завивки волос, которые почти полностью представляют собой белок кератин, пронизанный дисульфидными связями.
Характер пространственной укладки определяется аминокислотным составом и чередованием аминокислот в полипептидной цепи (первичной структурой). Следовательно, каждый белок имеет только одну пространственную структуру, соответствующую его первичной структуре. Небольшие изменения конформации белковых молекул происходят при взаимодействии с другими молекулами. Эти изменения порой играют огромную роль при функционировании белковых молекул. Так, при присоединении молекулы кислорода к гемоглобину несколько изменяется конформация белка, что приводит к эффекту кооперативного взаимодействия при присоединении остальных трех молекул кислорода. Такое изменение конформации в лежит в основе теории индуцирующего соответствия при объяснении групповой специфичности некоторых ферментов.
Кроме ковалентной дисульфидной все остальные связи, стабилизирующие третичную структуру, являются по своей природе слабыми и легко разрушаются. При разрыве большого числа связей, стабилизирующих пространственную структуру белковой молекулы, упорядоченная уникальная для каждого белка конформация нарушается, при этом часто теряется биологическая активность белка. Такое изменение в пространственном строении называется денатурацией.
Ингибиторы функций белков
Учитывая, что различные лиганды отличаются Ксв, всегда можно подобрать вещество, похожее по структуре на природный лиганд, но имеющий большее значение Ксв с данным белком. Например, СО имеет Ксв в 100 раз больше, чем О2 с гемоглобином, поэтому достаточно 0,1% СО в воздухе, чтобы заблокировать большое количество молекул гемоглобина. По такому же принципу действуют многие лекарства. Например, дитилин.
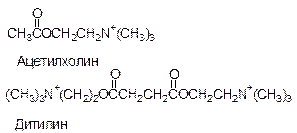
Ацетилхолин — медиатор передачи нервных импульсов на мышцу. Дитилин блокирует белок-рецептор, с которым связывается ацетилхолин и создает эффект парализации.
9.Связь структуры белков с их функциями на примере гемоглобина и миоглобина
Транспорт двуокиси углерода
Гемоглобин не только переносит кислород от легких к периферическим тканям, но и ускоряет транспорт СО2 от тканей к легким. Гемоглобин связывает СО2 сразу после освобождения кислорода (» 15 % всего СО2). В эритроцитах происходит ферментативный процесс образования угольной кислоты из СО2, поступающего из тканей: СО2 + Н2О = Н2СО3. Угольная кислота быстро диссоциирует на НСО3— и Н+. Для предотвращения опасного повышения кислотности должна существовать буферная система, способная поглощать избыток протонов. Гемоглобин связывает два протона на каждые четыре освободившиеся молекулы кислорода и определяет буферную емкость крови. В легких идет обратный процесс. Высвобождающиеся протоны связываются с бикарбонат- ионом с образованием угольной кислоты, которая под действием фермента превращается в СО2 и воду, СО2 выдыхается. Т.о., связывание О2 тесно сопряжено с выдыханием СО2. Это обратимое явление известно как эффект Бора. У миоглобина эффекта Бора не обнаруживается.
Изофункциональные белки
Белок, выполняющий определенную функцию в клетке, может быть представлен несколькими формами — изофункциональными белками, или изоферментами. такие белки хоть и выполняют одинаковую функцию, но отличаются, константой связывания, что приводит к некоторым различиям в функциональном отношении. Например, в эритроцитах человека обнаружено несколько форм гемоглобина: HbA (96%), HbF (2%), HbA2(2%). Все гемоглобины представляют собой тетрамеры, построенные из протомеров a, b, g, d (HbA -a2b2, HbF — a2g2, HbA2 — a2d2). Все протомеры сходны между собой по первичной структуре, и очень большое сходство наблюдается по вторичной и третичной структурам. Все формы гемоглобинов предназначены для переноса кислорода в клетки тканей, но HbF, например, имеет большее сродство к кислороду, чем HbA. HbF характерен для эмбриональной стадии развития человека. Он способен отнимать кислород у HbA, что обеспечивает нормальное снабжение кислородом плода.
Изобелки — это результат наличия более чем одного структурного гена в генофонде вида.
БЕЛКИ: СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ
1. Белки и их основные признаки
2. Биологические функции белков
3. Аминокислотный состав белков
4. Классификация белков
5. Физические свойства белков
6. Структурная организация белковых молекул (первичная, вторичная, третичная структуры)
5.Белки, их строение и функции.
Белки и их строение.
Среди органических компонентов клетки самыми важными являются белки. Они очень разнообразны и по строению, и по функциям. Содержание белков в различных клетках может колебаться от 50 до 80%. Белки представляют собой высокомолекулярные (молекулярная масса до 1,5 млн углеродных единиц) органические соединения. Кроме С, О, Н, N, в состав белков могут входить S, Р, Fe. Белки построены из мономеров, которыми являются аминокислоты. Поскольку в состав молекул белков может входить большое число аминокислот, то их молекулярная масса бывает очень большой.
В клетках разных живых организмов встречается свыше 170 различных аминокислот, но бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Из них может быть образовано 2 432 902 008 176 640 000 комбинаций, т. е. различных белков, которые будут обладать совершенно одинаковым составом, но различным строением. Но и это огромное число не предел — белок может состоять и из большего числа аминокислотных остатков, и, кроме того, каждая аминокислота может встречаться в белке несколько раз.
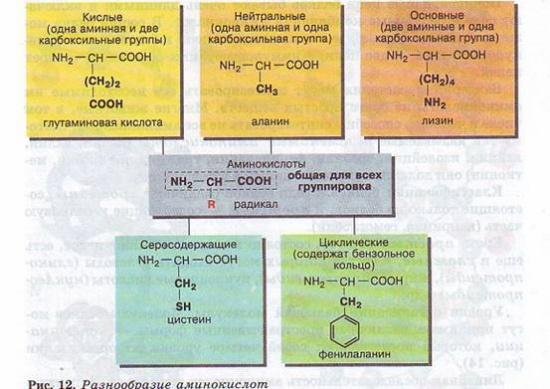
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (—Nh3) с основными свойствами, другая — карбоксильной группой (—СООН) с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение (рис. 12).
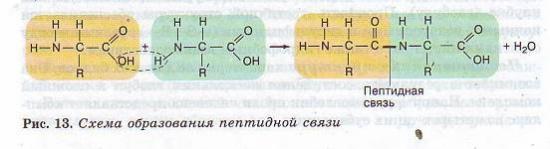
Наличие в одной молекуле аминокислоты и основной, и кислотной групп обусловливает их амфотерность и высокую реактивность. Через эти группы происходят соединения аминокислот при образовании белка. В ходе реакции полимеризации выделяется молекула воды, а освободившиеся электроны образуют ковалентную связь, которая получила название пептидной — образуется пептид (греч. peptos — сваренный). К свободным карбоксильной и аминогруппе могут присоединяться другие аминокислоты, удлиняя «цепь», называющуюся полипептидной. На одном конце такой цепи всегда будет группа МН2 (этот конец называется N-концом), а на другом конце — группа СООН (этот конец получил название С-конца) (рис. 13).
Полипептидные цепи белков бывают очень длинными и включают самые различные комбинации аминокислот. В состав белка может входить не одна, а две полипептидные цепи и более. Так, в молекуле инсулина — две цепи, а иммуноглобулины состоят из четырех цепей.
Бактерии и растения могут синтезировать все необходимые им аминокислоты из более простых веществ. Многие животные, в том числе и человек, способны синтезировать не все аминокислоты, поэтому так называемые незаменимые аминокислоты (лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, тирозин, метионин) они должны получать с пищей в готовом виде.
Классификация белков.
Среди белков различают протеины, состоящие только из белков, и протеиды — содержащие небелковую часть (например, гемоглобин).
Кроме простых белков, состоящих только из аминокислот, есть еще и сложные, в состав которых могут входить углеводы (гликопротеиды), жиры (липопротеиды), нуклеиновые кислоты (нуклеопротеиды) и др.
Уровни организации белковой молекулы.
Молекулы белков могут принимать различные пространственные формы — конформации, которые представляют собой четыре уровня их организации (рис. 14).
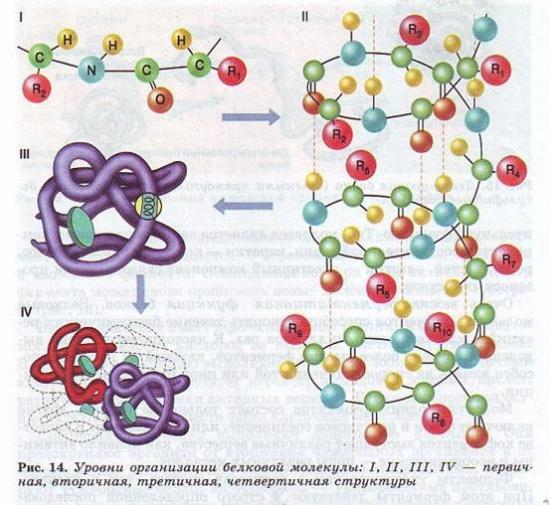
Линейная последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Она уникальна для любого белка и определяет его форму, свойства и функции.
Вторичная структура белков возникает в результате образования водородных связей между группами —СООН и —Nh3 -разных аминокислотных остатков полипептидной цепи. Хотя водородные связи малопрочные, но благодаря их значительному количеству в комплексе они обеспечивают довольно прочную структуру.
Третичная структура представляет собой причудливую, но для каждого белка специфическую конфигурацию, имеющую вид клубка (глобулу). Прочность третичной структуры обеспечивается ионными, водородными и дисульфидными ( — S-S-) связями между остатками цистеина, а также гидрофобным взаимодействием.
Четвертичная структура характерна не для всех белков.
Она возникает в результате соединения нескольких глобул в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех таких субъединиц.
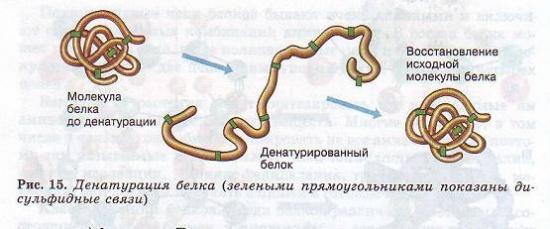
Утрата белковой молекулой своей природной структуры называется денатурацией. Она может возникать под воздействием температуры, химических веществ, обезвоживания, облучения и других факторов. Если при денатурации не нарушена первичная структура, то при восстановлении нормальных условий белок способен воссоздавать свою структуру (рис. 15). Отсюда следует, что все особенности строения макромолекулы белка определяются его первичной структурой.
Функции белков.
Белки выполняют целый ряд функций как в каждой клетке, так и в целом организме. Функции белков многообразны.
Белки являются основой всех биологических мембран, всех органоидов клетки, таким образом они выполняют структурную (строительную ) функцию.- (Рис. 15.) . Так, коллаген является важным составным компонентом соединительной ткани, кератин — компонент перьев, волос, рогов, ногтей, эластин — эластичный компонент связок, стенок кровеносных сосудов.
Очень важна ферментативная функция белков.
Белковые молекулы ферментов способны ускорять течение биохимических реакций в клетке в сотни миллионов раз. К настоящему времени выделено и изучено более тысячи ферментов, каждый из которых способен влиять на скорость течения той или иной биохимической реакции.
Молекулы одних ферментов состоят только из белков, другие включают белок и небелковое соединение, или кофермент, В качестве коферментов выступают различные вещества, как правило витамины и неорганические — ионы различных металлов.
Ферменты участвуют как в процессах синтеза, так и распада. При этом ферменты действуют в строго определенной последовательности, они специфичны для каждого вещества и ускоряют только определенные реакции. Встречаются ферменты, которые катализируют несколько реакций. Избирательность действия ферментов на разные химические вещества связана с их строением. Каталитическая активность фермента определяется не всей его молекулой, а определенным участком молекулы фермента, который называется его активным центром.
Субстрат взаимодействует с ферментом, причем связывание субстрата осуществляется именно в активном центре, Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные молекулы в силу их пространственного соответствия, они подходят друг к другу, «как ключ к замку».
На заключительном этапе химической реакции комплекс «фермент—субстрат» распадается с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр фермента может снова принимать новые молекулы вещества-субстрата (рис. 16).
Важное значение имеет транспортная функция белков.
Так, гемоглобин переносит кислород из легких к клеткам других тканей. В мышцах эту функцию выполняет белок миоглобин. Сывороточный альбумин крови способствует переносу липидов и жирных кислот, различных биологически активных веществ. Белки-переносчики осуществляют перенос веществ через клеточные мембраны. Специфические белки выполняют защитную функцию. Они предохраняют организм от вторжения чужеродных организмов и от повреждения. Так, антитела, вырабатываемые лимфоцитами, блокируют чужеродные белки; интерфероны — универсальные противовирусные белки; фибриноген, тромбин и другие предохраняют организм от кровопотери, образуя тромб.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы. Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Роль белка в жизни клетки огромна. Современная биология показала, что сходство и различие организмов определяются в конечном счете набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Белки. Протеины. Протеиды. Пептид. Пептидная связь. Простые и сложные белки. Первичная, вторичная, третичная и четвертичная структуры белков. Денатурация. 1. Какие вещества называются белками? 2. Что такое первичная структура белка? 3. Как образуются вторичная, третичная и четвертичная структуры белка? 4. Что такое денатурация белка? 5. По какому признаку белки делятся на простые и сложные? 6. Какие функции белков вам известны? 7. Какую роль выполняют белки-гормоны? 8. Какую функцию выполняют белки-ферменты? 9. Почему белки редко используются в качестве источника энергии?
Белок яйца является типичным протеином. Выясните, что с ним произойдет, если на него подействовать водой, спиртом, ацетоном, кислотой, щелочью, растительным маслом, высокой температурой и т. д.
1. Измельчите клубень сырого картофеля до состояния кашицы. Возьмите три пробирки и в каждую положите небольшое количество измельченного картофеля.
Первую пробирку поместите в морозилку холодильника, вторую — на нижнюю полку холодильника, а третью — в банку с теплой водой (t = 40 °С). Через 30 мин достаньте пробирки и в каждую капните небольшое количество пероксида водорода. Пронаблюдайте, что будет происходить в каждой пробирке. Объясните полученные результаты.
Возьмите три пробирки и в каждую из них положите небольшое количество измельченного сырого картофеля. В первую пробирку с картофелем капните несколько капель воды, во вторую — несколько капель кислоты (столовый уксус), а в третью — щелочи. Пронаблюдайте, что будет происходить в каждой пробирке. Объясните полученные результаты. Сделайте выводы. Ферменты значительно превосходят другие катализаторы по специфичности, каталитической активности и способны действовать в мягких условиях (невысокие температуры, нормальное давление и т.д.). Они способны в течение миллисекунд обеспечить протекание сложных многостадийных реакций, для проведения которых химику в современной лаборатории потребовались бы дни, недели или даже месяцы. Например, одна молекула фермента каталазы расщепляет в 1 мин более 5 млн молекул пероксида водорода (Н2О2), который образуется в организме при окислении различных соединений. Так как молекулы белков, построенные из аминокислот, необычайно велики и сложны, то для их изображения используют специальную общепринятую символику. Каждая аминокислота обозначается тремя латинскими буквами. Многие живые организмы способны вырабатывать одни аминокислоты из других и поэтому им не очень важно, какие аминокислоты содержатся в белках пищи. Но некоторые животные, в том числе человек, должны получать подавляющее число аминокислот с пищей, так как ряд аминокислот, называемых незаменимыми, в их организме не вырабатывается, но они необходимы для жизнедеятельности.
Белки Общая характеристика и функции белков
Белки — важнейшие природные соединения живой клетки как растительной, так и животной.
Основные функции белков в растительном организме те же, что и в животном.
Структурная. Белки участвуют в построении всех клеточных органелл.
Каталитическая. Все ферменты — белки.
Регуляторная. Например, гистоный ряд негистоновых белков регулируют транскрипцию.
Механо-химическая. Белки участвуют в осуществлении движений цитоплазмы и других клеточных органелл.
Транспортная. Белки-переносчики транспортируют различные вещества как через плазматическую мембрану, так и внутри клетки.
Защитная. Например, гидролитические ферменты лизосом и вакуолей расщепляют вредные вещества, попавшие в клетку. Кроме того, гликопротеины участвуют в защите растений от патогенов.
Запасная. Эта функция характерна в основном для растений. Запасные белки откладываются в семенах и используются для питания проростков в процессе прорастания.
В настоящее время функции многих белков еще не выяснены. Кроме того, один белок может выполнять две или более функций. Например, некоторые белки мембран могут выполнять структурную и ферментативную функции.
Как правило, содержание белков в растениях ниже, чем у животных. В вегетативных органах количество белка обычно 5-15% от сухой массы. Так, в листьях тимофеевки содержится 7% белка, а в листьях клевера и вики — 15%. Больше белка в семенах: у злаков в среднем 10-20%, у бобовых и масличных — 25-35%.
Наиболее богаты белком семена сои — до 40%, а иногда и выше. В растительных клетках белки обычно связаны с углеводами, липидами и другими соединениями, а также с мембранами. Поэтому их трудно извлекать из растений и получать чистые препараты, особенно из вегетативных органов. В связи с этим в растениях лучше изучены белки семян, где их больше и откуда они легче извлекаются.
Растительные белки по своим свойствам, молекулярной массе и структуре молекул близки к белкам животного происхождения.
Мономерами белков являются аминокислоты. В составе белков как растительных, так и животных, найдено 20 аминокислот:
В растениях, кроме 20 перечисленных выше, обнаружено большое количество аминокислот (свыше 250), которые не входят в состав белковых молекул, а содержатся только в свободном состоянии или встречаются в составе коротких пептидов. Их называют не протеиногенными. Эти аминокислоты присутствуют в растениях в небольших количествах и обычно характерны для небольшой группы растений (семейство, род).
Пептиды, или полипептиды,— это цепочки из нескольких аминокислот, связанных пептидными связями. В состав пептидов могут входить не только протеиногенные, но и непротеиногенные аминокислоты.
Пептиды играют важную роль промежуточных продуктов в обмене веществ, и многие из них являются физиологически очень активными соединениями. Пептидами являются некоторые антибиотики (грамицидин, лихениформин), гормоны (инсулин, окситацин, вазопрессин), токсины (аманитины). Некоторые пептиды представляют собой замкнутую полипептидную цепочку, т. е. являются циклопептидами, а некоторые даже имеют бициклическое строение. Среди циклопептидов есть сильно токсичные вещества. Например, ядовитый гриб бледная поганка (Amanita phalloides) содержит по крайней мере 10 токсичных циклопептидов — аманитинов. Все они имеют молекулярную массу около 1000.

Добавить комментарий