Соли в химии ⚗️ определение, классификация, структурные формулы, виды, химические и физические свойства, получение и применение, номенклатура, с чем взаимодействуют

Общие сведения
Все соли имеют сложный химический состав и в зависимости от него могут быть органическими или неорганическими. В теоретической химии существует несколько определений этой группы веществ:
- являющиеся результатом взаимодействия оснований и кислот;
- соединения, образованные одним или несколькими кислотными остатками и ионом металла;
- при электролитической диссоциации — состоящие из катионов и анионов.

Кроме металлов, к кислотным остаткам могут присоединяться ионы аммония (Nh5)+, гидроксония (Н3О)+, фосфония (РН4)+ и некоторые другие. С физической точки зрения чаще всего соли — это твердые кристаллические вещества. Встречаются вещества разной окраски. Прозрачные единичные кристаллы в большом количестве имеют белый цвет, например, поваренная соль NaCl.
Их строение представляет собой кристаллическую решетку, в узлах которой находятся анионы, а катионы занимают пространство между узлами. Другое распространенное строение — анионные фрагменты из кислотных остатков, соединенные в бесконечную цепочку, в трехмерных полостях которых находятся катионы. Такую структуру имеют силикаты, что отражается и на их свойствах: высокая температура плавления и неспособность проводить электрический ток.
Кроме ионных, в молекулах солей встречаются и молекулярные ковалентные связи, и промежуточные между ковалентными и ионными. В особую группу солей выделяются так называемые ионные жидкости, температура плавления которых ниже 100 °C, отличающиеся повышенной вязкостью.
Для изучения химических и физических свойств этой группы соединений важным критерием служит их растворимость в воде: полностью, частично или нерастворимые.
Классификация и номенклатура
Основные классы этой группы веществ были описаны французским химиком и аптекарем Г. Руэлем еще в 1754 году, а по мере развития химии к ним добавились новые. Главный принцип классификации солей основан на том, что при взаимодействии металла и кислоты в ней происходит частичное или полное замещение атомов водорода.
Общие характеристики
Формулы солей всегда образуются одним или несколькими металлами, кислотными остатками и гидроксильными группами. В зависимости от этого все солевые соединения делят на такие классы:

- Средние.
- Кислые.
- Основные.
- Двойные или смешанные.
- Комплексные.
- Кристаллогидраты.
Средними считаются те, у которых все атомы водорода образующей кислоты заменены атомами металла. К такому типу соединений относятся и те, в которых водород замещается одновалентной группой аммония Nh5. Согласно принятой номенклатуре, названия этих веществ образуются из латинского названия кислотного остатка и русского названия металла. Кислородосодержащие остатки оканчиваются на «ат», бескислородные — на «ид». Например:
- Na2CO3 — карбонат натрия.
- NaCl — хлорид натрия.
- KNO3 — нитрат калия.
Если одному химическому элементу соответствует не одна кислота, то может использоваться и окончание «ит». Это относится к таким кислотам, как серная h3SO4 (сульфаты) и сернистая h3SO3 (сульфиты).
Кислые вещества образуются только от двух- или полиосновных кислот: серной, фосфорной, угольной. Они относятся к неустойчивым соединениям и при нагревании происходит их разложение на составляющие элементы. В названии таких веществ всегда используют приставку «гидро», а если незамещенных атомов водорода осталось два — приставку «ди»:
- NaHSO4 — гидросульфат натрия.
- CaHPO4 — гидрофостфат кальция.
- Kh3PO4 — дигидрофосфат калия.

Образование основных солей происходит при частичном замещении гидроксильных групп кислотными остатками, причем валентность основного остатка всегда будет равна числу замещенных гидроксильных групп. Номенклатура названий таких химических соединений образуется в зависимости от количества гидроксогрупп приставками «гидроксо» и «дигидроксо»:
- Аl (OH)SO4 — гидроксосульфит алюминия.
- Cu (OH)Cl — гидроксохлорид меди.
- Fe (OH)2NO3 — дигидроксохлорид железа.
В двойных солях атомы водорода замещаются двумя разными металлами, соответственно и образовываться могут только от двух и более основных кислот: MgK (SO4)2, NaKCO3, KAl (SO4)2.
Комплексные соединения и кристаллогидраты
Этот класс химических соединений отличается большим разнообразием. В изучении комплексных солей (КС) большую роль сыграли швейцарский ученый А. Вернер и русский химик немецкого происхождения В. Освальд. КС состоят из комплексных частиц. Центральный элемент в комплексе называется комплексообразователем, а связанные с ним элементы — лигандами. Их число — это координационное число соединения. Лигандами могут быть как нейтральные молекулы, так и разнообразные ионы и катион водорода H+.
КС так и классифицируются на нейтральные, анионные и катионные. Разными лигандами образуются такие группы химических веществ:
- амиакаты, в которых с комплексообразователем связаны молекулы аммиака — [Co (Nh4)6]Cl3;
- аквакомплексы, образованные лигандами воды — [Al (h3O)6]Cl3;
- ацидокомплексы, включающие кислотные остатки — K2[PtCl4].

Кристаллы, образующиеся в водном растворе при выпадении в осадок солей, называются кристаллогидратами. При этом между молекулами воды и солевыми ионами формируются прочные связи, образующие кристаллическую решетку. Химические формулы кристаллогидратов записывают в виде количественного соотношения соли и воды, разделенных точкой — Na2SO4⋅10h3O. В номенклатуре для обозначения количества воды употребляются греческие числа — ди, три, тетра, гекса и так далее, с которых и начинается название. Число выступает приставкой к слову «гидро», а затем следует стандартное название соли: CaSO4⋅2h3O — дигидрат сульфата кальция.
Исторические наименования
Названия химических веществ соответствуют международной системе правил, позволяющей давать им названия, по которым можно правильно составить их формулу. Многие соединения солевой группы давно и хорошо известны, и в процессе их использования химики много лет назад уже как-то называли их. Традиционные или тривиальные названия полезно знать любому человеку. Их список приведен в таблице:
| Соль | Номенклатурное название | Тривиальное название |
| CuSO4⋅5h3O | Пентагидрат сульфата меди | Медный купорос |
| CaCO3 | Карбонат кальция | Известняк |
| AgNO3 | Нитрат серебра | Ляпис |
| NaHCO3 | Гидрокарбонат натрия | Питьевая сода |
| K2СO3 | Карбонат калия | Поташ |
| HgCl2 | Хлорид ртути | Сулема |
| Na2SiO3 | Силикат натрия | Жидкое стекло |
Это далеко не полный перечь общеизвестных наименований. Какой-либо системе они не подчиняются, и тем, кто изучает химию, их надо просто запомнить.
Химические свойства

Соли как химические соединения проявляют разные свойства в зависимости от их структурного состава. В водных растворах могут диссоциировать на анион металла и катион кислотного остатка. Степень диссоциации зависит от того, какую способность растворяться имеют разные виды солей: растворимые диссоциируют полностью, нерастворимые — частично или не диссоциируют. Ход такой реакции зависит от вида соли: средние, двойные и комплексные распадаются на ионы одномоментно, а кислые и основные — ступенчато. Примеры:
- Хлорид натрия: NaCl ↔ (Na+) + (Cl-).
- Сульфат калия-натрия: КNaSO4 ↔ (К+) + (Na+) + (SO42-).
- Хлорид-бромид кальция: CaClBr ↔ (Ca2+) + (Cl -)+ (Br-).
- Гидросульфат калия: КHSO4 ↔ (К+) + (НSO4-), а затем (HSO4-) ↔ (H+) + (SO42-).
- Гидроксохлорид железа: FeOHCl ↔ (FeOH+) + (Cl-), а затем (FeOH+) ↔ (Fe2+) + (OH-).
Некоторые соли под действием температуры могут разлагаться. Например, при нагревании из карбоната кальция СаСO3 получается оксид кальция СаO и кислотный оксид СО2. Солевые вещества, образованные от бескислородных кислот, разлагаются на простые элементы: хлорид серебра AgCl распадается на серебро Ag с выделением хлора Cl. Если солеобразующим соединением выступает кислота с сильными окислительными свойствами, то разложения до простых элементов не происходит: 2КNO3 → 2КNO2 + O2.
Взаимодействие с оксидами и кислотами

Соли реагируют путем сплавления с кислотными или амфотерными оксидами. При этом образуется новое солевое соединение, а оксиды замещаются менее летучими. С основными оксидами такая реакция не происходит. Например, карбонат калия K2CO3 сплавляется с оксидом кремния (IV) SiO2 с образованием силиката калия KSiO3 и выделением углекислого газа CO2: K2CO3 + SiO2 → KSiO3 + CO2↑. K2CO3 может взаимодействовать и с оксидом алюминия, при этом получается алюминат калия KAlO2 и углекислый газ CO2: K2CO3 + Al2O3 → 2KAlO2 + CO2↑.
Взаимодействие с кислотами может происходить только в том случае, если в реакцию вступает кислота и соль, образованная более слабой кислотой. Показателем возможного совместного реагирования солей с кислотами могут быть предполагаемые:
- осадок;
- вода;
- газообразное вещество;
- слабый электролит.
Например, нерастворимое соединение угольной кислоты карбонат магния MgCO3 вступает в реакцию с сильной серной кислотой: MgCO3 + h3SO4 → MgSO4 + 2h3O + CO2. Растворимый силикат калия как производное кремниевой кислоты может взаимодействовать с соляной кислотой, потому что в ходе реакции ожидается получение нерастворимой кремниевой кислоты: K2SiO3 + 2HCl → h3SiO3↓ + 2KCl.
Реакции с основаниями и другими солями
Со щелочами взаимодействуют в основном только соли аммония и тяжелых металлов, если при этом они относятся к растворимым. В результате получают новое солевое вещество и новое основание. Например, в реакцию с гидроксидом калия KOH вступает сульфат меди (II) CuSO4, в результате чего образуется сульфат калия K2SO4, а гидроксид меди Cu (OH) выпадает в осадок: 2KOH + CuSO4 → K2SO4 + Cu (OH)2.

Взаимодействие хлорида аммония с гидроксидом натрия описывается таким уравнением (Nh5)2SO4 + 2KOH → 2h3O + K2SO4 + 2Nh4↑. Если воздействовать основанием на кислую соль, то в результате получится средняя соль и вода. Например, гидрокарбонат натрия NaHCO3 взаимодействует с гидроксидом натрия NaOH: NaHCO3 + NaOH → Na3CO3 + h3O.
Реакции между солями возможны только в случае хорошей растворимости обоих веществ, при этом образуются две новые соли. С нерастворимым соединением взаимодействие не случается. Некоторые вещества, относящиеся к кислым, реагируют со слабокислыми солями и со своими средними соединениями.
Получение и применение
Многие соединения солей всех видов встречаются в виде залежей минеральных пород и рассолов. Например: известняк, разные виды селитры, поваренная и калийная соли, сильвин, карналлит, натрон, мирабилит и многие другие. Условно все способы получения солевых веществ разделяют на физическую переработку сырья (выпаривание, кристаллизация, флотация и тому подобное) и извлечение их из полупродуктов, отходов других производств и минералов химическими способами, основанными на свойствах солей.
Больше всего химическая промышленность выпускает солей для сельского хозяйства, причем они используются как в качестве удобрений для хорошего роста растений и повышения урожайности, так и для их защиты от сорняков и вредителей. Минеральные соли используют и как сырье для производства самых разнообразных химических веществ, применяемых в таких отраслях:

- производство целлюлозы и бумаги;
- лакокрасочная промышленность;
- моющие средства;
- стекловарение;
- обработка кожи.
В качестве присадок и плавней соли применяются в металлургии для обогащения руд и при выплавке металлов. Производство цемента, одного из самых важных для строительной промышленности компонента, невозможно без известняка. Соли хрома используются при изготовлении огнеупорных материалов. Весь спектр разновидностей солей применяется и в фармацевтической промышленности.
Что такое соль? Формула, свойства соли (химия) :: SYL.ru
Для того чтобы ответить на вопрос, что такое соль, обычно долго задумываться не приходится. Это химическое соединение в повседневной жизни встречается достаточно часто. Об обычной поваренной соли и говорить не приходится. Подробное внутреннее строение солей и их соединений изучает неорганическая химия.
Определение соли
Четкий ответ на вопрос, что такое соль, можно найти в трудах М. В. Ломоносова. Такое имя он присвоил хрупким телам, которые могут растворяться в воде и не воспламеняются под воздействием высоких температур или открытого огня. Позднее определение выводили не из их физических, а из химических свойств данных веществ.

Школьные учебники неорганической химии дают достаточно ясное понятие того, что такое соль. Так называются продукты замещения химической реакции, при которой атомы водорода кислоты в соединении замещаются на металл. Примеры типичных соединений солей: NaCL, MgSO4. Легко увидеть, что любую эту запись можно разделить на две половины: в левой составляющей формулы всегда будет записан металл, а в правой – кислотный остаток. Стандартная формула соли выглядит следующим образом:
MenmКислотный остатокmn.
Физические свойства соли
Химия, как точная наука, вкладывает в название того или иного вещества всю возможную информацию о его составе и возможностях. Так, все наименования солей в современной интерпретации состоят из двух слов: одна часть имеет название металлического составляющего в именительном падеже, вторая — содержит описание кислотного остатка.
Эти соединения не имеют молекулярного строения, поэтому при обычных условиях они представляют собой твердые кристаллические вещества. Многие соли обладают кристаллической решеткой. Кристаллы этих веществ тугоплавки, поэтому для их плавления нужны очень высокие температуры. Например, сульфид бария плавится при температуре около 2200о С.

По растворимости соли делятся на растворимые, малорастворимые и нерастворимые. Примером первых могут служить хлорид натрия, нитрат калия. К малорастворимым относят сульфит магния, хлорид свинца. Нерастворимые – это карбонат кальция. Информация о растворимости того или иного вещества содержится в справочной литературе.
Рассматриваемый продукт химической реакции обычно не имеет запаха и обладает разным вкусом. Предположение о том, что все соли соленые — ошибочно. Чистый соленый вкус имеет только один элемент этого класса – наша старая знакома поваренная соль. Существуют сладкие соли бериллия, горькие – магния и безвкусные – например, карбонат кальция (мел обыкновенный).
Большинство данных веществ бесцветно, но среди них имеются и такие, которые имеют характерные окрасы. Например, железа (II) сульфат отличается характерным зеленым цветом, калия перманганат – фиолетовый, а кристаллы хромата калия – ярко-желтые.

Классификация соли
Химия разделяет все виды неорганических солей на несколько основных признаков. Соли, получающиеся при полном замещении водорода в кислоте, называют нормальными или средними. Например, сульфат кальция.
Соль, которая является производной от реакции неполного замещения, называется кислой или основной. Примером такого образования может быть реакция гидросульфата калия:
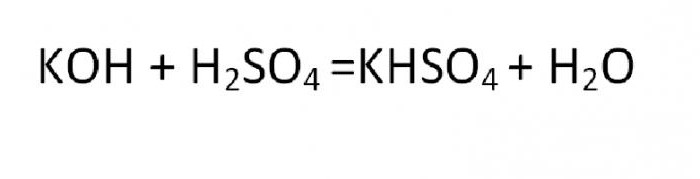
Основная соль получается при такой реакции, в которой гидроксогруппа не полностью замещается на кислотный остаток. Вещества данного вида могут быть образованны теми металлами, чья валентность равна двум или больше. Типичная формула соли этой группы может быть выведена из такой реакции:
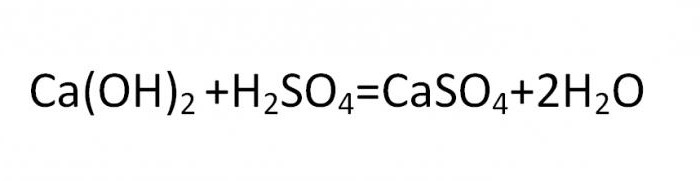
Нормальные, средние и кислые химические соединения образуют классы солей и являются стандартной классификацией этих соединений.
Двойная и смешанная соль
Химия неорганических веществ показывает, что данный продукт может быть образован двумя металлами и одной кислотой. В этом случае кислота должна иметь основность больше или равной 2. Такое соединение называют двойная соль. Химические соли этой группы – алюмокалиевые квасцы, их еще называют сульфат калия-алюминия.
Примером смешанной является кальциевая соль соляной и хлорноватистой кислоты: CaOCl2.
Номенклатура
Соли, образованные металлами с переменной валентностью, имеют дополнительное обозначение: после формулы в скобках пишут римскими цифрами валентность. Так, существует сульфат железа FeSO4 (II) и Fe2 (SO4)3 (III). В названии солей имеется приставка гидро-, если в ее составе существуют незамещенные атомы водорода. Например, гидрофосфат калия обладает формулой K2HPO4 .
Свойства солей в электролитах
Теория электролитической диссоциации дает собственное толкование химическим свойствам. В свете этой теории соль может быть определена как слабый электролит, который в растворенном виде диссоциирует (распадается) в воде. Таким образом, раствор соли можно представить как комплекс положительных отрицательных ионов, причем первые – это не атомы водорода Н+, а вторые – не атомы гидроксогруппы ОН—. Ионов, которые присутствовали бы во всех видах растворов солей, не существует, поэтому какими-либо общими свойствами они не обладают. Чем меньше заряды ионов, образующих раствор соли, тем лучше они диссоциируют, тем лучше электропроводимость такой жидкой смеси.
Растворы кислых солей
Кислые соли в растворе распадаются на сложные отрицательные ионы, представляющие собой кислотный остаток, и простые анионы, являющиеся положительно заряженными частицами металла.
 Например, реакция растворения гидрокарбоната натрия ведет к распаду соли на ионы натрия и остаток НСО3—.
Например, реакция растворения гидрокарбоната натрия ведет к распаду соли на ионы натрия и остаток НСО3—.Полная формула выглядит таким образом: NaHCO3 = Na+ + HCO3—,HCO3 — = H+ + CO32-.
Растворы основных солей
Диссоциация основных солей ведет к образованию анионов кислоты и сложных катионов, состоящих из металлов и гидроксокрупп. Эти сложные катионы, в свою очередь, также способны распадаться в процессе диссоциации. Поэтому в любом растворе соли основной группы присутствуют ионы ОН— . Например, диссоциация хлорида гидроксомагния протекает следующим образом:
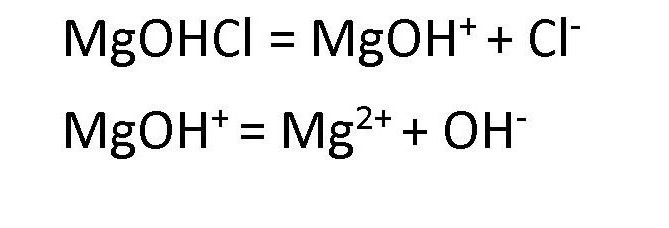
Распространение солей
Что такое соль? Этот элемент является одним из самых распространенных химических соединений. Всем известны поваренная соль, мел (карбонат кальция) и прочее. Среди солей карбонатной кислоты самым распространенным является карбонат кальция. Он является составной частью мрамора, известняка, доломита. А еще карбонат кальция — основа для формирования жемчуга и кораллов. Это химическое соединение является неотъемлемой составляющей для формирования твердых покровов у насекомых и скелетов у хордовых животных.
Поваренная соль известна нам с детства. Врачи предостерегают от ее чрезмерного употребления, но в умеренных количествах она крайне необходима для осуществления жизненных процессов в организме. А нужна она для поддержания правильного состава крови и вырабатывания желудочного сока. Физрастворы, неотъемлемая часть инъекций и капельниц, есть не что иное, как раствор поваренной соли.
Свойства гималайской соли и химический состав
Химический анализ гималайской соли. Полный состав и свойства соли.
По составу гималайская соль является самой насыщенной солью в природе. В ее состав входит более 80-ти составляющих — этим обусловлены ее уникальные свойства и целебные качества.
В Австрии институтом University of Graz в 2001 г. были проведены исследования на тему изучения свойств розовой соли из Гималаев. 50 добровольцев в ежедневно в течении месяца пили слабый раствор гималайской соли (1 чайная ложка на 200 граммовый стакан чистой воды). Заключение по исследованию: Исследование показало, что гималайская розовая соль — эффективный продукт для нормализации минерализации в организме. Она также показала свою эффективность в стабилизации уровня рН (повышенный или пониженный pH крови напрямую влияет на работу всех органов — начиная от желудочно-кишечного тракта и заканчивая легкими и сердцем) и оксидативного стресса (или нарушения обмена веществ — это химические реакции в организме отвечающие за питание и очищение клеток) в организме. Показатели гидратации увеличились за время теста в среднем на десять процентов. Правильная гидрация предотвращает образование камней в почках, инфекции мочевыводящих путей, запоры и др.
Другими словами — гималайская соль положительно воздействует да процессы в организме. Побочных эффектов не замечено.
Краткий состав гималайской соли
| Элементы | Процент вхождения | Описание |
| Натрий Na+ | 38% | Совместно с калием и хлором натрий является связующим звеном в процессе регуляции обмена воды и соли, наряду с магнием, кальцием и калием — участвует в нейтрализации кислот, поддерживает в норме осмотическое давление. Натрий участвует в процессах регуляции кровяного давления и механизмах мышечного сокращения, а также поддерживает нормальный ритм сердцебиения, повышает выносливость тканей. |
| Хлор Cl- | 59% | В природе он встречается только в виде соединений в составе минералов: галита NaCl (гималайская соль) и др. минералов. В организме человека и животных хлор играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток. |
| Сера, Калий, Кальций и более 80-ти др. элементов | 3% | Данные 3% элементов невероятно важны для усвоения организмом Натрия и Хлора. Без этих элементов Натрий и Хлор усваиваются с огромными энергетическими затратами организма или не усваиваются вовсе откладываясь в тканях. Присутствие этих микроэлементов — это основное и принципиальное отличие гималайской от обычной поваренной соли. Более детально ознакомиться можно в материале сравнение гималайской и поваренной солей. |
Полное исследование свойств можно найти в книге Water & Salt: The Essence of Life (авторы Dr. Barbara Hendel and Peter Ferreira) на Англ.
Химическая формула соли NaCl, плюс дополнительные микроэлементы (см. таблицу), добывается гималайская соль без термообработки — позволяя тем самым сохранить весь спектр полезных минеральных веществ.
Ниже представлен полный анализ гималайской соли.
Гималайская розовая соль — свойства и состав
| Название элемента | Обозначение | Порядковый номер | Значение | Тип анализа |
| Водород | H | 1 | 0.30 г/кг | DIN |
| Литий | Li | 3 | 0.40 г/кг | AAS |
| Бериллий | Be | 4 | <0.01 ppm | AAS |
| Бор | B | 5 | <0.001 ppm | FSK |
| Углерод | C | 6 | <0.001 ppm | FSK |
| Азот | N | 7 | 0.024 ppm | ICG |
| Кислород | O | 8 | 1.20 г/кг | DIN |
| Фторид | F- | 9 | <0.1 г/кг | Потенциометрия |
| Натрий | Na+ | 11 | 382.61 г/кг | FSM |
| Магний | Mg | 12 | 0.16 г/кг | AAS |
| Алюминий | Al | 13 | 0.661 ppm | AAS |
| Кремний | Si | 14 | <0.1 г/кг | AAS |
| Фосфор | P | 15 | <0.10 ppm | ICG |
| Сера | S | 16 | 12.4 г/кг | TXRF |
| Хлор | Cl- | 17 | 590.93 г/кг | Гравиметрия |
| Калий | K+ | 19 | 3.5 г/кг | FSM |
| Кальций | Ca | 20 | 4.05 г/кг | Титрование |
| Скандий | Sc | 21 | <0.0001 ppm | FSK |
| Титан | Ti | 22 | <0.001 ppm | FSK |
| Ванадий | V | 23 | 0.06 ppm | AAS |
| Хром | Cr | 24 | 0.05 ppm | AAS |
| Марганец | Mn | 25 | 0.27 ppm | AAS |
| Железо | Fe | 26 | 38.9 ppm | AAS |
| Кобальт | Co | 27 | 0.60 ppm | AAS |
| Никель | Ni | 28 | 0.13 ppm | AAS |
| Медь | Cu | 29 | 0.56 ppm | AAS |
| Цинк | Zn | 30 | 2.38 ppm | AAS |
| Галлий | Ga | 31 | <0.001 ppm | FSK |
| Германий | Ge | 32 | <0.001 ppm | FSK |
| Мышьяк | As | 33 | <0.01 ppm | AAS |
| Селен | Se | 34 | 0.05 ppm | AAS |
| Бром | Br | 35 | 2.1 ppm | TXRF |
| Рубидий | Rb | 37 | 0.04 ppm | AAS |
| Стронций | Sr | 38 | 0.014 г/кг | AAS |
| Иттербий | Y | 39 | <0.001 ppm | FSK |
| Цирконий | Zr | 40 | <0.001 ppm | FSK |
| Ниобий | Nb | 41 | <0.001 ppm | FSK |
| Молибден | Mo | 42 | 0.01 ppm | AAS |
| Технеций | Tc | 43 | неустойчивый | изотоп — не включен |
| Рутений | Ru | 44 | <0.001 ppm | FSK |
| Родий | Rh | 45 | <0.001 ppm | FSK |
| Палладий | Pd | 46 | <0.001 ppm | FSK |
| Серебро | Ag | 47 | 0.031 ppm | AAS |
| Кадмий | Cd | 48 | <0.01 ppm | AAS |
| Индий | In | 49 | <0.001 ppm | FSK |
| Олово | Sn | 50 | <0.01 ppm | AAS |
| Сурьма | Sb | 51 | <0.01 ppm | AAS |
| Теллур | Te | 52 | <0.001 ppm | FSK |
| Йод | I | 53 | <0.1 г/кг | Потенциометрия |
| Цезий | Cs | 55 | <0.001 ppm | FSK |
| Барий | Ba | 56 | 1.96 ppm | AAS/TXR |
| Лантан | La | 57 | <0.001 ppm | FSK |
| Церий | Ce | 58 | <0.001 ppm | FSK |
| Празеодимий | Pr | 59 | <0.001 ppm | FSK |
| Неодим | Nd | 60 | <0.001 ppm | FSK |
| Прометий | Pm | 61 | неустойчивый | изотоп — не включен |
| Самарий | Sm | 62 | <0.001 ppm | FSK |
| Европий | Eu | 63 | <3.0 ppm | TXRF |
| Гадолиний | Gd | 64 | <0.001 ppm | FSK |
| Тербий | Tb | 65 | <0.001 ppm | FSK |
| Диспрозий | Dy | 66 | <4.0 ppm | TXRF |
| Гольмий | Ho | 67 | <0.001 ppm | FSK |
| Эрбий | Er | 68 | <0.001 ppm | FSK |
| Тулий | Tm | 69 | <0.001 ppm | FSK |
| Иттербий | Yb | 70 | <0.001 ppm | FSK |
| Лютеций | Lu | 71 | <0.001 ppm | FSK |
| Гафний | Hf | 72 | <0.001 ppm | FSK |
| Тантал | Ta | 73 | 1.1 ppm | TXRF |
| Вольфрам | W | 74 | <0.001 ppm | FSK |
| Рений | Re | 75 | <2.5 ppm | TXRF |
| Осмий | Os | 76 | <0.001 ppm | FSK |
| Иридий | Ir | 77 | <2.0 ppm | TXRF |
| Платина | Pt | 78 | 0.47 ppm | TXRF |
| Золото | Au | 79 | <1.0 ppm | TXRF |
| Ртуть | Hg | 80 | <0.03 ppm | AAS |
| Таллий | Ti | 81 | 0.06 ppm | AAS |
| Свинец | Pb | 82 | 0.10 ppm | AAS |
| Висмут | Bi | 83 | <0.10 ppm | AAS |
| Полоний | Po | 84 | <0.001 ppm | FSK |
| Астат | At | 85 | <0.001 ppm | FSK |
| Франций | Fr | 87 | <1.0 ppm | TXRF |
| Радий | Ra | 88 | <0.001 ppm | FSK |
| Актиний | Ac | 89 | <0.001 ppm | FSK |
| Торий | Th | 90 | <0.001 ppm | FSK |
| Протактиний | Pa | 91 | <0.001 ppm | FSK |
| Уран | U | 92 | <0.001 ppm | FSK |
| Нептуний | Np | 93 | <0.001 ppm | FSK |
| Плутоний | Pu | 94 | <0.001 ppm | FSK |
Дополнительные элементы гималайской соли
| Вода | h3O | 1.5 г/кг | DIN |
| Аммоний | Nh5+ | 0.010 ppm | Фотометрия |
| Нитрат | NO3- | 0.09 ppm | Фотометрия |
| Фосфаты | PO43- | <0.10 ppm | ICG |
| Гидрокарбонат | HCO3- | <1.0 г/кг | Титрование |
Инертные газы Гелий-He-2, Неон-Ne-10, Аргон-Ar-18, Криптон-Kr-36, Ксенон-Xe-54, и Радон-Rn-86 не могли быть включены в исследование. Многие элементы не могут быть определены обычными химическими анализами.
Химический анализ гималайской розовой соли подтвердил содержание в ней хлорида натрия 97,41%, что соответствует мировым стандартам необходимым для поваренной соли.
г/кг — Грамм на килограмм
DIN — Немецкий институт стандартов
ICG — Ионная хроматография
AAS — Атомно-абсорбционная спектрометрия
TXRF — рентгено-флуоресцентная спектрометрия
ppm — Частей на миллион
FSM — Пламя спектрометрия
FSK — Спектроскопия
Сайт учителей биологии МБОУ Лицей № 2 города Воронежа
Неорганические вещества клетки. Минеральные соли
Минеральные соли могут содержаться в организме в растворенном виде (диссоциированными на ионы) или в нерастворимом виде.
Важную роль в жизнедеятельности клетки играют растворимые минеральные соли, представленные в основном катионами К+, Na+, Ca2+, Mg2+ и анионами НРО42-, Н2РО4-, Сl—, НСO3-.
Многие ионы неравномерно распределены между клеткой и окружающей средой. Именно благодаря существованию подобных градиентов концентраций осуществляются многие важные процессы жизнедеятельности, такие, например, как возбуждение нервных клеток и сокращение мышечных волокон.
На внешней клеточной мембране высокая концентрация ионов Na+, а на внутренней — ионов К+. Этот факт обуславливает передачу возбуждения по нервам и мышце. Са+2, Mg+2 являются активаторами многих ферментов, если их недостаточно, то нарушается процесс обмена веществ. Mg+2 поддерживает целостность рибосом, работу митохондрий. Са3(РО4)2 есть в составе костей, а СаСО3 — в составе раковин моллюсков.
Ионы растворимых солей Na+, K+, Cl— Mg2+, SO42- в организме человека и животных выполняют ряд важных функций:
- создают условия для передачи нервных импульсов;
- регулируют проницаемость мембран;
- участвуют в мышечных сокращениях;
- поддерживают осмотическое давление крови и нормализуют водный баланс;
- регулируют кислотно-щелочной баланс;
- усиливают действие желудочных соков, участвуют в формировании кислых и щелочных ферментов.
Анионы слабых кислот участвуют в поддержании кислотно-щелочного баланса (рН) клетки. Анионы фосфорной кислоты необходимы для синтеза главной энергетической молекулы — АТФ, нуклеотидов и нуклеиновых кислот (ДНК и РНК).
От концентрации солей внутри клетки зависят буферные свойства, то есть способность поддерживать слабощелочную среду. Внутри клетки буферность обеспечивается анионами Н2РО4—, во внеклеточной жидкости и в крови роль буфера играют НРО4-2, НСО3—.
Неорганические соли — KNO3, CaSO4, Na3PO4 — служат важными компонентами минерального питания растений.
| Роль | Пояснение | Примеры |
|---|---|---|
| Создание осмотического баланса | Состав минеральных солей и их концентрация определяют осмотическое давление жидкостей внутри клеток и полостей тела. Благодаря осмотическому давлению формируется гидроскелет беспозвоночных и тургор растений | Na+, K+, Ca2+, Mg2+, Cl—, HCO3—, H2PO4—, HPO42-, SO42- |
| Поддержание буферных свойств | Буферность — способность поддерживать рН на определенном уровне. За поддержание рН клеток и тканей отвечают фосфатная и бикарбонатная буферные системы | HPO42- + H+ ↔ H2PO4—; HCO3— + H+ ↔ H2CO3 |
| Поддержание градиентов концентраций | В клетке и межклеточном пространстве поддерживаются определенные концентрации ионов. Благодаря существованию градиентов концентраций осуществляются такие важные процессы жизнедеятельности, как возбуждение нервных клеток и сокращение мышечных волокон | Na+, K+, Ca2+, Cl— |
| Формирование скелетных образований | Кости скелета позвоночных в основном состоят из фосфатов кальция и магния. Раковины моллюсков формируются из карбоната кальция | Ca2+, Mg2+, PO43-, CO32- |
| Передача нервных импульсов | Участвуют в работе химических синапсов | Ca2+, К+, Na+, Cl— |
< Предыдущая страница «Неорганические вещества клетки. Вода»
Следующая страница «Органические вещества. Общая характеристика. Липиды» >
Соли: классификация и химические свойства
Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
 Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO3, KAl(SO4)2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl3)2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH2PO4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
 Химические свойства солей
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
Остались вопросы? Хотите знать больше о солях?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
химическая формула, плотность и другие характеристики, применение каменной соли
Происхождение галита можно сравнить с процессами зарождения жизни на нашей планете, так как соль является важнейшим компонентом морской воды. Термин имеет древнегреческое происхождение и означает «морская соль». Камень, как правило, имеет белый цвет. Однако в природе встречаются образцы с красными и голубыми оттенками, есть также бесцветные камни.
Значение каменной соли в жизни человека очень велико. Ее применяют в промышленных и бытовых целях, используют при лечении заболеваний. Ни одна хозяйка не обходится без соли при приготовлении пищи.
Известно, что этот минерал необходим для нормального функционирования мозга. Какими еще свойствами обладает галит? Как ухаживать за изделиями из соли?


Что такое галит, как он выглядит?
Как выглядит галит, знают даже дети, ведь этот минерал – не что иное, как соль. Каждый день люди добавляют эту приправу в блюда, чтобы сделать их более вкусными.
Образование минерала происходит, как правило, осадочным путем. Соль кристаллизуется из природных жидкостей. Благодаря тому, что на способность галита к растворимости не оказывает действия температура окружающей среды, он отделяется от иных видов растворенных солей.


Образование каменной соли осуществляется в морских лагунах и соленых озерах в процессе испарения влаги. Для образования крупных пластов соли толщиной в несколько сотен метров необходимо создание определенных условий в верхних слоях земной коры и преобразование осадочных пород под действием окружающих факторов.
Поваренную соль в природных условиях довольно сложно встретить в чистом виде. Присутствие инородных примесей способствует окрашиванию камней в различные цвета:
- железо дает желтоватый или красный оттенок;
- органические включения делают соль бурой или черной;
- глина в составе соляных отложений придает им серую окраску;
- сальвина окрашивает соль в синие оттенки.


Физические и химические характеристики минерала
В отличие от самородных минералов, таких как алмаз, состоящих из одного элемента, формула соли включает два компонента, ее химический состав представляет собой соединение NaCl, причем соотношение элементов неравное, содержание Na — примерно 39%, а Cl — около 61%. Часто можно встретить минералы с примесями, например, KCl, CaCl2 и MgCl2.
По шкале Мооса твердость соляных кристаллов равна 2, однако ее значения отличаются при нанесении царапин по ребру и по диагонали куба. Самые высокие показатели твердости отмечены у породы темно-синего оттенка.


Удельный вес галита равен 2,1-2,2 г/см3. Камни оставляют белую черту. Кристаллическая решетка, как правило, представляет собой куб, в узлах которого располагаются ионы хлора с отрицательным зарядом и ионы натрия, имеющие противоположный заряд. Структура может быть зернистой, листоватой, плотной, волокнистой, натечной. По трем направлениям граней куба в решетке отмечается совершенная спайность.
Кристаллы имеют соленый вкус и легко растворяются в воде. Однако при наличии в растворе CaCl2 и MgCl2 растворимость существенно снижается. Процесс растворения сопряжен с поглощением тепловой энергии. Галит отличается хрупкостью. Описание опытов с галитом позволяет утверждать, что его пластичность увеличивается при повышении температуры. Плавится соль при температуре 800 градусов, а при горении придает пламени желто-оранжевый оттенок.


Разновидности галита и их отличия
В зависимости от месторождения камни обладают разными физико-химическими показателями. Основываясь на этих характеристиках, галит делят на несколько разновидностей:
- Каменная соль. Этот вид представляет собой массивные скопления осадочных залежей в земных породах. Такие слои формировались в течение длительного времени в разные эпохи формирования геологических слоев.
- Самосадочная (или садочная) соль. Кристаллы такой породы формируются в эвапоритовых месторождениях. Их можно обнаружить в наиболее древних бассейнах в виде друз или небольшого мелкозернистого налета. На фото можно увидеть образец этого вида.


- Вулканический галит. Места образования этой породы связаны с вулканической активностью. Минерал залегает в остатках окаменевшей лавы и кратерах некогда действующих вулканов.
- Солончаки. Это корки, наросты или пласты соли на поверхности земли. Увидеть их можно в степной или полупустынной местности. Ниже на фото представлен солончак.


Области применения минерала
Применение кристаллов соли получило широкое распространение в различных сферах жизни. Ежедневно их используют в пищевых целях, так как соль – незаменимый компонент первых, вторых блюд, салатов, ее добавляют даже в процессе приготовления сладостей. Ежегодно люди съедают около 7 млн. т поваренной соли.


В отраслях химической промышленности NaCl применяется с целью получения соды, щелочных соединений путем выделения натрия и хлора из структуры галита. Галитовую пленку наносят в один слой при создании линз.
Технический галит в прессованном виде предназначен для устранения накипи в котлах и очистки водонагревательных приборов. При помощи минерального концентрата можно избавляться от обледенения. Галит замерзает при более низких температурных значениях, чем вода. По этой причине его используют для ликвидации корки льда на дорожном полотне, снижения ее плотности.


В строительной отрасли галит незаменим в работах на промерзших участках почвы. Соль способствует быстрому оттаиванию земли при проведении разведовательных мероприятий.
Минерал в виде друз часто становится материалом для поделок, талисманов, декоративных украшений. Созданные из галита фигурки в фоме шара, пирамидки или цилиндра являются оригинальными предметами украшения домашнего интерьера.
Месторождения галита
Самые мощные пласты галита зародились во времена Пермского периода несколько сотен миллионов лет назад. Такие залежи соли есть в Европе, Азии и Северной Америке, где господствовал засушливый климат с высокими температурами.


На данном этапе большие объемы каменной соли добываются на российских месторождениях. Наиболее крупные из них — Соликамское и Соль-Илецкое на Урале. Кроме того, активно разрабатываются залежи в Усолье-Сибирском бассейне в Иркутске. Наиболее известная в России илецкая соль производится в Оренбургской области, где находится месторождение Илецкое. Самосадочные породы галита разрабатывают на территории Нижнего Поволжья, на побережье озера Баскунчак, расположенного в Астраханской области, а также на озере Сиваш в Крыму.
Среди европейских месторождений можно отметить Артемовское (Украина, Донецкая область) и Закарпатское (Украина). Красивые кристаллы крупных размеров добывают на территории Польши в Иновроцлаве, Бохне и Величке. Германские месторождения, находящиеся недалеко от Страсбурга и Бернбурга, славятся завораживающими залежами сиреневых и голубых оттенков.
Крупные залежи каменной соли на территолии Америки находятся в Оклахоме, Техасе, Луизиане и Калифорнии. Добыча соляных пород ведется и в Индии в Пенджабе. Соль озерного вида разрабатывается в иранском месторождении Урмия.


Обладает ли галит лечебными свойствами?
Многолетний опыт использования соли в быту показал, что минерал обладает и рядом лечебных свойств. Галит, как натуральный антисептик, помогает в борьбе с ОРЗ и вирусными инфекциями. Соль включают в растворы для обработки полости рта при лагингите, тонзиллите, а также для промывания носовых ходов. Полоскания также способны уменьшить интенсивность зубной боли.
Лечить отит и радикулит можно при помощи прогреваний. Для этого поваренную соль помещают в мешочек и нагревают, затем ее кладут на больное место. При бронхите хорошо помогает посещение соляных комнат, где воздух насыщен ионами соли.


Если в рационе человека недостаточно соли, то в работе его организма возникают нарушения, появляются слабость, тошнота, происходит обезвоживание. Для общего укрепления организма и оздоровления суставов применяют ванны с солевым раствором, массаж с гималайской солью.
Магические свойства
Простой состав каменной соли, казалось бы, не обладает никакой магией. Однако существование народных поверий о соли, основанных на жизненном опыте, доказывает, что галит обладает некоторыми магическими силами. Например, если высыпать из соли крест, то можно обеспечить защиту от нечистой силы, а если случайно рассыпать ее, то в ближайшем будущем в доме можно ждать ссор или болезней.


Славянские воины верили, что горсть земли, смешанная с солью, убережет их от смерти на поле боя. С древних времен люди считали, что минерал способен:
- защищать от злых духов;
- предостерегать от опасностей и бед;
- беречь от сглаза недоброжелателей;
- приносить удачу;
- привлекать хороших людей в окружение.


Издавна детям и взрослым в одежду вшивали кусочек галита. Такой оберег помогал защитить человека от негативного влияния посторонних людей.
Астрологи считают, что амулеты из соли можно носить всем людям, независимо от принадлежности к знаку зодиака. Чтобы кристаллы проявляли магическую силу, нужно скрывать их от посторонних глаз и носить только под одеждой.


Маги применяют соль в своих ритуалах, так как она способна возвращать зло тому, кто его пожелал, а положительный посыл может быть усилен в несколько раз при помощи галита. По этой причине заговоры, сделанные на подобные амулеты для привлечения удачи, любви и счастья, с большой долей вероятности оказываются действенными.
Уход за изделиями из галита
Декоративные изделия, выполненные из галита, очень хрупкие, поэтому являются недолговечными и требуют бережного обращения. Кроме того, поделки из этого минерала в значительной степени подвержены воздействию влаги и теряют свой первозданный вид при соприкосновении с водой или при нахождении в помещении с большой влажностью.


Если амулет или талисман из галита нужно носить на теле, то предварительно его следует поместить мешочек из хлопковой ткани. Это убережет кожу от раздражения, вызываемого солью, а также не позволит изделию контактировать с влагой, выделяемой человеческим телом.
Статуэтки из соляных кристаллов лучше держать в сухих комнатах с пониженной влажностью. Это продлит срок их службы.
Поделитесь с друьями!
Хлорид натрия — это… Что такое Хлорид натрия?
| Хлорид натрия | |
 | |
 | |
| Общие | |
|---|---|
| Традиционные названия | обычная соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Химическая формула | NaCl |
| Физические свойства | |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Термические свойства | |
| Температура плавления | 800,8 °C |
| Температура кипения | 1465 °C |
| Молярная теплоёмкость (ст. усл.) | 50,8 Дж/(моль·К) |
| Удельная теплота испарения | 170,85 кДж/моль Дж/кг |
| Удельная теплота плавления | 28,68 кДж/моль Дж/кг |
| Химические свойства | |
| pKa | 6,7–7,3 |
| Растворимость в воде | 35,6 (0 °C) 35,9 (25 °C) 39,1 (100 °C) г/100 мл |
| Растворимость в метаноле | 14,9 г/100 мл |
| Растворимость в аммиаке | 21,5 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,5442 (589 нм) |
| Структура | |
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Классификация | |
| Рег. номер CAS | [7647-14-5] |
| Рег. номер PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | [Na+].[Cl-] |
| RTECS | VZ4725000 |
| Безопасность | |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 |  |
Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий.
Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Нахождение в природе и производство
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 10 15 тонн NaCl, то есть из каждой тысячи тонн морской воды можно получить в среднем 1,3 тонны хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, состоят из NaCl. Также он найден в кристаллах снега[2].
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах теплых морей или на соляных озёрах, где на мелководье соленая вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»[3].
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решетку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г / см ³, а твёрдость по шкале Мооса — 2. Бесцветный, прозрачный минерал, со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и т. п.[4]
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (желтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и т. д.[4]
По условиям формирования месторождений каменную соль подразделяют на следующие виды[4]:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
 Очищенная кристаллическая морская соль
Очищенная кристаллическая морская сольПри испарении морской воды при температуре 20 — 35 ° C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль с Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Залежи
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, о. Кулундинское, Эбейты и др. озера в Зап. Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённую соль выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой желобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 новгородский князь Святослав определил налог на соляные варницы[6]:
 | …на мори от чрена и от салгы по пузу… |  |
[7]
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли. Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн)[8].
-

Добыча соли в южной части Мертвого моря, Израиль
-

Кристаллы каменной соли
-

Плантация морской соли в Дакаре
-

Соляные кучи на солончаке Уюни, Боливия
Применение
В пищевой промышленности и кулинарии
Соль повареннаяВ пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах,%:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15 % содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % р-р) используют как вспомогательный осмотический диуретик при лёгочных, желудочных и кишечных кровотечениях для обеспечения форсированного диуреза, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололеда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в котельных установках всех мощностей для смягчения воды при водоподготовке. Катионитовым материалом на современных водоподготовительных установках служат в основном глауконит, сульфанованные угли и синтетические смолы. Наиболее распространены сульфоугли.
Регенерацию Nа-катионитовых фильтров осуществляют 6—8%-м раствором поваренной соли, в результате действие сульфоуголя восстанавливается. Реакции идут по уравнениям:
- CaR2 + 2NаСl = 2NаR + CaСl2.
- МgR2 + 2NаСl = 2NаR + МgСl2.
Химическая промышленность
Соль, наряду с каменным углем, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности[10]. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков[11]. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия[12]:
- NaCl + 3 H2O → NaClO3 + 3 H2↑
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах[13][14]:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H +, образованных в результате электролитической диссоциации воды:
- H2O ⇆ H+ + OH−
- 2 H+ + 2 e− → H2↑
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
- NaCl → Na+ + Cl−
- 2 Cl− − 2 e− → Cl2↑
- суммарная реакция:
- 2 NaCl + 2 H2O → 2 NaOH + Cl2↑ + H2↑
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор сжижается на жёлтую жидкость уже при обычной температуре[15].
Если между анодом и катодом нет диафрагмы, то растворенный в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO[14]:
- 2 NaOH + Cl2 → NaCl + NaClO + H2O
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подается в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH ничтожно мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия[14][16]:
- Na+ + e− → Na(Hg)
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
- 2 Na(Hg) + 2 H2O → 2 NaOH + H2↑
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
- 2 Na+ + 2 e− → 2 Na
- на аноде выделяется хлор (как побочный продукт):
- 2 Cl− − 2 e− → Cl2
- суммарная реакция:
- 2 Na+ + 2 Cl− → 2 Na + Cl2
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (800 ° C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления 580 ° C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (371 ° C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
- NaCl + H2SO4 → NaHSO4 + HCl↑
- NaCl + NaHSO4 → Na2SO4 + HCl↑
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идет почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4[18][19].
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления 800,8 С, кипения 1465 С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca 2 +, Mg 2 + и SO2−4), и такая соль на воздухе сыреет[20]. Кристаллогидрат NaCl · 2H 2 O можно выделить при температуре ниже +0,15 ° C[21].
Смесь измельченного льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 ° C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 ° C. Лед, имеющий температуру около 0 ° C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород. С раствором нитрата серебра образует белый осадок хлорида серебра.
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией[22]:
- Na(тв) + 1/2Cl2(г) → NaCl(тв) + 410 кДж
- нейтрализация щелочи гидроксида натрия соляной кислотой[23]:
- NaОН + НCl → NaCl + Н2О
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы: NaCl → Na+ + Cl−, его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
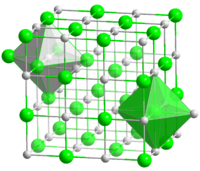
Структура
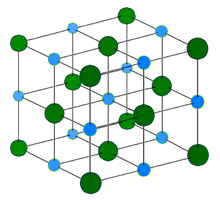 Кристаллическая решётка хлорида натрия.
Кристаллическая решётка хлорида натрия.Голубой цвет = Na+
Зелёный цвет = Cl−
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа F m3m, a = 0,563874 нм, d = 2,17 г/см³. Каждый из ионов Cl− окружен шестью ионами Na+ в октаедральний конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура с ионов Cl−, называемая гранецентрированной кубической решеткой. Ионы Na+ тоже образуют плотно упакованную кубическую решетку. Таким образом, кристалл состоит из двух подрешеток, сдвинутых друг относительно друга на полупериод. Такая же решетка характерна для многих других минералов.
В кристаллической решетке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов
См. также
Примечания
- ↑ Натрия хлорид на сайте Национального института стандартов и технологии (англ. National Institute of Standards and Technology) (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 218
- ↑ Пифагор. Золотой канон. Фигуры эзотерики. — М.: Изд-во Эксмо, 2003. — 448 с. (Антология мудрости).
- ↑ 1 2 3 4 Малая горная энциклопедия. В 3-х т. / Под ред. В. С. Белецкого . — Донецк: «Донбасс», 2004. — ISBN 966-7804-14-3
- ↑ УНИАН: Морская соль для красоты и здоровья кожи
- ↑ Российское законодательство Х-ХХ веков. Законодательство Древней Руси. т. 1. М, 1984. С. 224—225. (рус.)
- ↑ В переводе с поморской «говори» слово чрен (црен) означает четырёхугольный ящик, кованный из листового железа, а салга — котёл, в котором варили соль. Пузом в беломорских солеварнях называли мешок соли в два четверика, то есть, объёмом около 52 литров.
- ↑ Соль (PDF), Геологический обзор США на сайте Программы минеральных ресурсов (англ.)
- ↑ Энциклопедия здоровья
- ↑ Онлайн Энциклопедия кругосвет. Натрий
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 261
- ↑ Синтез хлората натрия (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 249
- ↑ 1 2 3 М. Л. Глинка Общая химия (Учебник), изд. 2-е изд., Перераб. и доп .. — С. 608, Киев: «Высшая школа», 1982.
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 254
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 231
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 219
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 250
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 257—258
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 215—216
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 234
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 255
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 191
Ссылки
Шаблон:АТХ код A07
Плазмозамещающие и перфузионные растворы — АТХ код: B05
| B05A |
| ||
|---|---|---|---|
| B05B |
| ||
| B05C |
| ||
| B05D |
| ||
| B05X |
| ||
| B05Z |





Добавить комментарий