Земные белки возникли просто | Наука и жизнь
Для синтеза самых первых белковых молекул на Земле не требовалось никаких экстремальных условий.
Одна из главных реакций во всех клетках: белок из класса РНК-полимераз делает РНК-копию на ДНК-шаблоне (РНК и ДНК показаны спиральными нитями в центре белковой молекулы). (Иллюстрация: NIH Image Gallery / Flickr.com.) Фрагмент молекулы РНК, разными цветами обозначены разные атомы. (Иллюстрация: Zappys Technology Solutions / Flickr.com.)‹
›
Зарождение жизни на Земле обычно ассоциируется с какими-то необычайными катаклизмами. Дело в том, что биологические молекулы устроены сложно, а химические соединения в «дожизненные» времена были довольно простыми. В лабораторных условиях «слепить» биологические молекулы из простых компонентов – задача не из легких, и долгое время считалось, что подобные реакции требовали огромного количества энергии и могли протекать лишь в исключительных условиях – с помощью сильного УФ-излучения, на фоне сверкающих молний и пылающих вулканов.
Но кто сказал, что сложные биологические молекулы на самом деле образовались за один прием? Вероятно, на деле все происходило в несколько этапов и с множеством промежуточных веществ, которые, в свою очередь, помогали процессу «жизнестроительства» продвигаться дальше, вплоть до появления биомолекулы. Такой точки зрения придерживаются исследователи из Технологического института Джорджии, предложившие сценарий возникновения первых белков на нашей планете.
По мнению Джея Форсайта (Jay Forsythe) и его коллег, все началось с депсипептидов – белковоподобных молекул, содержащих в своём составе, кроме аминокислот, ещё и гидроксикислоты. Так называют структурные аналоги аминокислот, которые часто находят на метеоритах и в которых не было недостатка ни тогда, ни сейчас. (Например, к гидроксикислотам относят лимонную, молочную и яблочную кислоты.) Гидроксикислоты гораздо легче связываются с аминокислотами, чем аминокислоты – между собой. С другой стороны, их связи с аминокислотами очень легко разрушаются водой, тогда как связи аминокислот друг с другом в водных растворах очень устойчивы.
Если представить, что депсипептиды то «высыхают», то опять попадают в воду, гидроксикислоты из них будут вымываться, а в освобождающиеся места будут встраиваться аминокислоты с «водостойкими» связями, и через какое-то время депсипептиды будут состоять уже только из одних аминокислот. Стоит подчеркнуть, что сами по себе, без посредничества гидроксикислот, аминокислоты при обычных условиях соединяться не стали бы, особенно в такие большие структуры.
Это не просто отвлеченная гипотеза – превращение депсипептидов в белки исследователи наблюдали в лабораторном эксперименте. Более того, оказалось, что таким способом можно получить молекулы самого разного строения, а где есть разнообразие, там есть и эволюционный отбор. В естественных условиях такая реакция могла происходить где-нибудь в прибрежной зоне мелких, насыщенных органическими веществами водоемов, на камнях, куда депсипептиды приносило волнами и где они высыхали на солнце, а затем с брызгами и дождем снова «сползали» обратно – и так много раз подряд. Полностью результаты исследований опубликованы в
Как новые результаты соотносятся с общими представлениями о появлении жизни, которые бытуют в современной науке? Ни для кого не секрет, что аминокислоты у нас в клетках никогда не собираются в белки сами по себе. Для сборки белков существует специальная молекулярная машина, которая присоединяет аминокислоты в строго определенной последовательности, прописанной в геноме. Поэтому долгое время все недоумевали, как на этапе зарождения жизни белок мог появиться раньше, чем нуклеиновая кислота, если информация о его структуре закодирована именно в ней? Оставалось только допустить, что так было не всегда. Появилась гипотеза, что «на заре времен» белки ничем не кодировались и возникали в результате самосборки.
Такой «изначальный биосинтез» попытались осуществить в лабораторных условиях, стараясь сымитировать условия, в которых химические соединения находились на планете миллиарды лет назад: через реакционные смеси пропускали электрические разряды, разогревали их до аномальных по современным меркам температур и пр. Что-то в итоге получалось, но получалось плохо: до таких изящных экспериментов, как с депсипептидами, было ещё далеко.
Другая проблема с белковой гипотезой касалась наследственности. Если аминокислоты в белке выстраиваются всякий раз в случайную последовательность, и последовательность эта нигде не кодируется (по белковой гипотезе, нуклеиновых кислот еще нет), то структуру конкретного белка просто невозможно повторить – не может появиться второго поколения молекул, которые повторяли бы «предков».
Но для того, чтобы получилась самая примитивная клетка с самым примитивным обменом веществ, нужно иметь на руках довольно внушительный комплект белков. Вероятность того, что они все могли бы получиться одновременно, исчезающе мала. Такое могло бы произойти, если бы информация о них хранилась долгое время, тогда те, кто появился раньше, воспроизводя себя в следующих поколениях, могли бы дождаться остальных. Но копировать сами себя белки не могут, а посторонних носителей информации тогда, повторим, еще не было.
Решение проблемы с передачей наследственной информации появилось с открытием у нуклеиновых кислот исключительно важных свойств. Клетки синтезируют и РНК, и ДНК с помощью ферментов – белков, которые облегчают реакцию присоединения нуклеотидов (составных частей нуклеиновых кислот) друг к другу.
Ферментативные свойства долгое время считались уникальными для белков, но в 1970-е их вдруг обнаружили и у некоторых разновидностей рибонуклеиновой кислоты. Оказалось, что некоторые РНК способны катализировать присоединение нуклеотидов – то есть РНК синтезировала РНК. И, что важно, при синтезе нуклеиновая кислота воспроизводила собственную нуклеотидов последовательность. Иными словами, можно представить себе древний мир биомолекул, которые передают информацию о самих себе из поколения в поколение, только биомолекулы эти – не белки, а РНК. Появилась гипотеза «мира РНК», которая остаётся общепринятой и по сей день.
Копируя самих себя, нуклеиновые кислоты неизбежно допускали ошибки, так что «потомки» выходили, хоть в целом и похожими на «родителей», но все-таки с отличиями. Под влиянием условий среды из таких разнообразных потомков преимущество получали лишь некоторые – например, те, которые копировали себя быстрее остальных.
В дальнейшем оказалось, что быстрее всего дело идет с помощью других молекул – например, белков, так что в итоге в эволюционной гонке вперед вырвались те, кто научился симбиозу с белками. По мере развития нуклеиново-белковых «отношений» возник генетический код, когда нуклеиновые кислоты научились кодировать аминокислотную последовательность своих «напарников», а РНК уступила место ДНК как главной наследственной молекуле.
В гипотезе «мира РНК» все ещё много умозрительных допущений, однако тут постепенно появляются новые исследования, позволяющие вполне удовлетворительно проиллюстрировать некоторые темные места – так, эксперименты с депсипептидами показывают, что у древних нуклеиновых кислот мог быть широкий выбор в смысле белковых молекул для сотрудничества.
Ну а что касается самого исходного сырья, из которого должны были получиться биомолекулы, то с этим, как теперь известно, проблем не было – все необходимые строительные соединения легко могли появиться в земном «первичном супе».
Клетка — Википедия

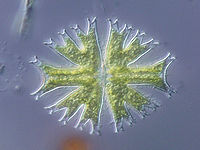
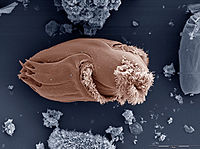
Кле́тка — структурно-функциональная элементарная единица строения и жизнедеятельности всех организмов. Обладает собственным обменом веществ, способна к самовоспроизведению. Организм, состоящий из одной клетки, называется одноклеточным (многие простейшие и бактерии). Раздел биологии, занимающийся изучением строения и жизнедеятельности клеток, называется цитологией. Также принято говорить о биологии клетки, или клеточной биологии.
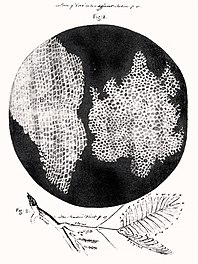 Срез пробкового дерева из книги Роберта Гука «Микрография», 1635—1703 Первое наблюдение за клетками, с использованием раннего микроскопа
Срез пробкового дерева из книги Роберта Гука «Микрография», 1635—1703 Первое наблюдение за клетками, с использованием раннего микроскопаПервым человеком, увидевшим клетки, был английский учёный Роберт Гук (известный открытием закона Гука). В 1665 году, пытаясь понять, почему пробковое дерево хорошо плавает, Гук стал рассматривать тонкие срезы пробки с помощью усовершенствованного им микроскопа. Он обнаружил, что пробка разделена на множество крошечных ячеек, напомнивших ему соты в ульях медоносных пчёл, и он назвал эти ячейки клетками (по-английски cell означает «ячейка, клетка»).
В 1675 году итальянский врач Марчелло Мальпиги подтвердил клеточное строение растений, а в 1681 году — английский ботаник Неемия Грю. О клетке стали говорить как о «пузырьке, наполненном питательным соком». В 1674 году голландский мастер Антоний ван Левенгук с помощью микроскопа впервые увидел в капле воды «зверьков» — движущиеся живые организмы (инфузории, амёбы, бактерии). Также Левенгук впервые наблюдал животные клетки — эритроциты и сперматозоиды. Таким образом, к началу XVIII века учёные знали, что под большим увеличением растения имеют ячеистое строение, и видели некоторые организмы, которые позже получили название одноклеточных. В 1802—1808 годах французский исследователь Шарль-Франсуа Мирбель установил, что растения состоят из тканей, образованных клетками. Ж. Б. Ламарк в 1809 году распространил идею Мирбеля о клеточном строении и на животные организмы. В 1825 году чешский учёный Я. Пуркине открыл ядро яйцеклетки птиц, а в 1839 ввёл термин «протоплазма». В 1831 году английский ботаник Р. Броун впервые описал ядро растительной клетки, а в 1833 году установил, что ядро является обязательным органоидом клетки растения. С тех пор главным в организации клеток считается не оболочка, а содержимое.
Клеточная теория[править | править код]
Клеточная теория строения организмов была сформирована в 1839 году немецкими учёными, зоологом Теодором Шванном и ботаником М. Шлейденом, и включала в себя три положения. В 1858 году Рудольф Вирхов дополнил её ещё одним положением, однако в его идеях присутствовал ряд ошибок: так, он предполагал, что клетки слабо связаны друг с другом и существуют каждая «сама по себе». Лишь позднее удалось доказать целостность клеточной системы.
В 1878 году русским учёным И. Д. Чистяковым открыт митоз в растительных клетках; в 1878 году В. Флемминг и П. И. Перемежко обнаруживают митоз у животных. В 1882 году В. Флемминг наблюдает мейоз у животных клеток, а в 1888 году Э. Страсбургер — у растительных.
Клеточная теория является одной из основополагающих идей современной биологии, она стала неопровержимым доказательством единства всего живого и фундаментом для развития таких дисциплин, как эмбриология, гистология и физиология. На сегодняшний день теория содержит такие утверждения:
- Клетка — элементарная единица строения, функционирования, размножения и развития всех живых организмов. Вне клетки нет жизни.
- Клетка — целостная система, содержащая большое количество связанных друг с другом элементов — органелл.
- Клетки различных организмов похожи (гомологичны) по строению и основным свойствам и имеют общее происхождение.
- Увеличение количества клеток происходит путём их деления, после репликации их ДНК: клетка — от клетки.
- Многоклеточный организм — система из большого количества клеток, объединённых в системы тканей и органов, связанных между собой гуморальной и нервной регуляциями.
- Клетки многоклеточных организмов обладают одинаковым полным фондом генетического материала этого организма, всеми возможными потенциями для проявления этого материала, — но отличаются по уровню экспрессии (работы) отдельных генов, что приводит к их морфологическому и функциональному разнообразию — дифференцировке[2].
Количество и формулировки отдельных положений современной клеточной теории в разных источниках могут отличаться.
Впервые клетки удалось увидеть только после создания оптических (световых) микроскопов. С того времени микроскопия остается одним из важнейших методов исследования клеток. Световая микроскопия, несмотря на небольшое разрешение, позволяла наблюдать за живыми клетками. В XX веке была изобретена электронная микроскопия, которая позволила изучить ультраструктуру клеток.
Для изучения функций клеток и их частей используют разнообразные биохимические методы — как препаративные, например фракционирование методом дифференциального центрифугирования, так и аналитические. Для экспериментальных и практических целей используют методы . Все упомянутые методические подходы могут использоваться в сочетании с методами культуры клеток.
Оптическая микроскопия[править | править код]
В оптическом микроскопе увеличение объекта достигается благодаря серии линз, через которые проходит свет. Максимальное увеличение составляет более 1000 раз. Также важной характеристикой является разрешение — расстояние между двумя точками, которые ещё распознаются отдельно. Разрешение характеризует чёткость изображения. Эта величина ограничивается длиной световой волны, и даже при использовании самого коротковолнового света — ультрафиолетового — можно достичь разрешения только около 200 нм; такое разрешение было получено ещё в конце XIX века. Малейшие структуры, которые можно наблюдать под оптическим микроскопом, это митохондрии и бактерии. Их линейный размер составляет примерно 500 нм. Однако объекты размером меньше 200 нм видны в световом микроскопе, если они сами излучают свет. Эта особенность используется в флуоресцентной микроскопии, когда клеточные структуры или отдельные белки связываются со специальными флуоресцентными белками или антителами с флуоресцентными метками. На качество изображения, полученного с помощью оптического микроскопа, влияет также контрастность — её можно увеличить, используя различные методы окраски клеток. Для изучения живых клеток используют фазово-контрастную, дифференциальную интерференционно-контрастную и темнопольную микроскопию. Конфокальные микроскопы позволяют улучшить качество флуоресцентных изображений[3][4].
Изображения, полученные с помощью оптической микроскопииЭлектронная микроскопия[править | править код]
В 30-х годах XX века был сконструирован электронный микроскоп, в котором вместо света через объект пропускается пучок электронов. Теоретический предел разрешения для современных электронных микроскопов составляет около 0,002 нм, однако из практических причин для биологических объектов достигается разрешение только около 2 нм. С помощью электронного микроскопа можно изучать ультраструктуру клеток. Различают два основных типа электронной микроскопии: сканирующую и трансмиссионную. Сканирующая (растровая) электронная микроскопия (РЭМ) используется для изучения поверхности объекта. Образцы зачастую покрывают тонкой плёнкой золота. РЭМ позволяет получать объёмные изображения. Трансмиссионная (просвечивающая) электронная микроскопия (ПЭМ) — используется для изучения внутреннего строения клетки. Пучок электронов пропускается через объект, предварительно обработанный тяжёлыми металлами, которые накапливаются в определённых структурах, увеличивая их электронную плотность. Электроны рассеиваются на участках клетки с большей электронной плотностью, в результате чего на изображениях эти области выглядят темнее[3][4].
Фракционирование клеток[править | править код]
Для установления функций отдельных компонентов клетки важно выделить их в чистом виде, чаще всего это делается с помощью метода дифференциального центрифугирования. Разработаны методики, позволяющие получить чистые фракции любых клеточных органелл. Получение фракций начинается с разрушения плазмалеммы и образования клеток. Гомогенат последовательно центрифугируется при различных скоростях, на первом этапе можно получить четыре фракции: (1) ядер и крупных обломков клеток, (2) митохондрий, пластид, лизосом и пероксисом, (3) — пузырьков аппарата Гольджи и эндоплазматического ретикулума, (4) рибосом, в останутся белки и более мелкие молекулы. Дальнейшее дифференциальное центрифугирование каждой из смешанных фракций позволяет получить чистые препараты органелл, к которым можно применять разнообразные биохимические и микроскопические методы[2].
Все клеточные формы жизни на Земле можно разделить на два надцарства на основании строения составляющих их клеток:
- прокариоты (доядерные) — более простые по строению, возникли в процессе эволюции раньше;
- эукариоты (ядерные) — более сложные, возникли позже. Клетки, составляющие тело человека, являются эукариотическими.
Несмотря на многообразие форм, организация клеток всех живых организмов подчинена единым структурным принципам.
Содержимое клетки отделено от окружающей среды плазматической мембраной, или плазмалеммой. Внутри клетка заполнена цитоплазмой, в которой расположены различные органеллы и клеточные включения, а также генетический материал в виде молекулы ДНК. Каждая из органелл клетки выполняет свою особую функцию, а в совокупности все они определяют жизнедеятельность клетки в целом.
Прокариотическая клетка[править | править код]
Прокариоты (от др.-греч. πρό — ‘перед’, ‘до’ и κάρῠον — ‘ядро’) — организмы, не обладающие, в отличие от эукариот, оформленным клеточным ядром и другими внутренними мембранными органоидами (за исключением плоских цистерн у фотосинтезирующих видов, например, у цианобактерий). Единственная крупная кольцевая (у некоторых видов — линейная) двухцепочечная молекула ДНК, в которой содержится основная часть генетического материала клетки (так называемый нуклеоид) не образует комплекса с белками-гистонами (так называемого хроматина). К прокариотам относятся бактерии, в том числе цианобактерии (сине-зелёные водоросли), и археи. Потомками прокариотических клеток являются органеллы эукариотических клеток — митохондрии и пластиды. Основное содержимое клетки, заполняющее весь её объём, — вязкая зернистая цитоплазма.
Эукариотическая клетка[править | править код]
Эукариоты (эвкариоты, от др.-греч. εὖ ‘хорошо’, ‘полностью’ и κάρῠον — ‘ядро’) — организмы, обладающие, в отличие от прокариот, оформленным клеточным ядром, отграниченным от цитоплазмы ядерной оболочкой. Генетический материал заключён в нескольких линейных двухцепочных молекулах ДНК (в зависимости от вида организмов их число на ядро может колебаться от двух до нескольких сотен), прикреплённых изнутри к мембране клеточного ядра и образующих у подавляющего большинства (кроме динофлагеллят) комплекс с белками-гистонами, называемый хроматином. В клетках эукариот есть система внутренних мембран, образующих, помимо ядра, ряд других органоидов (эндоплазматическая сеть, аппарат Гольджи и др.). Кроме того, у подавляющего большинства имеются постоянные внутриклеточные симбионты-прокариоты — митохондрии, а у водорослей и растений — также и пластиды.

 Фимбрии кишечной палочки, которые позволяют ей прикрепляться к субстрату (ОМ)
Фимбрии кишечной палочки, которые позволяют ей прикрепляться к субстрату (ОМ) 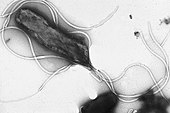
Клетки двух основных групп прокариот — бактерий и архей — похожи по структуре, характерными их признаками являются отсутствие ядра и мембранных органелл.
Основными компонентами прокариотической клетки являются:
- Клеточная стенка, которая окружает клетку извне, защищает её, придаёт устойчивую форму, предотвращающую от осмотического разрушения. У бактерий клеточная стенка состоит из пептидогликана (муреина), построенного из длинных полисахаридных цепей, соединённых между собой короткими пептидными перемычками. По строению клеточной стенки различают две группы бактерий:
- Клеточная стенка архей не содержит муреина, а построена в основном из разнообразных белков и полисахаридов[4].
- Капсула — имеющаяся у некоторых бактерий слизистая оболочка, расположенная снаружи от клеточной стенки. Состоит в основном из разнообразных белков, углеводов и уроновых кислот. Капсулы защищают клетки от высыхания, могут помогать бактериям в колониях удерживаться вместе, а индивидуальным бактериям — прикрепляться к различным субстратам. Кроме этого, капсулы предоставляют клетке дополнительную защиту: например, капсулированные штаммы пневмококков свободно размножаются в организме и вызывают воспаление лёгких, тогда как некапсулированные быстро уничтожаются иммунной системой и являются абсолютно безвредными[5].
- Пили или ворсинки — тонкие волоскоподобные выросты, что присутствуют на поверхности бактериальных клеток. Существуют различные типы пилей, из которых наиболее распространёнными являются:
- Жгутики — органеллы движения некоторых бактерий. Бактериальный жгутик построен значительно проще эукариотического, и он в 10 раз тоньше, не покрыт плазматической мембраной и состоит из одинаковых молекул белков, которые образуют цилиндр. В мембране жгутик закреплён при помощи базального тела[4].
- Плазматическая и внутренние мембраны. Общий принцип устройства клеточных мембран не отличается от эукариот, однако в химическом составе мембраны есть немало различий, в частности, в мембранах прокариот отсутствуют молекулы холестерина и некоторых липидов, присущих мембранам эукариот. Большинство прокариотических клеток (в отличие от эукариотических) не имеют внутренних мембран, которые разделяют цитоплазму на отдельные компартменты. Только у некоторых фотосинтетических и аэробных бактерий плазмалемма образует вгибание внутрь клетки, что выполняет соответствующие метаболические функции[4].
- Нуклеоид — не ограниченный мембранами участок цитоплазмы, в котором расположена кольцевая молекула ДНК — «бактериальная хромосома», где хранится весь генетический материал клетки[4].
- Плазмиды — небольшие дополнительные кольцевые молекулы ДНК, несущие обычно всего несколько генов. Плазмиды, в отличие от бактериальной хромосомы, не являются обязательным компонентом клетки. Обычно они придают бактерии определённые полезные для неё свойства, такие как устойчивость к антибиотикам, способность усваивать из среды определённые энергетические субстраты, способность инициировать половой процесс и т. д.[4][5]
- Рибосомы прокариот, как и у всех других живых организмов, отвечают за осуществление процесса трансляции (одного из этапов биосинтеза белка). Однако бактериальные рибосомы несколько меньше, чем эукариотические (коэффициенты седиментации 70S и 80S соответственно), и имеют другой состав белков и РНК. Из-за этого бактерии, в отличие от эукариот, чувствительны к таким антибиотикам, как эритромицин и тетрациклин, которые избирательно действуют на 70S-рибосомы[5].
- Эндоспоры — окружённые плотной оболочкой структуры, содержащие ДНК бактерии и обеспечивающее выживание в неблагоприятных условиях. К образованию эндоспор способны лишь некоторые виды прокариот, например представители родов Clostridium (C. tetani — возбудитель столбняка, C. botulinum — возбудитель ботулизма, C. perfringens — возбудитель газовой гангрены и т. п.) и Bacillus (в частности B. anthracis — возбудитель сибирской язвы). Для образования эндоспоры клетка реплицирует свою ДНК и окружает копию плотной оболочкой, из созданной структуры удаляется избыток воды, и в ней замедляется метаболизм[4]. Споры бактерий могут выдерживать довольно жёсткие условия среды, такие как длительное высушивание, кипячение, коротковолновое облучение и др.[5]
 Схематическое изображение животной клетки (подписи составных частей — ссылки на статьи про них).
Схематическое изображение животной клетки (подписи составных частей — ссылки на статьи про них).Поверхностный комплекс животной клетки[править | править код]
Состоит из гликокаликса, плазмалеммы и расположенного под ней кортикального слоя цитоплазмы. Плазматическая мембрана называется также плазмалеммой, наружной клеточной мембраной, цитолеммой и т. д. Её толщина — около 10 нанометров. Обеспечивает разграничение клетки и внешней среды, а также пропускание внутрь и наружу некоторых веществ.
На сохранение целостности своей мембраны клетка не тратит энергии: молекулы удерживаются по тому же принципу, по которому удерживаются вместе молекулы жира — гидрофобным частям молекул термодинамически выгоднее располагаться в непосредственной близости друг к другу. Гликокаликс представляет собой «заякоренные» в плазмалемме молекулы олигосахаридов, полисахаридов, гликопротеинов и гликолипидов. Гликокаликс выполняет рецепторную и маркерную функции.
Плазматическая мембрана животных клеток в основном состоит из фосфолипидов и липопротеидов со вкрапленными в неё молекулами белков, в частности, поверхностных антигенов и рецепторов.
В кортикальном (прилегающем к плазматической мембране) слое цитоплазмы находятся специфические элементы цитоскелета — упорядоченные определённым образом актиновые микрофиламенты. Основной и самой важной функцией кортикального слоя (кортекса) являются псевдоподиальные реакции: выбрасывание, прикрепление и сокращение псевдоподий. При этом микрофиламенты перестраиваются, удлиняются или укорачиваются. От структуры цитоскелета кортикального слоя зависит также форма клетки (например, наличие микроворсинок).
Структура цитоплазмы[править | править код]
Жидкую составляющую цитоплазмы также называют цитозолем. Под световым микроскопом казалось, что клетка заполнена чем-то вроде жидкой плазмы или золя, в котором «плавают» ядро и другие органеллы. На самом деле это не так. Внутреннее пространство эукариотической клетки строго упорядочено. Передвижение органоидов координируется при помощи специализированных транспортных систем, так называемых микротрубочек, служащих внутриклеточными «дорогами», и специальных белков динеинов и кинезинов, играющих роль «двигателей». Отдельные белковые молекулы также не диффундируют свободно по всему внутриклеточному пространству, а направляются в необходимые компартменты при помощи специальных сигналов на их поверхности, узнаваемых транспортными системами клетки.

Рибосомы[править | править код]
Рибосомы — органоиды, необходимые клетке для синтеза белка. Их размер составляет примерно 20—30 нм. В клетке их насчитывается несколько миллионов. Рибосомы образованы из двух субъединиц: большой и малой, состоящих из четырёх молекул РНК и нескольких молекул белков. У эукариотических клеток рибосомы встречаются не только в цитоплазме, но и в митохондриях и хлоропластах. Рибосомы формируются в области ядрышек, а затем через ядерные поры выходят в цитоплазму.
Эндоплазматический ретикулум[править | править код]
В эукариотической клетке существует система переходящих друг в друга мембранных отсеков (трубочек, мешочков и плоских цистерн разных размеров), которая называется эндоплазматическим ретикулумом (или эндоплазматическая сеть, ЭПР или ЭПС). Ту часть ЭПР, к мембранам которого прикреплены рибосомы, относят к гранулярному (или шероховатому) эндоплазматическому ретикулуму, на его мембранах происходит синтез белков. Те компартменты, на стенках которых нет рибосом, относят к агранулярному (или гладкому) ЭПР, принимающему участие в синтезе липидов. Внутренние пространства гладкого и гранулярного ЭПС не изолированы, а переходят друг в друга и сообщаются с просветом ядерной оболочки.
Аппарат Гольджи[править | править код]
Аппарат Гольджи представляет собой стопку плоских мембранных цистерн, несколько расширенных ближе к краям. В цистернах аппарата Гольджи созревают некоторые белки, синтезированные на мембранах гранулярного ЭПР и предназначенные для секреции или образования лизосом. Аппарат Гольджи асимметричен — цистерны, располагающиеся ближе к ядру клетки (цис-Гольджи) содержат наименее зрелые белки, к этим цистернам непрерывно присоединяются мембранные пузырьки — везикулы, отпочковывающиеся от эндоплазматического ретикулума. По-видимому, при помощи таких же пузырьков происходит дальнейшее перемещение созревающих белков от одной цистерны к другой. В конце концов от противоположного конца органеллы (транс-Гольджи) отпочковываются пузырьки, содержащие полностью зрелые белки.
Ядро[править | править код]
Клеточное ядро содержит молекулы ДНК, на которых записана генетическая информация организма. В ядре происходит репликация — удвоение молекул ДНК, а также транскрипция — синтез молекул РНК на матрице ДНК. В ядре же синтезированные молекулы РНК претерпевают некоторые модификации (например, в процессе сплайсинга из молекул матричной РНК исключаются незначащие, бессмысленные участки), после чего выходят в цитоплазму. Сборка рибосом также происходит в ядре, в специальных образованиях, называемых ядрышками.
Компартмент для ядра — кариотека — образован за счёт расширения и слияния друг с другом цистерн эндоплазматической сети таким образом, что у ядра образовались двойные стенки за счёт окружающих его узких компартментов ядерной оболочки. Полость ядерной оболочки называется люменом или перинуклеарным пространством. Внутренняя поверхность ядерной оболочки подстилается ядерной ламиной, жесткой белковой структурой, образованной белками-ламинами, к которой прикреплены нити хромосомной ДНК. В некоторых местах внутренняя и внешняя мембраны ядерной оболочки сливаются и образуют так называемые ядерные поры, через которые происходит материальный обмен между ядром и цитоплазмой.
Лизосомы[править | править код]
Лизосома — небольшое тельце, ограниченное от цитоплазмы одинарной мембраной и имеющее вид пузырька. В ней находятся литические ферменты, способные расщепить практически любые природные органические соединения. Основная функция — автолиз — то есть расщепление отдельных органоидов, участков цитоплазмы клетки.
Цитоскелет[править | править код]
К элементам цитоскелета относят белковые фибриллярные структуры, расположенные в цитоплазме клетки: микротрубочки, актиновые и промежуточные филаменты. Микротрубочки принимают участие в транспорте органелл, входят в состав органоидов движения — ресничек и жгутиков, характерных для некоторых клеток (например, инфузорий, сперматозоидов), из микротрубочек строится митотическое веретено деления. Актиновые филаменты необходимы для поддержания формы клетки, псевдоподиальных реакций. Роль промежуточных филаментов, по-видимому, также заключается в поддержании структуры клетки. Белки цитоскелета составляют несколько десятков процентов от массы клеточного белка.
Центриоли[править | править код]
Центриоли представляют собой цилиндрические белковые структуры, расположенные вблизи ядра клеток животных (у растений центриолей нет, за исключением низших водорослей). Центриоль представляет собой цилиндр, боковая поверхность которого образована девятью наборами микротрубочек. Количество микротрубочек в наборе может колебаться для разных организмов от 1 до 3.
Вокруг центриолей находится так называемый центр организации цитоскелета, район, в котором группируются минус-концы микротрубочек клетки.
Перед делением клетка содержит две центриоли, расположенные под прямым углом друг к другу. В ходе митоза они расходятся к разным концам клетки, формируя полюса веретена деления. После цитокинеза каждая дочерняя клетка получает по одной центриоли, которая удваивается к следующему делению. Удвоение центриолей происходит не делением, а путём синтеза новой структуры, перпендикулярной существующей.
Центриоли, по-видимому, гомологичны базальным телам жгутиков и ресничек.
Митохондрии[править | править код]
Митохондрии — особые органеллы клетки, основной функцией которых является синтез АТФ — универсального носителя энергии. Дыхание (поглощение кислорода и выделение углекислого газа) происходит также за счёт энзиматических систем митохондрий.
Внутренний просвет митохондрий, называемый матриксом, отграничен от цитоплазмы двумя мембранами, наружной и внутренней, между которыми располагается межмембранное пространство. Внутренняя мембрана митохондрии образует складки — кристы, на которых размещаются ферменты, ускоряющие реакции окисления жиров и углеводов. В матриксе содержатся различные ферменты, принимающие участие в дыхании и синтезе АТФ. Центральное значение для синтеза АТФ имеет водородный потенциал внутренней мембраны митохондрии.
Митохондрии имеют свой собственный ДНК-геном и прокариотические рибосомы, что, безусловно,
Земляные белки — Википедия
| ? Земляные белки | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Капская земляная белка (Xerus inauris) | ||||||||||||||||
| Научная классификация | ||||||||||||||||
| ||||||||||||||||
| Латинское название | ||||||||||||||||
| Xerus (Hemprich & Ehrenberg, 1833) | ||||||||||||||||
|
Земляные белки (лат. Xerus, от др.-греч. ξερός «сухой») — род африканских грызунов из семейства беличьих.
Содержание
- 1 Ареал и местообитания
- 2 Образ жизни
- 3 Классификация
- 4 Примечания
Земляные белки распространены на северо-востоке и западе Африки. Населяют саванны, светлые леса, полупустыни и пустыни.
Питаются семенами и плодами растений, съедобными корневищами и луковицами. Могут заметно вредить посевам арахиса и сладкого картофеля. Также питаются различными насекомыми, мелкими пресмыкающимися, яйцами птиц.
В роде земляных белок (Xerus) 3 подрода с 4 видами[1]:
- Подрод Xerus
- Рыжая земляная белка (Xerus rutilus)
- Подрод Euxerus
- Полосатая земляная белка (Xerus erythropus)
- Подрод Geosciurus
- Капская земляная белка (Xerus inauris)
- Дамарская земляная белка (Xerus princeps)
- ↑ Xerus Архивная копия от 22 мая 2011 на Wayback Machine в книге Wilson D. E. & Reeder D. M. (editors). 2005. Mammal Species of the World. A Taxonomic and Geographic Reference (3rd ed.). — Baltimore: Johns Hopkins University Press, 2 vols. (2142 pp.) ISBN 978-0-8018-8221-0 [1]
Тау-белок — Википедия
Материал из Википедии — свободной энциклопедии
Тау-белок (англ. Microtubule-associated protein tau, MAPT) принадлежит к группе белков, ассоциированных с микротрубочками (MAP). Альтернативный сплайсинг гена MAPT порождает в организме человека шесть известных изоформ белка[1][2]. Белок часто встречается в нейронах центральной нервной системы (ЦНС), и редко — в других местах, однако слабо экспрессируется в астроцитах и олигодендроцитах ЦНС[3].
При болезни Альцгеймера и некоторых других заболеваниях избыточно фосфорилированный тау-белок образует нейрофибриллярные клубки, прекращая стабилизировать микротрубочки.
Тау-белок был открыт в 1975 в лаборатории Marc Kirschner, Принстонский университет.[4]
 Нейроны, выращенные в культуре. Зелёным обозначены антитела к MAP2, а красным — к MAP tau. Синий цвет — ДНК, желтый — комбинация зеленого и красного.
Нейроны, выращенные в культуре. Зелёным обозначены антитела к MAP2, а красным — к MAP tau. Синий цвет — ДНК, желтый — комбинация зеленого и красного.- ↑ Goedert M., Wischik C.M., Crowther R.A., Walker J.E., Klug A. Cloning and sequencing of the cDNA encoding a core protein of the paired helical filament of Alzheimer disease: identification as the microtubule-associated protein tau (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1988. — June (vol. 85, no. 11). — P. 4051—4055. — DOI:10.1073/pnas.85.11.4051. — PMID 3131773.
- ↑ Goedert M., Spillantini M.G., Jakes R., Rutherford D., Crowther R.A. Multiple isoforms of human microtubule-associated protein tau: sequences and localization in neurofibrillary tangles of Alzheimer’s disease (англ.) // Neuron (англ.)русск. : journal. — Cell Press (англ.)русск., 1989. — October (vol. 3, no. 4). — P. 519—526. — DOI:10.1016/0896-6273(89)90210-9. — PMID 2484340.
- ↑ Shin R.W., Iwaki T., Kitamoto T., Tateishi J. Hydrated autoclave pretreatment enhances tau immunoreactivity in formalin-fixed normal and Alzheimer’s disease brain tissues (англ.) // Lab. Invest. (англ.)русск. : journal. — 1991. — May (vol. 64, no. 5). — P. 693—702. — PMID 1903170.
- ↑ Weingarten M.D., Lockwood A.H., Hwo S.Y., Kirschner M.W. A protein factor essential for microtubule assembly (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1975. — May (vol. 72, no. 5). — P. 1858—1862. — DOI:10.1073/pnas.72.5.1858. — PMID 1057175.
Предсказание функции белка — Википедия
Предсказа́ние фу́нкции белка́ — определение биологической роли белка и значения в контексте клетки. Предсказание функций проводится для плохо изученных белков или для гипотетических белков, предсказанных на основе данных геномных последовательностей. Источником информации для предсказания могут служить гомология нуклеотидных последовательностей, профили экспрессии генов, доменная структура белков, интеллектуальный анализ текстов публикаций, филогенетические и фенотипические профили, белок-белковые взаимодействия.
Функция белка — очень широкий термин: роли белков варьируются от катализа биохимических реакций до передачи сигнала и клеточного транспорта[en], и один белок может играть определённую роль в нескольких клеточных процессах[1].
В целом, функцию можно рассматривать как «всё, что происходит с белком или с его помощью». Проект «Генная Онтология» предложил полезную классификацию функций, в основе которого лежит список (словарь) четко сформулированных терминов, разделенных на три основные категории – молекулярные функции, биологические процессы и клеточные компоненты[2]. Из этой базы данных можно по названию белка или его идентификационному номеру найти присвоенные ему термины «Генной Онтологии» или аннотации, сделанные на основе расчётных или экспериментальных данных.
Несмотря на то что на сегодняшний день для экспериментального доказательства функций белка используются такие современные методы, как анализ микрочипов, РНК-интерференция и двугибридный анализ, технологии секвенирования продвинулись настолько, что темпы экспериментально доказательной характеристики открытых белков сильно отстают от темпов открытия новых последовательностей[3]. Поэтому аннотирование новых белковых последовательностей будет в основном осуществляться путём предсказания на основе вычислительных методов, так как таким образом можно осуществлять характеристику последовательностей гораздо быстрее и одновременно по нескольким генам/белкам. Первые методики предсказания функций были основаны на сходстве гомологичных белков с известными функциями (так называемое предсказание функций, основанное на гомологии). Дальнейшее развитие методов привело к появлению предсказаний на основе геномного контекста и на основе структуры белковой молекулы, что позволило расширить спектр получаемых данных и комбинировать методики, основанные на разных типах данных, для получения наиболее полной картины роли белка[3]. Ценность и производительность вычислительного предсказания функции генов подчеркивает тот факт, что по состоянию на 2010 год 98 % аннотаций Генной Онтологии были сделаны на основе автоматического извлечения из других баз аннотаций и только 0,6 % — на основе экспериментальных данных[4].
Методы, основанные на гомологии[править | править код]

Белки, имеющие сходные последовательности, как правило, являются гомологичными[5] и, стало быть, имеют сходную функцию. Поэтому в недавно секвенированных геномах белки обычно аннотируют по аналогии с последовательностями схожих белков из других геномов. Однако не всегда близкородственные белки выполняют одну и ту же функцию[6], например, дрожжевые белки Gal1 и Gal3 являются паралогами с 73 % и 92 % сходства, приобретшие в ходе эволюции очень разные функции: так, Gal1 является галактокиназой[en], а Gal3 — индуктором транскрипции[7]. К сожалению, нет четкого порога степени сходства по последовательности для безопасного предсказания функций; многие белки с одинаковой функцией имеют едва обнаруживаемые сходства, тогда как встречаются очень схожие по последовательности, но совершенно разные по функциям.
Методы, основанные на мотивах последовательностей[править | править код]
Развитие таких баз данных белковых доменов, как Pfam[8] позволяет находить в искомой последовательности уже известные домены для предположения возможных функций. В ресурсе dcGO[en][9] содержатся аннотации как к отдельным доменам, так и супра-доменам (т.е. комбинациям из двух или более последовательно расположенных доменов), что позволяет сделать предсказание более приближенным к реальности. Также, внутри самих белковых доменах содержатся более короткие характерные последовательности, связанные с определенными функциями (так называемые мотивы)[10], наличие которых в искомом белке можно определить поиском в базах данных мотивов, таких как PROSITE[en][11]. Мотивы также могут быть использованы для предсказания внутриклеточной локализации белка: наличие особых коротких сигнальных пептидов предопределяет, в какие органеллы белок будет транспортирован после синтеза, и было разработано множество ресурсов для определения таких сигнальных последовательностей[12], например, SignalP, который обновлялся несколько раз по мере развития методов[13]. Таким образом, некоторые особенности функции белков можно предсказать без сравнения с полноразмерными гомологичными последовательностями.
Методы, основанные на структуре белка[править | править код]

Поскольку 3D-структура белка, как правило, является более консервативной, чем белковая последовательность, сходство структур может указывать на сходство и функций белков. Было разработано много программ для поиска похожих укладок внутри базы данных белковых структур (Protein Data Bank)[14], например, FATCAT[15], CE[16], DeepAlign[17]. В случае, когда для искомой белковой последовательности нет решенной структуры, сначала составляют вероятную трехмерную модель последовательности, на основе которой в дальнейшем делается предсказание функции белка; так работает, например, сервер по предсказанию функции белка RaptorX. Во многих случаях вместо структуры всего белка, поиск ведется по структурам отдельных мотивов, содержащим, например, сайт связывания лиганда или активный сайт фермента. Для аннотации последних в новых белковых последовательностях была разработана база данных Catalytic Site Atlas[18].
Методы, основанные на геномном контексте[править | править код]
Многие из недавно появившихся методов прогнозирования основаны не на сравнении последовательностей или структуры, как описанные ранее, а на корреляции между новыми генами/белками и уже аннотированными: для каждого гена составляется филогенетический профиль (по наличию или отсутствию в различных геномах), которые затем сравнивают для установления функциональных связей (предполагается, что гены с одинаковыми профилями функциональны связаны друг с другом)[19]. В то время, как методы на основе гомологии часто используются для установления молекулярных функций, предсказание на основе геномного контекста может быть использовано для предположения биологического процесса, в котором участвует белок. Например, белки, участвующие в одном и том же пути передачи сигнала, имеют общий для всех видов геномный контекст.
Слияние генов[править | править код]
Когда два (или более) гена, кодирующие разные белки в одном организме, в процессе эволюции объединяются в один ген в другом организме, говорят, что произошло слияние генов (соответственно, при обратном процессе — разделение генов)[20]. Это явление было использовано при поиске гомологов для всех белковых последовательностей E. coli, когда обнаружилось, что более 6000 пар негомологичных друг другу последовательностей E. coli имеют общую гомологию с единичными генами в других геномах, что указывает на потенциальное взаимодействие между белками в каждой из пар, которое нельзя предсказать, отталкиваясь от одной лишь гомологии.
Колокализация/коэкспрессия[править | править код]
У прокариот в процессе эволюции часто сохраняются кластеры сближенных друг к другу генов, которые, как правило, кодируют белки, взаимодействующие между собой или входящих в один оперон. Поэтому, для предсказания функционального сходства между белками, по крайней мере, у прокариот, может быть использована близость расположения генов на хромосоме (метод, основанный на соседстве генов)[21]. Также в некоторых эукариотических геномах, включая Homo sapiens, для отдельных биологических путей было отмечено близкое расположение входящих в них генов[22], что с развитием методик может оказаться полезным при изучении белковых взаимодействий в эукариотах.
Гены, участвующие в одинаковых процессах, также часто транскрибируются совместно, поэтому можно предположить по ко-экспрессии с известными белками о сходной функции неаннотированного белка. На основании этого факта разрабатывают так называемые алгоритмы «вины в соучастии» (англ. guilt by association), которые используют для анализа больших объемов данных последовательностей и идентификации неизвестных белков по сходству с паттернами экспрессии уже известных генов[23][24]. В исследованиях «вины в соучастии» часто сравнивают группу генов-кандидатов с неизвестной функцией с целевой группой (например, с генами, четко ассоциированными с определенным заболеванием) и на основе собранных данных (например, ко-экспрессия генов, белок-белковые взаимодействия или филогенетические профили) классифицируют гены-кандидаты по степени сходства к целевой группе. К примеру, так как многие белки являются мультифункциональными, кодирующие их гены могут принадлежать одновременно сразу нескольким целевым группам, поэтому, такие гены будут чаще выявляться в исследованиях «вины в соучастии», и такие предсказания не являются специфичными.
С накоплением данных РНК-секвенирования, по которым можно оценить профили экспрессии изоформ белков, полученных путём альтернативного сплайсинга, были разработаны алгоритмы машинного обучения для прогнозирования функций на уровне изоформ[25].
Вычислительная топография растворителя[править | править код]
 Вычислительная топография растворителя белка AMA1, полученная в результате работы сервера FTMAP, в ходе которой было симулировано взаимодействие поверхности с 16 различными типами зондов, в результате чего были определены места локализации скопления зондов на поверхности[26]
Вычислительная топография растворителя белка AMA1, полученная в результате работы сервера FTMAP, в ходе которой было симулировано взаимодействие поверхности с 16 различными типами зондов, в результате чего были определены места локализации скопления зондов на поверхности[26]Одной из проблем, связанных с предсказанием функции белка, является обнаружение активного сайта, осложненное тем, что некоторые активные сайты не формируются до тех пор, пока белок не претерпевает конформационные изменения, вызванные связыванием малых молекул, например, молекул растворителя. Большинство белковых структур были получены методом рентгеноструктурного анализа, для которого требуется кристаллы чистого белка, в результате, в существующих трёхмерных моделях белков нельзя проследить конформационные изменения, необходимые для формирования активных сайтов. Вычислительная топография растворителя использует так называемые зонды (небольшие органические молекулы), которые в процессе компьютерной симуляции «перемещаются» по поверхности белка в поисках мест потенциального связывания и последующей кластеризации. Как правило, применяются несколько различных зондов с целью получения как можно большего числа различных конформационных структур «белок-зонд». Полученные структуры оценивают по средней свободной энергии. После множественных симуляций различными зондами место, где формируется наибольшее число кластеров, отождествляют с активным центром белка[27].
Этот метод представляет собой компьютерную адаптацию «мокрой» методики из статьи 1996 года. При наложении структур белка, полученных при растворении в различных органических растворителях, было обнаружено, что молекулы растворителя чаще всего скапливаются в активном центре белка. Эта работа была сделана с целью убрать оставшиеся молекулы воды, которые проявляются на картах электронной плотности, полученные рентгеноструктурным анализом: взаимодействуя с белком, они имеют тенденцию скапливаться в полярных областях белка. Это привело к идее промывать очищенный кристалл белка в различные растворители (такие как этанол, изопропанол) с целью установить в каком месте кластеризуются молекулы растворителя. Растворители можно выбирать из расчета с какими молекулами может взаимодействовать белок (например, выбор этанола в качестве зонда может отождествлять взаимодействие белка с серином, выбор изопропанола — с треонином, и т.д.). Очень важно, чтобы кристалл белка сохранял свою третичную структуру в каждом растворителе. После того, как процедуру промывания провели с несколькими растворителями, получают данные, на основе которых можно предположить потенциальные активные сайты белка[28].
- ↑ Rost B., Liu J., Nair R., Wrzeszczynski K. O., Ofran Y. Automatic prediction of protein function. (англ.) // Cellular and molecular life sciences : CMLS. — 2003. — Vol. 60, no. 12. — P. 2637—2650. — DOI:10.1007/s00018-003-3114-8. — PMID 14685688. [исправить]
- ↑ Ashburner M., Ball C. A., Blake J. A., Botstein D., Butler H., Cherry J. M., Davis A. P., Dolinski K., Dwight S. S., Eppig J. T., Harris M. A., Hill D. P., Issel-Tarver L., Kasarskis A., Lewis S., Matese J. C., Richardson J. E., Ringwald M., Rubin G. M., Sherlock G. Gene ontology: tool for the unification of biology. The Gene Ontology Consortium. (англ.) // Nature genetics. — 2000. — Vol. 25, no. 1. — P. 25—29. — DOI:10.1038/75556. — PMID 10802651. [исправить]
- ↑ 1 2 Gabaldón T., Huynen M. A. Prediction of protein function and pathways in the genome era. (англ.) // Cellular and molecular life sciences : CMLS. — 2004. — Vol. 61, no. 7-8. — P. 930—944. — DOI:10.1007/s00018-003-3387-y. — PMID 15095013. [исправить]
- ↑ du Plessis L., Skunca N., Dessimoz C. The what, where, how and why of gene ontology—a primer for bioinformaticians. (англ.) // Briefings in bioinformatics. — 2011. — Vol. 12, no. 6. — P. 723—735. — DOI:10.1093/bib/bbr002. — PMID 21330331. [исправить]
- ↑ Reeck G. R., de Haën C., Teller D. C., Doolittle R. F., Fitch W. M., Dickerson R. E., Chambon P., McLachlan A. D., Margoliash E., Jukes T. H. «Homology» in proteins and nucleic acids: a terminology muddle and a way out of it. (англ.) // Cell. — 1987. — Vol. 50, no. 5. — P. 667. — PMID 3621342. [исправить]
- ↑ Whisstock J. C., Lesk A. M. Prediction of protein function from protein sequence and structure. (англ.) // Quarterly reviews of biophysics. — 2003. — Vol. 36, no. 3. — P. 307—340. — PMID 15029827. [исправить]
- ↑ Platt A., Ross H. C., Hankin S., Reece R. J. The insertion of two amino acids into a transcriptional inducer converts it into a galactokinase. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2000. — Vol. 97, no. 7. — P. 3154—3159. — PMID 10737789. [исправить]
- ↑ Finn R. D., Mistry J., Tate J., Coggill P., Heger A., Pollington J. E., Gavin O. L., Gunasekaran P., Ceric G., Forslund K., Holm L., Sonnhammer E. L., Eddy S. R., Bateman A. The Pfam protein families database. (англ.) // Nucleic acids research. — 2010. — Vol. 38. — P. D211–222. — DOI:10.1093/nar/gkp985. — PMID 19920124. [исправить]
- ↑ Fang H., Gough J. DcGO: database of domain-centric ontologies on functions, phenotypes, diseases and more. (англ.) // Nucleic acids research. — 2013. — Vol. 41. — P. D536–544. — DOI:10.1093/nar/gks1080. — PMID 23161684. [исправить]
- ↑ Sleator R. D., Walsh P. An overview of in silico protein function prediction. (англ.) // Archives of microbiology. — 2010. — Vol. 192, no. 3. — P. 151—155. — DOI:10.1007/s00203-010-0549-9. — PMID 20127480. [исправить]
- ↑ Sigrist C. J., Cerutti L., de Castro E., Langendijk-Genevaux P. S., Bulliard V., Bairoch A., Hulo N. PROSITE, a protein domain database for functional characterization and annotation. (англ.) // Nucleic acids research. — 2010. — Vol. 38. — P. D161–166. — DOI:10.1093/nar/gkp885. — PMID 19858104. [исправить]
- ↑ Menne K. M., Hermjakob H., Apweiler R. A comparison of signal sequence prediction methods using a test set of signal peptides. (англ.) // Bioinformatics. — 2000. — Vol. 16, no. 8. — P. 741—742. — PMID 11099261. [исправить]
- ↑ Petersen T. N., Brunak S., von Heijne G., Nielsen H. SignalP 4.0: discriminating signal peptides from transmembrane regions. (англ.) // Nature methods. — 2011. — Vol. 8, no. 10. — P. 785—786. — DOI:10.1038/nmeth.1701. — PMID 21959131. [исправить]
- ↑ Berman H. M., Westbrook J., Feng Z., Gilliland G., Bhat T. N., Weissig H., Shindyalov I. N., Bourne P. E. The Protein Data Bank. (англ.) // Nucleic acids research. — 2000. — Vol. 28, no. 1. — P. 235—242. — PMID 10592235. [исправить]
- ↑ Ye Y., Godzik A. FATCAT: a web server for flexible structure comparison and structure similarity searching. (англ.) // Nucleic acids research. — 2004. — Vol. 32. — P. 582—585. — DOI:10.1093/nar/gkh530. — PMID 15215455. [исправить]
- ↑ Shindyalov I. N., Bourne P. E. Protein structure alignment by incremental combinatorial extension (CE) of the optimal path. (англ.) // Protein engineering. — 1998. — Vol. 11, no. 9. — P. 739—747. — PMID 9796821. [исправить]
- ↑ Wang S., Ma J., Peng J., Xu J. Protein structure alignment beyond spatial proximity. (англ.) // Scientific reports. — 2013. — Vol. 3. — P. 1448. — DOI:10.1038/srep01448. — PMID 23486213. [исправить]
- ↑ Porter C. T., Bartlett G. J., Thornton J. M. The Catalytic Site Atlas: a resource of catalytic sites and residues identified in enzymes using structural data. (англ.) // Nucleic acids research. — 2004. — Vol. 32. — P. D129–133. — DOI:10.1093/nar/gkh028. — PMID 14681376. [исправить]
- ↑ Eisenberg D., Marcotte E. M., Xenarios I., Yeates T. O. Protein function in the post-genomic era. (англ.) // Nature. — 2000. — Vol. 405, no. 6788. — P. 823—826. — DOI:10.1038/35015694. — PMID 10866208. [исправить]
- ↑ Marcotte E. M., Pellegrini M., Ng H. L., Rice D. W., Yeates T. O., Eisenberg D. Detecting protein function and protein-protein interactions from genome sequences. (англ.) // Science (New York, N.Y.). — 1999. — Vol. 285, no. 5428. — P. 751—753. — PMID 10427000. [исправить]
- ↑ Overbeek R., Fonstein M., D’Souza M., Pusch G. D., Maltsev N. The use of gene clusters to infer functional coupling. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1999. — Vol. 96, no. 6. — P. 2896—2901. — PMID 10077608. [исправить]
- ↑ Lee J. M., Sonnhammer E. L. Genomic gene clustering analysis of pathways in eukaryotes. (англ.) // Genome research. — 2003. — Vol. 13, no. 5. — P. 875—882. — DOI:10.1101/gr.737703. — PMID 12695325. [исправить]
- ↑ Walker M. G., Volkmuth W., Sprinzak E., Hodgson D., Klingler T. Prediction of gene function by genome-scale expression analysis: prostate cancer-associated genes. (англ.) // Genome research. — 1999. — Vol. 9, no. 12. — P. 1198—1203. — PMID 10613842. [исправить]
- ↑ Klomp J. A., Furge K. A. Genome-wide matching of genes to cellular roles using guilt-by-association models derived from single sample analysis. (англ.) // BMC research notes. — 2012. — Vol. 5. — P. 370. — DOI:10.1186/1756-0500-5-370. — PMID 22824328. [исправить]
- ↑ Eksi R., Li Hong-Dong, Menon R., Wen Yuchen, Omenn G. S., Kretzler M., Guan Yuanfang. Systematically Differentiating Functions for Alternatively Spliced Isoforms through Integrating RNA-seq Data // PLOS Computational Biology. — 2013. — Vol. 9, no. 11. — P. e1003314. — DOI:10.1371/journal.pcbi.1003314. — PMID 24244129. [исправить]
- ↑ Wang G., MacRaild C. A., Mohanty B., Mobli M., Cowieson N. P., Anders R. F., Simpson J. S., McGowan S., Norton R. S., Scanlon M. J. Molecular insights into the interaction between Plasmodium falciparum apical membrane antigen 1 and an invasion-inhibitory peptide. (англ.) // Public Library of Science ONE. — 2014. — Vol. 9, no. 10. — P. e109674. — DOI:10.1371/journal.pone.0109674. — PMID 25343578. [исправить]
- ↑ Clodfelter K. H., Waxman D. J., Vajda S. Computational solvent mapping reveals the importance of local conformational changes for broad substrate specificity in mammalian cytochromes P450. (англ.) // Biochemistry. — 2006. — Vol. 45, no. 31. — P. 9393—9407. — DOI:10.1021/bi060343v. — PMID 16878974. [исправить]
- ↑ Mattos C., Ringe D. Locating and characterizing binding sites on proteins. (англ.) // Nature biotechnology. — 1996. — Vol. 14, no. 5. — P. 595—599. — DOI:10.1038/nbt0596-595. — PMID 9630949. [исправить]



Добавить комментарий