Глауберова соль — Википедия
Глауберова соль (мирабилит) — Na2SO4·10H2O, десятиводный кристаллогидрат (декагидрат) сульфата натрия. Впервые обнаружена химиком И. Р. Глаубером в составе минеральных вод, а впоследствии синтезирована действием серной кислоты на хлорид натрия. Применяется в стекольном и содовом производстве, в медицине.
Другие названия: Sal glauberi, мирабилит, сибирская соль, гуджир, сернокислый натрий.
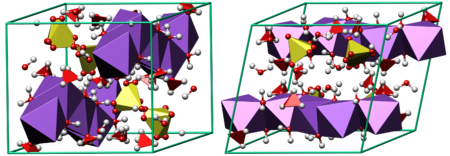 Кристаллическая структура мирабилита
Кристаллическая структура мирабилитаПредставляет собой большие прозрачные кристаллы в форме призм. Имеет горький солёный вкус и тает на языке. Не имеет запаха. Хорошо растворима в воде. Не горит, в огне не трещит. При длительном нахождении на воздухе или нагревании выветривается (выпаривается) и теряет массу. При полном выветривании становится обычным сульфатом натрия — порошком белого цвета.
Кроме само́й десятиводной глауберовой соли известны ромбические кристаллы семиводного кристаллогидрата Na
Природный минерал глауберовой соли называется мирабилит. Его плотность составляет всего 1,49 г/см³, что делает его одним из самых лёгких минералов.
Залежи порядка 100 млн тонн мирабилита обнаружены близ провинции Саскачеван в центральной части Канады.
В Грузии в XIX веке мирабилит был обнаружен в 30 км от г. Тбилиси. Эти залежи представляли собой высохшее солёное озеро площадью около 55 тыс. м². Пласт мирабилита толщиной порядка 5 метров был сверху покрыт пластом песчаной глины толщиной от 30 см до 4,5 м.
В зимнее время, в период примерно с 20 ноября по 15 марта, когда температура воды Каспийского моря опускается до 5,5−6 °C, мирабилит выпадает в больших количествах из вод залива Кара-Богаз-Гол в Туркмении, оседая бесцветными кристаллами на дне и берегах залива.
Мирабилит также содержится в озере Кучук в Западной Сибири, в соляных озёрах Томской области, в Алтайском крае (оз. Большое Яровое и Бурлинское оз.)).
В других месторождениях, например, в Калифорнии (США), Сицилии, Германии, в Большом Малиновском озере (Астраханская область), мирабилит встречается с примесями других минералов — астраханита Na2Mg(SO4)2 · 4H2O, левеита Na2Mg(SO4)2 · 2,5H2O, вантгоффита Na6Mg(SO4)4, глауберита Na2Ca(SO4)2, глазерита Na2K6(SO4)4.
В растворённом виде глауберова соль в значительном количестве присутствует в морской воде и во многих минеральных водах, например, курортов Карловы Вары, Мариенбад в Чехии. Карловарская соль, получаемая из минеральных вод Карловых Вар, на 44% состоит из сульфата натрия (глауберовой соли), на 36% из гидрокарбоната натрия (пищевой соды), на 18% из хлорида натрия (поваренной соли) и на 2% из сульфата калия.
Также мирабилит встречается в виде налёта и корок на залежах гипса и каменной соли.
Очень редко в природе встречается безводный сульфат натрия — минерал тенардит, названный в честь французского химика Л. Ж. Тенара. Для его сохранения в безводном виде необходимы засушливые пустынные зоны. Поэтому такие залежи обнаружены в Чили, в Центральной Азии, в штате Аризона (США), а также в Испании в долине реки Эбро.
Открытие глауберовой соли датировано зимой 1626 года и непосредственно связано с перенесённой в 1625 году Глаубером болезнью — сыпным тифом, в то время именуемого «венгерской лихорадкой». Вот как сам Глаубер описывал это:
Несколько оправившись от болезни, я прибыл в Неаполис (латинизированное название Нойштадта, по-немецки — «нового города»; в Германии несколько городов имеют такое название). Там у меня снова начались приступы, и я должен был остаться в этом городе. Болезнь настолько ослабила мой желудок, что он не мог ни принимать, ни переваривать никакую еду. Местные жители посоветовали мне пойти к источнику, находящемуся вблизи виноградника в часе ходьбы от города. Они сказали, что вода источника вернет мне аппетит. Следуя их совету, я взял с собой большой кусок хлеба; мне сказали, что должен буду весь его съесть, но я мало верил в то, что это мне как-то поможет. Придя к источнику, я намочил хлебный мякиш в воде и съел его — причём с большим удовольствием, хотя перед этим не мог смотреть без отвращения на самые изысканные лакомства. Взяв оставшуюся от хлеба корку, я зачерпнул ею воды из источника и выпил её. Это настолько возбудило мой аппетит, что в конце концов я съел и «чашку» из хлеба, которой черпал воду. Домой я возвратился значительно окрепшим и поделился своими впечатлениями с соседями. Я чувствовал, что если буду и дальше лечиться этой водой, функции моего желудка полностью восстановятся. Я спросил, что это за вода. Мне сказали, что в ней содержится селитра, чему тогда, не будучи искушён в подобных вопросах, я поверил.
Глаубер заинтересовался химическим составом воды источника и посвятил этому изучению всю следующую зиму. Он подружился с местным аптекарем Айснером и использовал его лабораторию для опытов. В ходе исследований он выпаривал минеральную воду и анализировал осадки. Вместо селитры в осадке оказалась ранее неизвестная соль, которую он назвал «чудесной» — по латыни «sal mirabile». В частности, название природного минерала мирабилита происходит именно из латинского названия.
Спустя много лет, в 1648 году, Глаубер проводил опыты с кислотами, а точнее получал соляную кислоту путём нагревания обычной каменной соли с серной кислотой. При слабом нагревании шла реакция образования гидросульфата натрия: NaCl + H2SO4 = NaHSO4 + HCl, а при сильном — сульфата натрия: 2NaCl + H2SO4 = Na2SO4 + 2HCl. Каково же было удивление Глаубера, когда он обнаружил, что большие прозрачные кристаллы, выпавшие в осадок, оказались той самой «чудесной солью», с которой он познакомился в молодости. В результате одной реакции Глаубер открыл и способ получения соляной кислоты, и синтеза сульфата натрия.
Используется при производстве соды, гипосульфата, ультрамарина; кроме того, в стекольной промышленности, в холодильном деле, в медицине. Глауберова соль применяется в медицине при запорах, как слабительное средство внутрь по 15—30 г на приём.
Мирабилит в художественной литературе[править | править код]
В 1932 году в Советском Союзе публикуется производственная повесть Константина Паустовского «Кара-Бугаз». Это произведение рассказывает о непростой добыче глауберовой соли в заливе Кара-Богаз-Гол и о тех богатствах природы, которые должен освоить человек. После публикации этого произведения коллеги по писательскому цеху стали называть Паустовского «мирабилит нашей литературы».[1]
- ↑ Литературоведческие заметки о К. Г. Паустовским или его же автобиографическая «Повесть о жизни».
- Илья Леенсон. Чудесная соль Иоганна Глаубера. // Энциклопедия для детей. Том 17. Химия. М.: Аванта+, 2000, с. 457; 2-е изд, перераб., 2006, с.463.
- Химический словарь школьника / Б. Н. Кочергин, Л. Я. Горностаева, В. М. Макаревский, О. С. Аранская. — Мн.: Народная асвета, 1990. — 255 с. — 75 000 экз. — ISBN 5-341-00127-3.
Минерал — Википедия
Не следует путать с минеральными добавками (биологически значимые элементы, биологически активные добавки).

Минера́л (нем. Мineral или фр. minéral, от позднелат. (аеs) minerale — руда[1]) — однородная по составу и строению часть горных пород, руд, метеоритов, являющаяся естественным продуктом геологических процессов и представляющая собой химическое соединение или химический элемент; минерал может находиться в любом агрегатном состоянии, при этом большинство минералов — твёрдые тела.
Минералы подразделяют на имеющие кристаллическую структуру, аморфные и минералы, имеющие внешнюю форму кристаллов, но находящиеся в аморфном состоянии (метамиктные минералы).[2][3] Горная порода может состоять из нескольких породообразующих минералов разного вида (полиминеральная порода), или из единственного породообразующего минерала (мономинеральная порода). В литературе применяется также словосочетание — Минеральный материал.
Термин «минерал» используют для обозначения минеральных индивида, вида и разновидности[4]. Минерал как минеральный вид — это природное химическое соединение, имеющее определённый химический состав и кристаллическую структуру. Если различия в химическом составе при структурной идентичности не очень велики, то по окраске, морфологическим или другим особенностям выделяют минеральные разновидности — например горный хрусталь, аметист, цитрин, халцедон являются разновидностями кварца. Минеральные индивиды — минеральные тела, между которыми имеются поверхности раздела, например, кристаллы и зёрна
Изучением минералов занимается наука минералогия. Происхождение минералов выясняет генетическая минералогия, а изучением минеральных видов занимается филогения минералов.
С 1950-х годов факт открытия нового минерала и его название утверждает Комиссия по новым минералам и названиям минералов Международной минералогической ассоциации (ММА)[5]. В настоящее время установлено более 5336[6] минеральных видов и ежегодно комиссией утверждается несколько десятков новых, однако лишь 100—150 минералов широко распространены.
Минералами считаются также некоторые природные вещества, представляющие собой в атмосферных условиях жидкости (например, самородная ртуть, которая приходит к кристаллическому состоянию при более низкой температуре). Воду, напротив, к минералам не относят, рассматривая её как жидкое состояние (расплав) минерала лёд. Некоторые минералы находятся в аморфном состоянии и не имеют кристаллической структуры. Это относится главным образом к так называемым метамиктным минералам, имеющим внешнюю форму кристаллов, но находящимся в аморфном, стеклоподобном состоянии вследствие разрушения их изначальной кристаллической решётки под действием жёсткого радиоактивного излучения, входящих в их собственный состав радиоактивных элементов (уран, торий и так далее). Различают минералы явно кристаллические, аморфные — метаколлоиды (например, опал, лешательерит и другие) и метамиктные минералы, имеющие внешнюю форму кристаллов, но находящиеся в аморфном, стеклоподобном состоянии.
 Галенит, PbS имеет высокий показатель удельной плотности
Галенит, PbS имеет высокий показатель удельной плотностиФизические свойства минералов обусловлены их кристаллической структурой и химическим составом. Различают
Габитус кристаллов выясняется при визуальном осмотре, для рассматривания мелких образцов используется лупа. Помимо внешней формы кристаллов и других выделений, важное значение при описании и визуальной диагностике минералов, особенно в полевых условиях, имеют цвет, блеск, спайность и отдельность, твёрдость, хрупкость и излом[7]. При диагностике некоторых минералов имеют значение также ковкость, гибкость (сопротивление излому) и упругость.
- Твёрдость. Определяется по шкале Мооса. По этой шкале, самым твёрдым эталонным минералом является алмаз (10 по шкале Мооса, с абсолютной твёрдостью 1600), а самым мягким является тальк (1 по шкале Мооса, с абсолютной твёрдостью 1, царапается ногтем). Твёрдость минерала не всегда одинакова со всех сторон кристалла, что является производным от его кристаллической структуры — в одних направлениях кристаллическая решётка может быть упакована плотнее, чем в других. Например, кианит имеет твёрдость 5.5 по шкале Мооса в одном направлении и 7 в другом.
- Спайность — способность минерала раскалываться по определённым кристаллографическим направлениям.
- Излом — специфика поверхности минерала на свежем не спайном сколе.
- Побежалость — тонкая цветная или разноцветная плёнка, которая образуется на выветрелой поверхности некоторых минералов за счёт окисления.
- Хрупкость — прочность минеральных зёрен (кристаллов), обнаруживающаяся при механическом раскалывании. Хрупкость иногда увязывают или путают с твёрдостью, что неверно. Иные очень твёрдые минералы могут с лёгкостью раскалываться, то есть быть хрупкими (например, алмаз)
- Плотность — масса единицы объёма вещества, выражается в г/см3. Прежнее, устаревшее название — удельный вес; его ещё можно встретить в старых минералогических учебниках. Удельная плотность — характеристика, используемая для определения единичной массы минерала, представляет собой отношение плотности (массы на единицу объёма) минерала к плотности воды. Удельная плотность может служить диагностическим признаком для некоторых классов минералов. Среди часто встречающихся минералов более высокую удельную плотность имеют оксиды и сульфиды, поскольку они включают в себя элементы с высокой атомной массой. Наиболее высокой удельной плотностью обладают самородные металлы и интерметаллиды. Камасит (никелистое метеоритное железо) имеет удельную плотность 7.9[8], а плотность самородного золота достигает 19.3 г/см3.
Оптические свойства[править | править код]
- Блеск — световой эффект, вызываемый отражением части светового потока, падающего на минерал. Зависит от отражательной способности минерала.
- Цвет — признак, с определённостью характеризующий одни минералы (зелёный малахит, синий лазурит, красная киноварь), и очень обманчивый у ряда других минералов, окраска которых может варьировать в широком диапазоне в зависимости от наличия примесей элементов-хромофоров либо специфических дефектов в кристаллической структуре (флюориты, кварцы, турмалины).
- Цвет черты — цвет минерала в тонком порошке, обычно определяемый царапанием по шершавой поверхности фарфорового бисквита.
- Преломление, дисперсия и поляризация характеризуют их оптические константы: показатель преломления, угол между оптическими осями, оптический знак кристалла, ориентация оптической индикатрисы и др.
Магнитные свойства[править | править код]
Магнитность зависит от содержания главным образом двухвалентного железа, обнаруживается при помощи обычного магнита.
- По распространённости минералы можно разделить на:
- породообразующие — составляющие основу большинства горных пород;
- акцессорные — часто присутствующие в горных породах, но редко слагающие больше 5 % породы;
- редкие минералы — находки которых единичны или немногочисленны;
- рудные — содержащие в своём составе промышленно ценные компоненты и образующие значительные скопления в рудных месторождениях.
- По форме нахождения минералов различают
- Минеральные индивиды — составные части минеральных агрегатов. Это отдельные кристаллы, зерна и сферические или близкие к сферическим выделения минералов, отделенные друг от друга физическими поверхностями раздела и представляющие собой форму нахождения минеральных видов в природе. Минеральный индивид — исходное понятие минералогии, означающее зерна и идиоморфные кристаллы, в виде которых в природе представлены минеральные виды; индивиды могут быть зернами — «монокристаллами» или сферокристаллами, из которых строятся простые минеральные агрегаты (Ю. М. Дымков, 1966)
- Минеральные агрегаты — срастания минеральных индивидов одного и того же или разных минералов. Они могут быть одно- и многоэтапными. Минеральный агрегат — исходное понятие минералогии. На уровне организации вещества, следующем за понятием «индивид», агрегат — это скопление индивидов, не обладающее при идеальном развитии чёткими признаками симметричных фигур (это принципиальное отличие от индивидов — по Ю. М. Дымкову, 1966).
- Минеральные тела — скопления минеральных агрегатов, обладающие естественными границами. Размеры их варьируют от микроскопических до очень крупных, соизмеримых с масштабом геологических объектов.
Распространённость минералов на Земле является прямым следствием их химического состава, который, в свою очередь, зависит от распространённости различных химических элементов. Большинство наблюдаемых минералов добываются из земной коры. Большинство минералов имеют в своём основном составе всего 8 элементов, наиболее распространённых в земной коре: кислород, кремний, алюминий, железо, магний, кальций, натрий и калий (по степени убывания). Вместе эти восемь элементов составляют до 98 % от веса земной коры. Из этих восьми особое значение имеют кислород, составляющий 46,6 % от веса земной коры, и кремний, составляющий 27,7 %[9].
Химический состав минералов, как правило, близок по своему составу той породе, из которой они сформировались. Так из магмы, богатой железом и магнием, сформируется оливин, а магма, богатая силикатами, кристаллизуется в богатый силикатами минерал — как, например, кварц. В известняке, богатом кальцием и карбонатами, формируются кальциты.
Химический состав может изменяться между членами ряда минералов. Например, плагиоклазы, входящие в группу каркасных алюмосиликатов — полевых шпатов, по химическому составу представляют собой непрерывный изоморфный ряд натриево-кальциевых алюмосиликатов — альбита и анортита с неограниченной смесимостью. Имеются 4 опознанные разновидности между богатым натрием альбитом и богатым кальцием анортитом — олигоклаз, андезин, лабрадор и битовнит[10][11]. Другие примеры подобных рядов включают в себя оливиновый ряд от богатого магнием форстерита до богатого железом фаялита[12] и вольфрамитовый ряд от богатого марганцем гюбнерита до богатого железом ферберита[13].
Наличие минеральных рядов объясняется химической субституцией. В природе минералы не являются чистыми материалами. В них присутствуют примеси, состоящие из любых элементов, находящихся в данной химической системе. В результате иногда определённый элемент подменяется другим[14]. Такая подмена обычно происходит между ионами похожих размеров и одинаковых зарядов. Например, K+ не может подменить Si4+ из-за химической и структурной несовместимости, вызванной большим различием в размерах и в заряде, а подмена Si4+ на Al3+ происходит достаточно часто, так как они близки по размеру, заряду и распространённости в земной коре, что мы и наблюдаем на примере плагиоклазов.
Изменения температуры, давления и химического состава влияют на минералогический состав данной породы. Изменения химического состава могут быть вызваны такими процессами, как эрозия почвы и выветривание, а также метасоматизмом. Изменения температуры и давления происходят, когда материнская порода проходит тектонический или магматический сдвиг в иной физический режим. Изменения в термодинамических условиях благоприятно влияют на возможность реакции между уже сформировавшимися минералами с получением новых минералов[15].
Классификация минералов[править | править код]
Современные классификации минералов проводятся на структурно-химической основе[16]. Классификация утверждённая Международной минералогической ассоциацией (IMA) в 2009 году, периодически обновляется и утверждается заново.
Неорганические минералы[править | править код]
Самородные элементы и интерметаллические соединения[править | править код]
Карбиды, нитриды, фосфиды[править | править код]
Сульфиды, сульфосоли и подобные[править | править код]
- класс Селениды, Теллуриды, арсениды и подобные
- класс Сульфосоли
Галоидные соединения (галогениды) и галогеносоли[править | править код]
- класс Фториды, алюмофториды
- класс Хлориды, бромиды и иодиды
Окислы и гидроокислы[править | править код]
- класс Простые и сложные окислы
- класс Гидроокислы
Кислородные соли (оксисоли)[править | править код]
- класс Иодаты
- класс Нитраты
- класс Карбонаты
- класс Сульфаты и селенаты
- класс Хроматы
- Класс Вольфраматы и молибдаты
- Класс Фосфаты, арсенаты и ванадаты
- Класс Бораты
- Класс Силикаты и алюмосиликаты (бериллосиликаты, боросиликаты)
- Островные силикаты с изолированными тетраэдрами SiO4
- Цепочечные силикаты с изолированными группами тетраэдров SiO4
- Ленточные силикаты с непрерывными цепочками и лентами тетраэдров SiO4
- Слоистые силикаты с непрерывными слоями тетраэдров SiO4
- Каркасные силикаты с непрерывными трёхмерными каркасами тетраэдров SiO4 и Al04
Органические минералы[править | править код]
Согласно современной номенклатуре минералов, утверждённой ММА, в числе минералов рассматриваются некоторые из природных солеподобных органических соединений (оксалаты, меллитаты, ацетаты и др), объединяемые в класс органические вещества. При этом в общей систематике минералов высокомолекулярные органические образования типа древесных смол и битумов, не отвечающие в большинстве случаев требованиям кристалличности и однородности, в число минералов не включаются. Некоторые органические вещества — нефть, асфальты, битумы раньше ошибочно относили к минералам. Они лишены кристаллической структуры и не могут быть охарактеризованы с кристаллохимической точки зрения. Природные органические продукты в большинстве случаев относятся либо к горным породам (антрацит, шунгит и др.), либо к природным углеводородам группы нефти (озокерит, битумы), либо к ископаемым смолам (янтарь, копал), либо к биогенным образованиям, содержащим в своём составе тот или иной минерал (жемчуг и перламутр, в строении которых участвует минерал арагонит).
Природные формиаты (формикаит Ca(HCOO)2, дашковаит Mg(HCOO)2•2H2O и др.) и оксалаты (степановит и др.) в минералогии относят к классу Органические вещества.
Минералы, наряду с органическими материалами, находят широкое применение.
Человек использовал минералы с древнейших времён. Долгое время основным полезным ископаемым был кремень — тонкозернистая разновидность кварца, его отщепы с острыми краями первобытные люди использовали ещё в древнем каменном веке. Кроме него применялись и другие минералы, например, вишневый гематит, желто-коричневый гётит и черные оксиды марганца — как краски, а янтарь, нефрит, самородное золото и др. — как материал для украшений и т. п. В доисторическом Египте (5000—3000 до н. э.) из самородной меди, золота и серебра делали украшения. Позже стали использовать бронзу для изготовления оружия и орудий труда[7]. Сейчас из минералов получают металлы и другие химические элементы и соединения[4], они являются сырьём для производства строительных материалов (цемент, стекло и др.) и для химической промышленности. Минералы могут использоваться в качестве красителей[7], абразивных и огнеупорных материалов, они находят применение в керамике, оптике, радиоэлектронике, электротехнике и радиотехнике. Драгоценные камни тоже являются минералами[4].
Минералы используются в пищу, как источник сырья, в качестве валюты, как предметы искусства и роскоши и как компоненты высоких технологий. Одним из видов шарлатанства является литотерапия — лечение минералами путём их ношения, прикладывания, вступления в астральные контакты с якобы заключёнными в камнях и кристаллах сверхъестественными энергиями и магическими силами. Приверженцы литотерапии утверждают, что каждый кристаллический объект обладает свойствами излучения и поглощения неведомых энергий и полей, которые при «правильном» приложении к биологическому телу способны восстанавливать нарушенный энергетический баланс организма. Литотерапия не имеет под собой клинически доказанных обоснований и научной базы[17].
- ↑ Фасмер М. Этимологический словарь русского языка. — Прогресс. — М., 1964–1973. — Т. 2. — С. 623—624.
- ↑ Бетехтин А. Г. Минералогия и понятие о минерале // Курс минералогии. 3-е изд., исправленное и дополненное. М.: Кн. дом Университет, 2014. С. 11-13
- ↑ 1 2 3 Минерал // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ 1 2 3 Минерал. Химическая энциклопедия.
- ↑ Расцветаева Р. К. Как открыть новый минерал (рус.) // Природа. — Наука, 2006. — № 5.
- ↑ Ernst A.J. Burke. International Mineralogical Association — Commission on New Minerals, Nomenclature and Classification (неопр.) (недоступная ссылка). nrmima.nrm.se. Дата обращения 13 мая 2018. Архивировано 10 августа 2019 года.
- ↑ 1 2 3 МИНЕРАЛЫ И МИНЕРАЛОГИЯ (неопр.). Энциклопедия Кольера.
- ↑ Kamacite (неопр.). Webmineral.com. Дата обращения 2 августа 2012. Архивировано 13 мая 2013 года.
- ↑ Dyar and Gunter, pp. 4-7
- ↑ Дир У.-А., Хауи Р.-А., Зусман Дж., Породообразующие минералы, пер. с англ., т. 4, М., 1966
- ↑ Марфунин А. С., Полевые шпаты — фазовые взаимоотношения, оптические свойства, геологическое распределение, М., 1962.
- ↑ Фаялит в базе webmineral.com (англ.)
- ↑ Характеристика вольфрамита (англ.)
- ↑ Dyar and Gunter, p. 141
- ↑ Dyar and Gunter, p. 549
- ↑ Бетехтин А. Г. Классификация и номенклатура минералов // Курс минералогии. 3-е изд., исправленное и дополненное. М.: Кн. дом Университет, 2014. 151—158.
- ↑ Lawrence E. Jerome. Crystal Power: The Ultimate Placebo Effect. Prometheus Books, 1989
- Земятченский П. А. Минерал // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Busbey, A.B.; Coenraads, R.E.; Roots, D.; Willis, P. Rocks and Fossils (неопр.). — San Francisco: Fog City Press, 2007. — ISBN 978-1-74089-632-0.
- Chesterman, C.W.; Lowe, K.E. Field guide to North American rocks and minerals (англ.). — Toronto: Random House of Canada (англ.)русск., 2008. — ISBN 0-394-50269-8.
- Dyar, M.D.; Gunter, M.E. Mineralogy and Optical Mineralogy (неопр.). — Chantilly, Virginia: Mineralogical Society of America (англ.)русск., 2008. — ISBN 978-0-939950-81-2.
Неорганические кислоты — Википедия
Неоргани́ческие (минера́льные) кисло́ты — неорганические вещества, обладающие комплексом физико-химических свойств, которые присущи кислотам. Вещества кислотной природы известны для большинства химических элементов за исключением щелочных и щёлочноземельных металлов.
Свойства и классификация неорганических кислот[править | править код]
Формы существования и агрегатное состояние[править | править код]
Большинство неорганических кислот при обычных условиях существуют в жидком состоянии, некоторые – в твёрдом состоянии (ортофосфорная, борная, вольфрамовая, поликремниевые (гидраты SiO2) и др.). Кислотами также являются водные растворы некоторых газообразных соединений (галогеноводородов, сероводорода H2S, диоксида азота NO2, диоксида углерода CO2 и др.). Некоторые кислоты (например, угольную Н2СО3, сернистую Н2SO3, хлорноватистую HClO и др.) невозможно выделить в виде индивидуальных соединений, они существуют только в растворе.
По химическому составу различают бескислородные кислоты (HCl, H2S, HF, HCN) и кислородсодержащие (оксокислоты)(H2SO4, H3PO4)[1]. Состав бескислородных кислот можно описать формулой: HnХ, где Х — химический элемент образующий кислоту (галоген, халькоген) или бескислородный радикал: например, бромоводородная HBr, циановодородная HCN, азидоводородная HN3 кислоты. В свою очередь, все кислородсодержащие кислоты имеют состав, который можно выразить формулой: НnXОm, где X — химический элемент, образующий кислоту.
 Таутомерные формы родановодородной кислоты
Таутомерные формы родановодородной кислоты 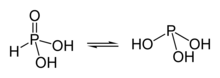 Таутомерные формы фосфористой кислоты
Таутомерные формы фосфористой кислотыАтомы водорода в кислородсодержащих кислотах чаще всего связаны с кислородом полярной ковалентной связью. Известны кислоты с несколькими (чаще двумя) таутомерными или изомерными формами, которые различаются положением атома водорода:
Отдельные классы неорганических кислот образуют соединения, в которых атомы кислотообразующего элемента образуют молекулярные гомо- и гетерогенные цепные структуры. Изополикислоты — это кислоты, в которых атомы кислотообразующего элемента связаны через атом кислорода (кислородный мостик). Примерами выступают полисерные H2S2O7 и H2S3O10 и полихромовые кислоты H2Cr2O7 и H2Cr3O10. Кислоты с несколькими атомами разных кислотообразующих элементов, соединенных через атом кислорода, называются гетерополикислотами. Существуют кислоты, молекулярная структура которых образована цепочкой одинаковых кислотообразующих атомов, например в политионовых кислотах H2SnO6 или в сульфанах H2Sn, где n≥2.
Отдельно выделяют пероксокислоты — кислоты, содержащие пероксогруппы [–O–O–], например пероксомоносерная H2SO5 и пероксодисерная H2S2O8 кислоты. Тиокислотами называют кислоты, содержащие вместо атомов кислорода атомы серы, например тиосерная кислота H2SO3S. Существуют и комплексные кислоты, например: H2[SiF6], H[AuCl4], H4[Fe(CN)6] и др.
Равновесные процессы в водных растворах[править | править код]
Химические свойства кислот определяются способностью их молекул диссоциировать в водной среде с образованием гидратированных ионов H+ и анионов кислотных остатков А–:
- HA+h3O⇄h4O++A−{\displaystyle {\mathsf {HA+H_{2}O\rightleftarrows H_{3}O^{+}+A^{-}}}}
- HA→H++A−{\displaystyle {\mathsf {HA\rightarrow H^{+}+A^{-}}}} (упрощённая запись)
В зависимости от значения константы химического равновесия, также называемой константой кислотности Ka[2], выделяют сильные и слабые кислоты:
- HCl→H++Cl− Ka 107{\displaystyle {\mathsf {HCl\rightarrow H^{+}+Cl^{-}\ \ K_{a}~10^{7}}}}
- HNO2→H++NO2− Ka 10−5{\displaystyle {\mathsf {HNO_{2}\rightarrow H^{+}+NO_{2}^{-}\ \ K_{a}~10^{-5}}}}
Из числа распространённых кислот к сильным относятся хлорная, азотная, серная и хлороводородная. Азотистая HNO2, угольная H2CO3 (CO2·H2O), фтороводородная HF – примеры слабых кислот. Также используется более детальная классификация по значению Ka на очень слабые (≤10−7), слабые (~10−2), средней силы (~10−1), сильные (~103), очень сильные (≥108).
Для неорганических кислородсодержащих кислот вида HnXOm известно эмпирическое правило, по которому значение первой константы связано со значением (m – n). При (m – n) = 0 кислота очень слабая, при 1 — слабая, при 2 — сильная, и, наконец, при 3 — кислота очень сильная[3]:
| Кислота | Значение (m – n) | Ka |
|---|---|---|
| HClO | 0 | 10−8 |
| H3AsO3 | 0 | 10−10 |
| Н2SО3 | 1 | 10−2 |
| Н3РО4 | 1 | 10−2 |
| HNO3 | 2 | 101 |
| H2SO4 | 2 | 103 |
| HClO4 | 3 | 1010 |
Данная закономерность обусловлена усилением поляризации связи Н-О вследствие сдвига электронной плотности от связи к электроотрицательному атому кислорода по подвижным π-связям Э=O и делокализацией электронной плотности в анионе.
Неорганические кислоты обладают свойствами, общими для всех кислот, среди которых: окрашивание индикаторов, растворение активных металлов с выделением водорода (кроме HNO3), способность реагировать с основаниями и основными оксидами с образованием солей, например:
- 2HCl+Mg→MgCl2+h3↑{\displaystyle {\mathsf {2HCl+Mg\rightarrow MgCl_{2}+H_{2}\uparrow }}}
- HNO3+NaOH→NaNO3+h3O{\displaystyle {\mathsf {HNO_{3}+NaOH\rightarrow NaNO_{3}+H_{2}O}}}
- 2HCl+CaO→CaCl2+h3O{\displaystyle {\mathsf {2HCl+CaO\rightarrow CaCl_{2}+H_{2}O}}}
Число атомов водорода, отщепляемых от молекулы кислоты и способных замещаться на металл с образованием соли, называется основностью кислоты. Кислоты можно разделить на одно-, двух- и трехосновные. Кислоты с более высокой основностью неизвестны.
Одноосновными являются многие неорганические кислоты: галогеноводородные вида HHal, азотная HNO3, хлорная HClO4, роданистоводородная HSCN и др. Серная H2SO4, хромовая H2CrO4, сероводородная H2S служат примерами двухосновных кислот и т. д.
Многоосновные кислоты диссоциируют ступенчато, каждой ступени отвечает своя константа кислотности, причем всегда каждая последующая Кa меньше предыдущей ориентировочно на пять порядков. Ниже показаны уравнения диссоциации трехосновной ортофосфорной кислоты:
- h4PO4⇄H++h3PO4− Ka1=7⋅10−3{\displaystyle {\mathsf {H_{3}PO_{4}\rightleftarrows H^{+}+H_{2}PO_{4}^{-}\ \ K_{a1}=7\cdot 10^{-3}}}}
- h3PO4−⇄H++HPO42− Ka2=6⋅10−8{\displaystyle {\mathsf {H_{2}PO_{4}^{-}\rightleftarrows H^{+}+HPO_{4}^{2-}\ \ K_{a2}=6\cdot 10^{-8}}}}
- HPO42−⇄H++PO43− Ka3=1⋅10−12{\displaystyle {\mathsf {HPO_{4}^{2-}\rightleftarrows H^{+}+PO_{4}^{3-}\ \ K_{a3}=1\cdot 10^{-12}}}}
Основность определяет число рядов средних и кислых солей − производных кислоты[4].
К замещению способны только атомы водорода, входящие в состав гидроксигрупп −OH, поэтому, например, ортофосфорная кислота H3PO4 образует средние соли — фосфаты вида Na3PO4, и два ряда кислых − гидрофосфаты Na2HPO4 и дигидрофосфаты NaH2PO4. Тогда как, у фосфористой кислоты H2(HPO3) только два ряда − фосфиты и гидрофосфиты, а у фосфорноватистой кислоты H(H2PO2) − только ряд средних солей − гипофосфитов.
Исключение составляет борная кислота H3BO3, которая в водном растворе существует в виде одноосновного гидроксокомплекса:
- h4BO3+2h3O⇄h4O+[B(OH)4]−{\displaystyle {\mathsf {H_{3}BO_{3}+2H_{2}O\rightleftarrows H_{3}O^{+}[B(OH)_{4}]^{-}}}}
Современные теории кислот и оснований значительно расширяют понятие кислотных свойств. Так, кислота Льюиса — вещество, молекулы или ионы которого способны принимать электронные пары, в том числе и не содержащие ионов водорода: например, катионы металлов (Ag+, Fe3+), ряд бинарных соединений (AlCl3, BF3, Al2O3, SO3, SiO2). Протонные кислоты рассматриваются теорией Льюиса как частный случай класса кислот.
Окислительно-восстановительные свойства[править | править код]
Все пероксокислоты и многие кислородсодержащие кислоты (азотная HNO3, серная H2SO4, марганцовая HMnO4, хромовая Н2CrO4, хлорноватистая HClO и др.) — сильные окислители. Окислительная активность этих кислот в водном растворе выражена сильнее, чем у их солей; при том окислительные свойства сильно ослабевают при разбавлении кислот (например, свойства разбавленной и концентрированной серной кислоты). Неорганические кислоты также всегда менее термически устойчивы, чем их соли. Указанные различия связаны с дестабилизирующим действием сильнополяризованного атома водорода в молекуле кислоты. Наиболее выразительно это проявляется в свойствах кислородсодержащих кислот-окислителей, например, хлорной и серной. Этим же объясняется невозможность существования вне раствора ряда кислот при относительной стабильности их солей. Исключение составляет азотная кислота и её соли, проявляющие сильно выраженные окислительные свойства вне зависимости от разбавления раствора. Такое поведение связано с особенностями строения молекулы HNO3.
Номенклатура неорганических кислот прошла долгий путь развития и складывалась постепенно. Наряду с систематическими названиями кислот широко применяются традиционные и тривиальные. Некоторые распространённые кислоты могут в различных источниках иметь разные названия: например, водный раствор HCl может именоваться соляной, хлороводородной, хлористоводородной кислотой.
Традиционные русские названия кислот образованы прибавлением к названию элемента морфем -ная или -овая (хлорная, серная, азотная, марганцовая). Для разных кислородсодержащих кислот, образованных одним элементом, используется -истая для более низкой степени окисления (сернистая, азотистая). В ряде случаев для промежуточных степеней окисления дополнительно используются морфемы -новатая и -новатистая (см. ниже названия кислородсодержащих кислот хлора).
Традиционные названия некоторых неорганических кислот и их солей приведены в таблице:
| Формула кислоты | Традиционное название | Тривиальное название | Название соли |
|---|---|---|---|
| H3AsO4 | Мышьяковая | Арсенаты | |
| H3ВO3 | Борная | Бораты | |
| Н2СО3(CO2•H2O) | Угольная | Карбонаты | |
| НCN | Циановодородная | Синильная | Цианиды |
| Н2CrO4 | Хромовая | Хроматы | |
| НМnO4 | Марганцовая | Перманганаты | |
| HNO3 | Азотная | Нитраты | |
| HNO2 | Азотистая | Нитриты | |
| Н3РО4 | Ортофосфорная | Фосфорная | Ортофосфаты |
| H2SO4 | Серная | Сульфаты | |
| Н2SiO3(SiO2•H2О) | Метакремниевая | Кремниевая | Метасиликаты |
| H4SiO4(SiO2•2H2O) | Ортокремниевая | Ортосиликаты | |
| H2S | Сероводородная | Сульфиды | |
| HF | Фтороводородная | Плавиковая | Фториды |
| НCl | Хлороводородная | Соляная | Хлориды |
| НВr | Бромоводородная | Бромиды | |
| HI | Иодоводородная | Иодиды |
Для менее известных кислот, содержащих кислотообразующие элементы в переменных степенях окисления, обычно применяются систематические названия.
В систематических названиях кислот к корню латинского названия кислотообразующего элемента добавляют суффикс -ат, а названия остальных элементов или их групп в анионе приобретают соединительную гласную -о. В скобках указывают степень окисления кислотообразующего элемента, если она имеет целочисленное значение. В противном случае в название включают и число атомов водорода[5]. Например (в скобках традиционные названия):
- HClO4 — тетраоксохлорат(VII) водорода (хлорная кислота)
- HClO3 — триоксохлорат(V) водорода (хлорноватая кислота)
- HClO2 — диоксохлорат(III) водорода (хлористая кислота)
- HClO — оксохлорат(I) водорода (хлорноватистая кислота)
- H2Cr2O7 — гептаоксодихромат(VI) диводорода (дихромовая кислота)
- H2S4O6 — гексаоксотетрасульфат диводорода (тетратионовая кислота)
- Н2В4О6 — гексаоксотетраборат диводорода (тетраметаборная кислота)
- HAuCl4 — тетрахлороаурат(III) водорода (золотохлористоводородная кислота)
- H[Sb(OH)6] — гексагидроксостибат(V) водорода
Ниже приведены корни латинских названий кислотообразующих элементов, не совпадающие с корнями русских названий тех же элементов: Ag — аргент(ат), As — арсен(ат), Аu — аур(ат), Cu — купр(ат), Fe — ферр(ат), Hg — меркур(ат), Pb — плюмб(ат), Sb — стиб(ат), Si — силик(ат), Sn — станн(ат), S — сульф(ат).
В формулах тиокислот, образованных из оксикислот замещением атомов кислорода на атомы серы, последние помещают в конце: H3PO3S — тиофосфорная кислота, H2SO3S — тиосерная кислота.
Существует множество методов получения кислот, в т. ч. общих, среди которых в промышленной и лабораторной практике можно выделить следующие:
- Взаимодействие кислотных оксидов (ангидридов) с водой, например:
- P2O5+3h3O→2h4PO4{\displaystyle {\mathsf {P_{2}O_{5}+3H_{2}O\rightarrow 2H_{3}PO_{4}}}}
- 2CrO3+h3O→h3Cr2O7{\displaystyle {\mathsf {2CrO_{3}+H_{2}O\rightarrow H_{2}Cr_{2}O_{7}}}}
- Вытеснение более летучей кислоты из её соли менее летучей кислотой, например:
- CaF2+h3SO4→CaSO4+2HF↑{\displaystyle {\mathsf {CaF_{2}+H_{2}SO_{4}\rightarrow CaSO_{4}+2HF\uparrow }}}
- KNO3+h3SO4→KHSO4+HNO3↑{\displaystyle {\mathsf {KNO_{3}+H_{2}SO_{4}\rightarrow KHSO_{4}+HNO_{3}\uparrow }}}
- Гидролиз галогенидов или солей, например:
- PCl5+4h3O→h4PO4+5HCl{\displaystyle {\mathsf {PCl_{5}+4H_{2}O\rightarrow H_{3}PO_{4}+5HCl}}}
- Al2Se3+6h3O→2Al(OH)3+3h3Se{\displaystyle {\mathsf {Al_{2}Se_{3}+6H_{2}O\rightarrow 2Al(OH)_{3}+3H_{2}Se}}}
- Синтез бескислородных кислот из простых веществ:
- h3+Cl2→2HCl{\displaystyle {\mathsf {H_{2}+Cl_{2}\rightarrow 2HCl}}}
Минеральные кислоты широко применяют в металло- и деревообработке, текстильной, лакокрасочной, нефтегазовой и других отраслях промышленности и в научных исследованиях. К числу веществ, производимых в наибольшем объёме, относятся серная, азотная, фосфорная, соляная кислоты. Суммарное годовое производство в мире этих кислот исчисляется сотнями миллионов тонн в год.
В металлообработке они часто используются для травления железа и стали и в качестве очищающих агентов перед сваркой, металлизацией, окраской или гальванической обработкой.
Серная кислота, метко названная Д. И. Менделеевым «хлебом промышленности», применяется в производстве минеральных удобрений, для получения других минеральных кислот и солей, в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ, в нефтяной, металлообрабатывающей, текстильной, кожевенной, пищевой и др. отраслях промышленности, в промышленном органическом синтезе и т. п.
Соляная кислота применяется для кислотной обработки, очищения руд олова и тантала, для производства патоки из крахмала, для удаления накипи с котлов и теплообменного оборудования ТЭЦ. Она также используется в качестве дубильного вещества в кожевенной промышленности.
Азотная кислота применяется при получении аммонийной селитры, использующейся в качестве удобрения и в производстве взрывчатых веществ. Кроме того, она применяется в процессах органического синтеза, в металлургии, при флотации руды и для переработки отработанного ядерного топлива.
Ортофосфорную кислоту широко используют при производстве минеральных удобрений. Она используется при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали). Входит в состав ингибиторов коррозии. Также применяется в составе фреонов в промышленных морозильных установках как связующее вещество.
Пероксокислоты, кислородсодержащие кислоты хлора, марганца, хрома находят применение как сильные окислители.
- Некрасов Б. В., Основы общей химии, 3 изд., т. 1—2. М., 1973;
- Кемпбел Дж., Современная общая химия, пер. с англ., т. 1—3, М., 1975;
- Белл Р., Протон в химии, пер. с англ., М., 1977;
- Хьюн Д., Неорганическая химия, пер. с англ., М., 1987.
Калийные удобрения — Википедия
Материал из Википедии — свободной энциклопедии
Кали́йные удобре́ния — минеральные вещества, используемые как источник калия для питания растений[1]; помимо увеличения урожайности, они улучшают качественные характеристики выращиваемой продукции: способствуют повышению сопротивляемости растений к заболеваниям, повышению лёжкости плодов при хранении и стойкости при транспортировке, а также улучшению их вкусовых и эстетических качеств.
Калийные удобрения, как правило, применяются в комплексе с азотными и фосфорными удобрениями.
Является концентрированным калийным удобрением. Представляет собой белое кристаллическое вещество и легко растворяется в воде. Содержание питательного вещества в пересчёте на K2O находится в пределах 52-62 %. Основным сырьём для производства хлористого калия являются природные калийные соли (сильвинит и карналлит — соли с содержанием чистого вещества на уровне 12-15 % с примесями солей натрия и магния).
Хлорид калия применяют на любых почвах как основное удобрение. Особенно эффективно при использовании под корнеплоды, картофель, подсолнечник, плодовые и другие культуры.
Комплексное калийно-азотное удобрение: содержание калия — 45 %, азота — 14 %. В объёме 10 см3 содержится 12,5 г (1 г занимает 0,75 см3), то есть в стакане (200 мл) поместится 250 г, в спичечном коробке 25 г. Широко применяется в защищённом грунте: перед высадкой рассады вносят до 36 г/м2, для корневой подкормки 18-20 г/м2.
Комплексное калийно-магниевое удобрение, без содержания хлора. Применяется под хлорофобные культуры положительно отзывающиеся на магний.
Содержание калия 26-32 %, магния 11-18 %. В объёме 10 см3 содержится 10 г (1 г занимает 1 см3), то есть в стакане (200 мл) поместится 200 г, в спичечном коробке 20 г. Не гигроскопична, не слеживается, рассеиваемость хорошая.
Применяют в виде подкормки (10 г/м2) при низком содержании в почве подвижного магния. При основном внесении норма составляет 40 г/м2.
Более 80 % запасов используемой для производства калия руды приходится всего на три страны — Белоруссию, Канаду и Россию.
| Страна | Доля мировых резервов,% | Основное месторождение | Запасы месторождения, млрд.т. | Среднее содержание калия в руде,% | Начало разработки | Площадь месторождения тыс. км2. |
| Канада | 37,5 | Саскачеванское | 50 | 30 | 1958 | ? |
| Россия | 31,4 | Верхнекамское | 13 | 18-34 | 1933 | 6,5 |
| Белоруссия | 9,1 | Старобинское | 7,8 | 22-30 | 1961 | 14 |
| Узбекистан | 1 | Тюбегатанское | 1 | 25-35 | 2007 | 0,56 |
Крупнейшие мировые производители калийных удобрений[править | править код]
Второе рудоуправление «Беларуськалия»| Страна | Производство, млн тонн (2015 год)[2] |
| Канада | 11,2 |
| Белоруссия | 10,6 |
| Россия | 7,4 |
| Германия | 3,4 |
| Китай | 3,1 |
| Израиль | 2,0 |
| Туркменистан | 1,4 |
| Иордания | 1,4 |
| США | 1,1 |
| Чили | 0,8 |
| Узбекистан | 0,62 |
| Великобритания | 0,43 |
| Испания | 0,42 |
| Бразилия | 0,4 |
| Общемировое производство | 37 |
Минеральная соль Википедия
Эта статья — о минерале. О приправе см. поваренная соль; о химическом соединении см. хлорид натрия. У этого термина существуют и другие значения, см. Галит (значения).| Галит | |
|---|---|
 Кристалл галита из Велички | |
| Формула | хлорид натрия NaCl |
| Физические свойства | |
| Цвет | бесцветный или белый; примеси придают голубой, фиолетовый, розовый, жёлтый и серый оттенок |
| Цвет черты | Белый |
| Блеск | Стеклянный |
| Прозрачность | Прозрачный, полупрозрачный |
| Твёрдость | 2 |
| Спайность | Совершенная по кубу |
| Излом | Раковистый |
| Плотность | 2,1 -2,2 г/см³ |
| Сингония | Кубическая |
| Показатель преломления | 1,544 |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
| Прочие свойства | |
|---|---|
| Кристаллическая форма | кристаллы кубические, агрегаты слоистые и волокнистые (в осадочных породах), гранулированные скопления, плотные массивные массы |
| Кристаллическая структура | Кубическая сингония Fm3m |
| Расщепление | спайность в трёх направлениях |
| Отражение | стекловидное |
| Растворимость | в воде |
| Другое | солёный вкус |
Гали́т (греч. ἅλς — соль) — каменная соль, минерал подкласса хлоридов, кристаллическая форма хлорида натрия (NaCl).В кристаллохимической структуре минерала шесть катионов натрия окружают анион хлора. Сингония кубическая, пространственная группа Fm3m[1].
Содержание
- 1 Свойства
- 2 Форма залегания и месторождения
- 3 Использование
- 4 См. также
- 5 Примечания
- 6 Ссылки
Свойства[ | ]
Галит формируется в виде кубических кристаллов, от бесцветного до белого, светло- и тёмно-голубого, жёлтого и розового. Окраска связана с примесями, в том числе красноватая окраска может быть вызвана присутствием некоторых мёртвых бактерий и примесей мёртвых растений, а также любых неорганических веществ. Обычно встречается с другими продуктами испарени
Общая минерализация — Википедия
Материал из Википедии — свободной энциклопедии
Общая минерализация — показатель количества содержащихся в воде растворённых веществ (неорганические соли, органические вещества). Также этот показатель называют содержанием твёрдых веществ или общим солесодержанием. Растворённые газы при вычислении общей минерализации не учитываются.
В англоязычном мире минерализацию также называют «общим количеством растворённых частиц» — Total Dissolved Solids (TDS).
Наибольший вклад в общую минерализацию воды вносят распространённые неорганические соли (бикарбонаты, хлориды и сульфаты кальция, магния, калия и натрия), а также небольшое количество органических веществ.
Обычно минерализацию подсчитывают в миллиграммах на литр (мг/л), но, учитывая, что единица измерения «литр» не является системной, правильнее минерализацию выражать в мг/куб. дм, при больших концентрациях — в граммах на литр (г/л, г/куб. дм). Также уровень минерализации может выражаться в миллионных долях — parts per million (ppm). Соотношение между единицами измерения в мг/л и ppm почти равное и для простоты можно принять, что 1 мг/л = 1 ppm[1].
В зависимости от общей минерализации воды делятся на следующие виды[2]:
- слабоминерализованные (1-2 г/л),
- малой минерализации (2-5 г/л),
- средней минерализации (5-15 г/л),
- высокой минерализации (15-30 г/л),
- рассольные минеральные воды (35-150 г/л)
- крепкорассольные воды (150 г/л и выше).
На минерализацию вод влияют как природные факторы, так и воздействие человека. Природная минерализация зависит от геологии района происхождения вод. Различный уровень растворимости минералов природной среды оказывает серьёзное влияние на итоговую минерализацию воды.
Воздействие человека сводится к сточным водам промышленности, городским ливневым стокам (так как соли и прочие химреагены используется зимой для борьбы с оледенением дорожного покрытия), стокам с сельхозугодий (которые обрабатываются химическими удобрениями) и т. п.[3]
Качество воды, методики отбора проб регламентируются ГОСТ (раздел ISO 13.060 Качество воды
Качество питьевой воды регулируется в России рядом СанПин, а именно:
ВОЗ не вводит ограничений на общую минерализацию воды. Но вода при минерализации более 1000—1200 мг/л может менять свой вкус и вызывать тем самым нарекания. Поэтому ВОЗ по органолептическим показаниям рекомендует предел общей минерализации питьевой воды в 1000 мг/л, хотя уровень и может изменяться в зависимости от сложившихся привычек или местных условий.
Питание растений — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 октября 2018; проверки требуют 6 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 октября 2018; проверки требуют 6 правок. Симптомом дефицита некоторых микроэлементов является хлороз.
Симптомом дефицита некоторых микроэлементов является хлороз.Питание растений, минеральное питание растений — процесс добычи растениями неорганических соединений из почвенного раствора, воздушной или водной среды. В растительных организмах было обнаружено около 50 различных химических элементов, однако только 13 (азот, калий, кальций, магний, фосфор, сера, хлор, железо, медь, бор, цинк, марганец, молибден) считаются необходимыми для их жизни. Критерием признания элемента необходимым является возникновение нарушений в процессах жизнедеятельности в ситуации, когда исследуемый элемент удален из среды организма. Помимо 13 необходимых микроэлементов, в организме растения могут присутствовать также и такие, присутствие которых может положительно повлиять на его работу. Они называются полезными для растения микроэлементами[1].
Элементы, присутствующие в количестве выше 0,1 % от сухой массы, называются макроэлементами. К ним относятся азот, калий, кальций, магний, фосфор и сера. Необходимые элементы, присутствующие в количествах меньше 0,1 % от сухой массы, называют микроэлементами. К этой группе относятся: хлор, железо, медь, бор, цинк, марганец, молибден, никель. К полезным химическим элементам относятся натрий, кремний, кобальт, алюминий и ванадий[1]. Эта классификация химических элементов не является однозначной, и могут возникать различия в определениях отдельных авторов: в микроэлементы, как правило, входят йод и кобальт[2], а в макроэлементы — кремний[3]. Кроме элементов, поглощаемых из почвы в виде ионов, в растительных организмах встречаются в значительных количествах вода и углекислый газ, состоящие из углерода, водорода, кислорода[3].
Знание о потребности растений в отдельных химических элементах используется в традиционном сельском хозяйстве, а также в практике гидропоники и аэропоники[3]. Чаще всего симптомы радикального дефицита тех или иных химических элементов наблюдаются у растений, произрастающих в посевах гидропоники, в ситуации, когда один из минеральных компонентов не подаётся. В случае с растениями, растущими в почве, хронический дефицит проявляется в виде слабых симптомов: как правило, замедление роста и пожелтение листьев[4].
Многие растения могут поглощать минеральные соли, создавая для этого микоризу. Подсчитано, что микоризные растения составляют около 80 % видов, обитающих на суше. Доминирующим типом микоризы является арбускулярная микориза[5]. Грибы доставляют к корням растений как макроэлементы (главным образом соединения азота и фосфора), так и микроэлементы (например, цинк и медь)[1]. Мицелий может объединить несколько растений, создавая микоризную сеть, обеспечивающую общую доставку минеральных веществ многим растениям[6].
==== Дефицит питательных веществ
Влияние дефицита питательных веществ может варьироваться от незначительного снижения темпов роста до очевидного его замедления, деформации, обесцвечивания и даже гибели растения. Визуальные симптомы, достаточно заметные, чтобы анализировать их при выявлении дефицита, встречаются редко. Большинство дефицитов многочисленны и умеренны. Однако, несмотря на то, что редко встречается дефицит только одного питательного вещества, азот, как правило, является наиболее дефицитным питательным веществом.
- ↑ 1 2 3 Zofia Starck: Rola składników mineralnych w roślinie W: Fizjologia roślin (red. Kopcewicz Jan, Lewak Stanisław). Warszawa: Wydawnictwo Naukowe PWN, 2002, s. 228—246. ISBN 8301137533.
- ↑ Szweykowska Alicja: Fizjologia Roślin. Poznań: Wydawnictwo Naukowe Uniwersytetu im. Adama Mickiewicza w Poznaniu, 1997, s. 67-78. ISBN 8323208158.
- ↑ 1 2 3 Taiz L., Zeiger E.: Plant physiology. (3 ed.). Sunderland: Sinauer Associates, Inc., Publishers., 2002, s. 67-86. ISBN 978-0-87893-823-0.
- ↑ Wade Berry: A Companion to Plant Physiology, Fifth Editionby Lincoln Taiz and Eduardo Zeiger (неопр.). 5e.plantphys.net. Дата обращения 12 января 2019.
- ↑ B. Wang, YL. Qiu. Phylogenetic distribution and evolution of mycorrhizas in land plants.. «Mycorrhiza». 16 (5), s. 299—363, Jul 2006
- ↑ Suzanne W. Simard, Kevin J. Beiler, Marcus A. Bingham, Julie R. Deslippe i inni. Mycorrhizal networks: Mechanisms, ecology and modelling. «Fungal Biology Reviews». 26 (1), s. 39-60, 2012.

Добавить комментарий