Простые белки — Википедия
Материал из Википедии — свободной энциклопедии
Просты́е белки́ — белки, которые построены из остатков α-аминокислот и при гидролизе распадаются только на аминокислоты.
Простые белки по растворимости в воде и солевых растворах условно подразделяются на несколько групп: протамины, гистоны, альбумины, глобулины, проламины, глютелины.
До 80-х годов XX века в научной литературе на русском языке простые белки часто обозначались термином «протеины». Простые белки по растворимости и пространственному строению разделяют на глобулярные и фибриллярные. Глобулярные белки отличаются шарообразной формой молекулы (эллипсоид вращения), растворимы в воде и в разбавленных солевых растворах. Хорошая растворимость объясняется локализацией на поверхности глобулы заряженных аминокислотных остатков, окруженных гидратной оболочкой, что обеспечивает хороший контакт с растворителем. К этой группе относятся все ферменты и большинство других биологически активных белков, исключая структурные.
Среди глобулярных белков можно выделить:
- альбумины— растворимы в воде в широком интервале рН (от 4 до 8,5), осаждаются 70-100%-ным раствором сульфата аммония;
- полифункциональные глобулины с большей молекулярной массой, труднее растворимы в воде, растворимы в солевых растворах, часто содержат углеводную часть;
- гистоны— низкомолекулярные белки с высоким содержанием в молекуле остатков аргинина и лизина, что обусловливает их основные свойства;
- протамины отличаются еще более высоким содержанием аргинина (до 85 %), как и гистоны, образуют устойчивые ассоциаты с нуклеиновыми кислотами, выступают как регуляторные и репрессорные белки — составная часть нуклеопротеинов;
- проламины характеризуются высоким содержанием глутаминовой кислоты (30-45 %) и пролина (до 15 %), нерастворимы в воде, растворяются в 50-90 % этаноле;
- глутелины содержат около 45 % глутаминовой кислоты, как и проламины, чаще содержатся в белках злаков.
Фибриллярные белки характеризуются волокнистой структурой, практически нерастворимы в воде и солевых растворах. Полипептидные цепи в молекулах расположены параллельно одна другой. Участвуют в образовании структурных элементов соединительной ткани (коллагены, кератины, эластины).
белки — урок. Биология, Общие биологические закономерности (9–11 класс).
Белки (протеины, полипептиды) — самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. В состав молекул белков входят атомы углерода, кислорода, водорода, азота и иногда серы, фосфора и железа.
Мономерами белков являются аминокислоты, которые (имея в своём составе карбоксильную и аминогруппы) обладают свойствами кислоты и основания (амфотерны).

Благодаря этому аминокислоты могут соединяться друг с другом (их количество в одной молекуле может достигать нескольких сотен). В связи с этим молекулы белков имеют большие размеры, и их называют
Структура белковой молекулы
Под структурой белковой молекулы понимают её аминокислотный состав, последовательность мономеров и степень скрученности молекулы белка.
В молекулах белков встречается всего \(20\) видов различных аминокислот, и огромное разнообразие белков создаётся за счёт различного их сочетания.
- Последовательность аминокислот в составе полипептидной цепи — это первичная структура белка (она уникальна для любого белка и определяет его форму, свойства и функции). Первичная структура белка уникальна для любого типа белка и определяет форму его молекулы, его свойства и функции.
- Длинная молекула белка сворачивается и приобретает сначала вид спирали в результате образования водородных связей между —СО и —NН группами разных аминокислотных остатков полипептидной цепи (между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты). Эта спираль — вторичная структура белка.
- Третичная структура белка — трёхмерная пространственная «упаковка» полипептидной цепи в виде глобулы (шарика). Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот (гидрофобными, водородными, ионными и дисульфидными S–S связями).
- Некоторые белки (например, гемоглобин крови человека) имеют четвертичную структуру. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Четвертичная структура удерживается непрочными ионными, водородными и гидрофобными связями.
Структура белков может нарушаться (подвергаться денатурации) при нагревании, обработке некоторыми химическими веществами, облучении и др. При слабом воздействии распадается только четвертичная структура, при более сильном — третичная, а затем — вторичная, и белок остаётся в виде полипептидной цепи. В результате денатурации белок теряет способность выполнять свою функцию.
Нарушение четвертичной, третичной и вторичной структур обратимо. Этот процесс называют ренатурацией.
Разрушение первичной структуры необратимо.
Кроме простых белков, состоящих только из аминокислот, есть ещё и сложные белки, в состав которых могут входить углеводы (гликопротеины), жиры (липопротеины), нуклеиновые кислоты (нуклеопротеины) и др.
Функции белков
- Каталитическая (ферментативная) функция. Специальные белки — ферменты — способны ускорять биохимические реакции в клетке в десятки и сотни миллионов раз. Каждый фермент ускоряет одну и только одну реакцию. В состав ферментов входят витамины.
- Структурная (строительная) функция — одна из основных функций белков (белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин — хрящи и сухожилия).
- Транспортная функция — белки обеспечивают активный транспорт ионов через клеточные мембраны (транспортные белки в наружной мембране клеток), транспорт кислорода и углекислого газа (гемоглобин крови и миоглобин в мышцах), транспорт жирных кислот (белки сыворотки крови способствуют переносу липидов и жирных кислот, различных биологически активных веществ).

- Сигнальная функция. Приём сигналов из внешней среды и передача информации в клетку происходит за счёт встроенных в мембрану белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды.
- Сократительная (двигательная) функция — обеспечивается сократительными белками — актином и миозином (благодаря сократительным белкам двигаются реснички и жгутики у простейших, перемещаются хромосомы при делении клетки, сокращаются мышцы у многоклеточных, совершенствуются другие виды движения у живых организмов).

- Защитная функция — антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь, образуя тромб.

- Регуляторная функция присуща белкам — гормонам (не все гормоны являются белками!). Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах (например, инсулин регулирует содержание сахара в крови).
- Энергетическая функция — при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры (при полном расщеплении \(1\) г белка до конечных продуктов выделяется \(17,6\) кДж энергии). Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.

Источники:
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. 9 класс // ДРОФА.
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. Общая биология (базовый уровень) 10–11 класс // ДРОФА.
Лернер Г. И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель.
http://ours-nature.ru/lib/b/book/1063747118/348
Типы белков: классификация, определение и примеры
Определение белков: Что такое белок?
Белок, от греческого «πρωτεῖος», являются биомолекулами, образованными линейными цепочками аминокислот.
Благодаря своим физико-химическим свойствам белки можно классифицировать как простые белки (голопротеиды), образованные только аминокислотами или их производными; конъюгированные белки (гетеропротеиды), образованные аминокислотами, сопровождающимися различными веществами, и производными белками, веществами, образованными денатурацией и расщеплением предыдущих.

Белки необходимы для жизни, особенно из-за их пластической функции (они составляют 80% обезвоженной протоплазмы каждой клетки), но также из-за их биорегуляторных функций (они являются частью ферментов) и защиты (антитела являются белками).
Белки играют жизненно важную роль для жизни и являются самыми универсальными и разнообразными биомолекулами. Они необходимы для роста организма и выполняют огромное количество различных функций, среди которых:
- Строительство тканей. Это самая важная функция белка (например: коллаген)
- Контрабильность (актин и миозин)
- Ферментативный (например: сукраза и пепсин)
- Гомеостатик: сотрудничает в поддержании рН (поскольку они действуют как химический буфер)
- Иммунологические (антитела)
- Рубцевание ран (например, фибрин)
- Защитные (например, тромбин и фибриноген)
- Трансдукция сигнала (например, родопсин).
Белки образованы аминокислотами. Белки всех живых существ определяются главным образом их генетикой (за исключением некоторых антимикробных пептидов не рибосомального синтеза), то есть генетическая информация в значительной степени определяет, какие белки представляют клетка, ткань и организм.
Белки синтезируются в зависимости от того, как регулируются гены, которые их кодируют. Поэтому они восприимчивы к сигналам или внешним факторам. Набор белков, выраженный в данном случае, называется протеомом.
Свойства белков
Пять основных свойств, которые позволяют существование и обеспечить функцию белков:
- PH-буфер (известный как буферный эффект): они действуют как буферы рН из-за их амфотерного характера, то есть они могут вести себя как кислоты (донорские электроны) или как основания (прием электронов).
- Электролитическая способность: определяется методом электрофореза, аналитическим методом, в котором, если белки переносятся на положительный полюс, это происходит потому, что их молекула имеет отрицательный заряд и наоборот.
- Специфичность: каждый белок имеет определенную функцию, которая определяется его первичной структурой.
- Стабильность: белок должен быть стабильным в среде, где он выполняет свою функцию. Для этого большинство водных белков создают упакованное гидрофобное ядро. Это связано с периодом полураспада и оборотом белка.
- Растворимость: необходимо сольватировать белок, который достигается путем воздействия на поверхность белка остатков с одинаковой степенью полярности. Он поддерживается до тех пор, пока присутствуют сильные и слабые связи. Если температура и рН увеличиваются, растворимость теряется.

Денатурация белков
Если изменения в рН, изменения концентрации, молекулярное возбуждение или внезапные изменения температуры происходят в белковом растворе, растворимость белков может быть уменьшена до точки осаждения. Это связано с тем, что связи, которые поддерживают глобулярную конформацию, разрушаются, а белок принимает нитевидную конформацию. Таким образом, слой молекул воды не полностью покрывает молекулы белка, которые имеют тенденцию связываться друг с другом, приводя к образованию крупных частиц, которые выпадают в осадок.
Кроме того, его биокаталитические свойства исчезают при изменении активного центра. Белки, находящиеся в этом состоянии, не могут выполнять деятельность, для которой они были разработаны, короче говоря, они не функционируют.
Этот вариант конформации называется денатурацией. Денатурация не влияет на пептидные связи: при возвращении в нормальные состояния может произойти, что белок восстанавливает примитивную конформацию, которая называется ренатурацией.
Примерами денатурации являются вырезание молока в результате денатурации казеина, осаждение яичного белка, когда овальбумин денатурируется действием тепла или фиксацией расчесанных волос в результате воздействия тепла на кератины волос.
Классификация белков
Согласно форме
Волокнистые белки: они имеют длинные полипептидные цепи и атипичную вторичную структуру. Они нерастворимы в воде и в водных растворах. Некоторыми примерами этого являются кератин, коллаген и фибрин.
Шаровидные белки: характеризуются складыванием своих цепей в плотную или компактную сферическую форму, оставляя гидрофобные группы в белковой и гидрофильной группах наружу, что делает их растворимыми в полярных растворителях, таких как вода. Большинство ферментов, антител, некоторых гормонов и транспортных белков являются примерами глобулярных белков.
Смешанные белки: они имеют фибриллярную часть (обычно в центре белка) и другую шаровидную часть (в конце).
Согласно химическому составу
Простые белки или голопротеиды: при их гидролизе производятся только аминокислоты. Примерами таких веществ являются инсулин и коллаген (шаровидные и волокнистые), альбумины.
Конъюгированные или гетеропротеины: эти белки содержат полипептидные цепи и протезную группу. Неаминокислотная часть называется протезной группой, это могут быть нуклеиновая кислота, липид, сахар или неорганический ион. Примерами этого являются миоглобин и цитохром. Конъюгированные белки или гетеропротеины классифицируются по характеру их протезной группы:
- Нуклеопротеиды: нуклеиновые кислоты.
- Липопротеины: фосфолипиды, холестерин и триглицериды.
- Металлопротеины: группа состоит из металлов.
- Хромопротеины: это белки, конъюгированные с хромофорной группой (окрашенное вещество, содержащее металл).
- Гликопротеины: группа состоит из углеводов.
- Фосфопротеины: белки, конъюгированные с радикалом, содержащим фосфат, отличным от нуклеиновой кислоты или фосфолипида.
Источники белка
Источники белка растительного происхождения, такие как бобовые, имеют более низкое качество чем белки животного происхождения, потому что они представляют менее важные аминокислоты, что компенсируется подходящей смесью обоих.
Взрослый должен употреблять белка в соответствии с образом жизни, то есть, чем больше физической активности, тем потребуется больше источников белка чем сидячих.

В пожилом возрасте, все еще выглядящим противоречиво, нет необходимости в более низком потреблении белка, но рекомендуется увеличить их количество, потому что на этом этапе очень важно регенерировать ткани. Кроме того, мы должны учитывать возможное появление хронических заболеваний, которые могут деградировать белки.
Здесь мы расскажем вам, какие продукты являются лучшими источниками белка:
Продукты с животными белками
- Яйца: это хороший источник белка, потому что он содержит альбумин превосходного качества, так как он содержит большое количество незаменимых аминокислот.
- Рыба (лосось, сельдь, тунец, треска, форель …).
- Молоко.
- Молочные продукты, сыр или йогурт.
- Красное мясо, индейка, вырезка и курица.
Эти продукты содержат белки с большим количеством незаменимых аминокислот (те, которые не могут быть синтезированы организмом, поэтому они должны поступать вместе с пищей).
Продукты с белками растительного происхождения
- Бобовые (чечевица, фасоль, нут, горох …) должны быть дополнены другими продуктами, такими как картофель или рис.
- Зеленые листовые овощи (капуста, шпинат …).
- Орехи, такие как фисташки или миндаль (при условии, что они не жареные и не соленые).
- Сейтан, киноа, соевые бобы, морские водоросли.
Переваривание белков
Переваривание белков обычно инициируется в желудке, когда пепсиноген превращается в пепсин под действием соляной кислоты и продолжается действием трипсина и химотрипсина в кишечнике.
Диетические белки деградируют до все более мелких пептидов, и до аминокислот и их производных, которые абсорбируются желудочно-кишечным эпителием. Скорость поглощения отдельных аминокислот сильно зависит от источника белка. Например, переваримость многих аминокислот у людей различается между соевым белком и молочным белком и между отдельными молочными белками, такими как бета-лактоглобулин и казеин.

Для молочных белков приблизительно 50% потребляемого белка переваривается в желудке или тонкой кишке, а 90% уже переваривается, когда проглоченная пища достигает подвздошной кишки.
Помимо своей роли в синтезе белка, аминокислоты также являются важным источником питания азота. Белки, как и углеводы, содержат четыре килокалории на грамм, тогда как липиды содержат девять ккал. Спирты — семь ккал. Аминокислоты могут быть превращены в глюкозу посредством процесса, называемого глюконеогенезом.
Читайте также:
Жмите кнопку «Поделиться» в соцсетях, чтобы не потерять информацию
Что такое белки, какой у них состав, зачем они нужны? :: SYL.ru
О том, что такое белки, сейчас знает практически каждый из школьных уроков биологии. Они выполняют множество функций в клетке живого существа.
Что такое белки?
Это сложные органические соединения. Они состоят из аминокислот, которых всего существует 20, однако, соединив их в разной последовательности, можно получить миллионы разнообразных химических веществ.
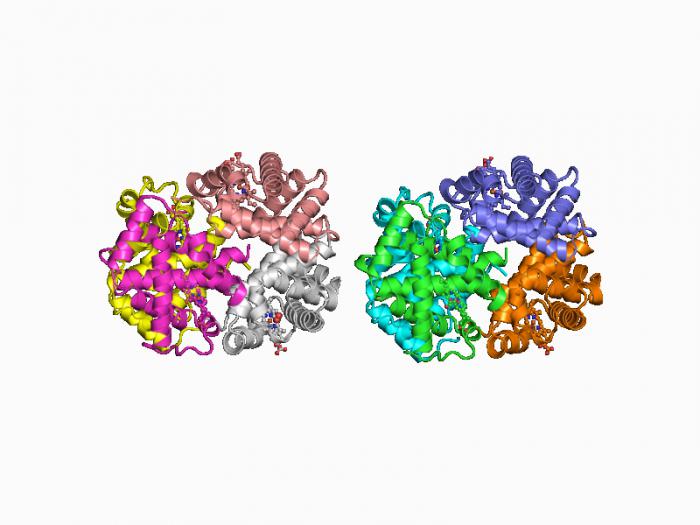
Структура белков
Когда мы уже знаем, что такое белки, можно подробнее рассмотреть их строение. Существует первичная, вторичная, третичная и четвертичная структура такого рода веществ.
Первичная структура
Это цепь, в которой аминокислоты соединены в нужном порядке. Это чередование и определяет вид белка. Для каждого вещества данного класса оно индивидуально. От первичной структуры во многом зависят также физические и химические свойства того или иного белка.
Вторичная структура
Это пространственная форма, которую принимает полипептидная цепь за счет образования водородных связей между карбоксильными группами и имино-группами. Существует два наиболее распространенных ее типа: альфа-спираль и бета-структура, имеющая лентообразный вид. Первая формируется вследствие возникновения связей между молекулами одной и той же полипептидной цепи, вторая — между двумя или более расположенными параллельно цепями. Однако также возможно возникновение бета-структуры и в пределах одного полимера — в том случае, когда определенные его фрагменты повернуты на 180 градусов.

Третичная структура
Это чередование и расположение относительно друг друга в пространстве участков альфа-спирали, простых полипептидных цепей и бета-структур.
Четвертичная структура
Ее также существует два вида: глобулярная и фибриллярная. Такая структура формируется за счет электростатических взаимодействий и водородных связей. Глобулярная имеет форму небольшого клубка, а фибриллярная — нити. Примерами белков с четвертичной структурой первого типа могут служить альбумин, инсулин, иммуноглобулин и т. д.; фибриллярных — фиброин, кератин, коллаген и другие. Есть и еще более сложные по строению белки, к примеру, миозин, содержащийся в мышечных тканях, он имеет стержень фибриллярной формы, на котором расположены две глобулярные головки.
Химический состав белков
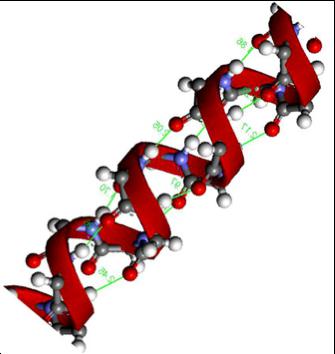
Аминокислотный состав белков может быть представлен двадцатью аминокислотами, которые комбинируются в различном порядке и количестве.
Это глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, лизин, аргинин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, фенилаланин, тирозин, триптофан, гистидин и пролин. Среди них есть незаменимые, то есть те, которые организм человека не в состоянии вырабатывать самостоятельно. Таких аминокислот насчитывается 8 для взрослых и еще 2 для детей: лейцин, изолейцин, валин, метионин, лизин, триптофан, фенилаланин, треонин, а также гистидин и аргинин.
Примеры белков с разной структурой
Ярким представителем глобулярных белков является альбумин. Его третичная структура состоит из альфа-спиралей, которые соединяются одиночными полипептидными цепочками.
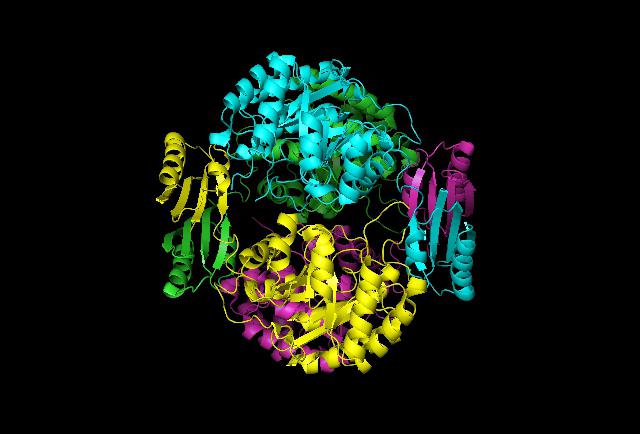
Первичная же образуется такими аминокислотами, как аспаргиновая кислота, аланин, цистеин и глицин. Данный белок находится в плазме крови и выполняет функцию транспорта определенных веществ. Из фибриллярных можно выделить фиброин и коллаген. Третичная структура первого представляет собой вещество из бета-структур, которые соединены одиночными полипептидными цепочками. Сама цепь представляет собой чередование аланина, глицина, цистеина и серина. Данное химическое соединение является основным компонентом паутины и шелка, а также перьев птиц.
Что такое денатурация?
Это процесс разрушения сперва четвертичной, затем третичной и вторичной структур белка. Белок, с которым это случилось, уже не может выполнять свои функции и теряет основные физические и химические свойства. Такой процесс происходит в основном из-за воздействия высоких температур или агрессивных химических веществ. К примеру, при температуре выше сорока градусов Цельсия начинает денатурировать гемоглобин, переносящий кислород по крови организмов. Вот почему для человека опасно столь сильное повышение температуры.
Функции белков
Узнав о том, что такое белки, можно обратить внимание на роль этих веществ в жизни клетки и всего организма в целом. Они выполняют девять основных функций. Первая — пластическая. Они являются компонентами многих структур живого организма и служат в качестве строительного материала для клетки. Вторая — транспортная. Белки способны переносить вещества, примером веществ данного назначения являются альбумин, гемоглобин, а также разнообразные белки-транспортеры, находящиеся на плазматической мембране клетки, каждый из которых пропускает только определенное вещество в цитоплазму из окружающей среды. Третья функция — защитная. Ее выполняют иммуноглобулины, которые являются частью иммунной системы, и коллаген, являющийся основным компонентом кожного покрова. Также белки в организме человека и других организмов выполняют регуляторную функцию, так как существует некоторое количество гормонов, представленных такого рода веществами, к примеру, как инсулин. Еще одна роль, выполняемая этими химическими соединениями, — сигнальная. Данные вещества передают электрические импульсы из клетки в клетку. Шестая функция — двигательная. Яркими представителями белков, выполняющих ее, являются актин и миозин, которые способны сокращаться (они находятся в мышцах). Такие вещества могут также служить запасными, однако в таких целях они используются довольно редко, в основном это белки, которые есть в молоке. Они выполняют еще и каталитическую функцию — в природе есть ферменты белковой природы. И последняя функция— рецепторная. Существует группа белков, которые частично денатурируют под воздействием того или иного фактора, давая таким образом сигнал всей клетке, которая передает его дальше.
Сложные белки — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 августа 2016; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 августа 2016; проверки требуют 3 правки.
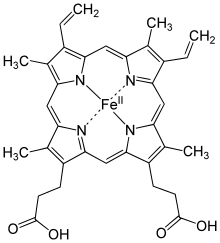
Сло́жные белки́ (протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизе сложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада.
В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы[1]:
- Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
- Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
- Металлопротеины, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
- Нуклеопротеины, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом[2].
- Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока[3]:
- Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлосодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы; флавопротеиды с флавиновой группой, и др.
8 Простые и сложные белки
Простые белки построены из остатков аминокислот и при гидролизе распадаются соответственно только на свободные аминокислоты.
Сложные белки – это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого про-стетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада.
Простые белки в свою очередь делятся на основании некоторых условно выбранных критериев на ряд подгрупп: протамины, гистоны, альбумины, глобулины, проламины, глютелины и др. Классификация сложных белков (см. главу 2) основана на химической природе входящего в их состав небелкового компонента. В соответствии с этим различают фосфопротеины (содержат фосфорную кислоту), хромопротеины (в состав их входят пигменты), нуклеопротеины (содержат нуклеиновые кислоты), гликопротеины (содержат углеводы),липопротеины (содержат липиды) и металлопротеины (содержат металлы).
Простые:
Протамин (protamine) — Низкомолекулярный (4-12 кД) основный ядерный белок. У многих животных протамин наряду с гистонамисодержится в сперматозоидах, а у некоторых (например, у рыб) полностью замещает гистоны. Присутствие протамина защищает ДНКот действия нуклеаз и придает хроматину компактную форму.
ГИСТОНЫ (от греч. histos-ткань), группа сильноосновных простых белков (р/ 9,5-12,0), содержащихся в ядрах клеток животных и растений. Предполагают, что Г. участвуют в переводе чрезвычайно длинных молекул хромосомной ДНК в форму, удобную для пространств. разъединения отдельных хромосом и их перемещения в ходе деления клетки. Полагают также, что Г. участвуют в механизмахтранскрипции и репликации.
АЛЬБУМИНЫ (от лат. albumen, род. падеж albuminis- белок), водорастворимые глобулярные белки, входящие в составсыворотки крови, цитоплазмы клеток животных и растений, молока. наиб. известны сывороточный и яичный А., а также лактальбумин (гл. компоненты соотв. сыворотки крови, яичного белка и молока).
Глобулин (globulin) — Глобулины – семейство глобулярных белков, растворимых в растворах солей, кислот и щелочей (полипептидные цепи свернуты в сферические или эллипсоидные структуры – глобулы). Глобулины участвуют в иммунных реакциях (иммуноглобулины), в свертывании крови (протромбин, фибриноген) и т.п.
ПРОЛАМИНЫ, запасные белки семян злаков (у пшеницы эти белки наз. птиалинами, у кукурузы-зеинами, у ячменя-гордеинами, у ржи-секалинами, у овса-авснинами). П. делятся на две группы-серосодержащие (S-богатые) и серо-несодержащие (S-бедные). Все эти белкикодируются семействами родственных генов, имеющих общего предшественника. Часто к П. относят также родственные им белки-глютенины (глутелины, или HMW). Все эти группы белков различаются по аминокислотному составу, содержат много остатковглутамина и пролина, мало остатков основных аминокислот (см. табл.).
Сложные:
ГЛИКОПРОТЕИНЫ (гликопротеиды), соед., в молекулах к-рых остатки олиго- или полисахаридов ковалентно связаны (О- или N-гликозидными связями) с полипептидными цепями белка. Г. широко распространены в природе. К ним относятся важные компонентысыворотки крови (иммуноглобулины, трансферины и др.), групповые в-ва крови, определяющие групповую принадлежность крови человека и животных, антигены мн. вирусов (гриппа, кори, энцефалита и др.), нек-рые гормоны, лектины, ферменты.
ИПОПРОТЕИНЫ (липопротеиды), комплексы, состоящие из белков (аполипопротеинов; сокращенно — апо-Л.) и липидов, связь между к-рыми осуществляется посредством гидрофобных и электростатич. взаимодействий. Л. подразделяют на свободные, или р-римые в воде (Л. плазмы крови, молока, желтка яиц и др.), и нерастворимые, т. наз. структурные (Л.мембран клетки, миелиновой оболочки нервных волокон, хлоропластов растений). Нековалентная связь в Л. между белкамии липидами имеет важное биол. значение. Она обусловливает возможность своб. обмена липидов и модуляцию св-в Л. ворганизме. Среди своб. Л. (они занимают ключевое положение в транспорте и метаболизме липидов) наиб. изучены Л.плазмы крови, к-рые классифицируют по их плотности.
Белки это что такое, из чего состоят и какие бывают
Белки – это органические вещества, которые играют роль строительного материала в человеческом организме клеток, органов, тканей и синтеза гормонов и ферментов. Они отвечают за много полезных функций, сбой которых приводит к нарушению жизнедеятельности, а также образуют соединения, обеспечивающие устойчивость иммунитета к инфекциям. Белки состоят из аминокислот. Если их соединять в разной последовательности, образуется более миллиона разных химических веществ. Они делятся на несколько групп, которые одинаково важны для человека.
Белковые продукты способствуют росту мышечной массы, поэтому бодибилдеры насыщают свой рацион именно белковой пищей. Она содержит мало углеводов, а соответственно и низкий гликемический индекс, поэтому полезна для диабетиков. Здоровому человеку диетологи рекомендуют употреблять 0.75 – 0.80 гр. качественного компонента на 1 кг веса. Для роста новорожденного необходимо до 1,9 гр. Недостаток белков приводит к нарушению жизненно важных функций внутренних органов. Кроме этого нарушается обмен веществ, и развивается атрофия мышц. Поэтому белки невероятно важны. Давайте изучим их детальнее, чтобы правильно сбалансировать свой рацион и создать идеальное меню для похудения или набора мышечной массы.
Содержание статьи
Немного теории
В погоне за идеальной фигурой не все знают, что такое белки, хотя активно пропагандируют низкоуглеводные диеты. Чтобы избежать ошибок в употреблении белковой пищи, выясним, что он собой представляет. Белок или протеин – это высокомолекулярные органические соединения. Они состоят из альфа-кислот и с помощью пептидных связей соединяются в единую цепочку.

В состав входит 9 незаменимых аминокислот, которые не синтезируются. К ним относятся:
- лейцин;
- изолейцин;
- валин;
- фенилаланин;
- лицин;
- метионин;
- триптофан;
- треонин;
- гистидин.
Также содержится 11 заменимых аминокислот и других, которые играют роль в метаболизме. Но самыми важными аминокислотами считается лейцин, изолейцин и валин, которые известны как BCAA. Рассмотрим их назначение и источники.
| Аминокислоты | Назначение | Природные источники |
| Валин | Препятствует снижению уровня серотонина, поставляет энергию в мышечные клетки | Яичный белок, мясные белки, белки риса, лесного ореха, казеин |
| Изолейцин | Способствует выработке энергии для мышечных клеток, предотвращает перепроизводство серотонина | Белок молочной сыворотки, лесного ореха, куриных яиц, мяса, казеин |
| Лейцин | Предназначен для роста и строительства мышечной ткани, образования соединений в печени и мышцах, препятствует разрушениям белковых молекул и понижению уровня серотонина. Прекрасный источник энергии. | Белок молочной сыворотки, овса, кукурузы, пшена, куриного яйца, лесного ореха, творог |
Как мы видим, каждая из аминокислот имеет значение в образовании и поддержке мышечной энергии. Чтобы все функции выполнялись без сбоев, их нужно вводить в ежедневный рацион в качестве биологически активных добавок или натуральной пищи.
Какое количество аминокислот необходимо для правильной работы организма?
| Лейцин | Изолейцин | Валин | ||
| Потребность человека в аминокислоте (г/100 г.) | ||||
| Минимальный уровень | 2,5 | 1,8 | 1,8 | |
| Рекомендуемый уровень | 7 | 4 | 5 | |
| Аминокислотный состав пищевых белков (г/100 г.) | ||||
| Яичный белок | 9,9 | 5,5 | 7,7 | |
| Казеин (творог) | 9,2 | 6,1 | 7,2 | |
| Соевый белок | 8,2 | 4,9 | 5 | |
| Рыбный белок | 8,6 | 4,5 | 5 | |
| Белок риса | 8,6 | 4,4 | 6,1 | |
| Сывороточный белок | 12,3 | 6,2 | 5,7 | |
Все перечисленные белковые соединения содержат в составе фосфор, кислород, азот, серу, водород, и углерод. Поэтому соблюдается положительный азотный баланс, необходимый для роста красивых рельефных мышц.
Интересно! В процессе жизнедеятельности человека, доля белков теряется (примерно 25 – 30 грамм). Поэтому они постоянно должны присутствовать в еде, потребляемой человеком.
Существует два основных вида белков: растительные и животные. Их принадлежность определяется в зависимости от того, откуда они поступают в органы и ткани. К первой группе относятся белки, получаемые из соевых продуктов, орехов, авокадо, гречки, спаржи. А ко второй – из яиц, рыбы, мяса и молочных продуктов.
Строение белков
Чтобы понять, из чего состоит белок, следует подробно рассмотреть их строение. Соединения могут быть первичной, вторичной, третичной и четвертичной структуры.
- Первичная. В ней аминокислоты соединены последовательно и определяют вид, химические и физические свойства протеина.
- Вторичная – форма полипептидной цепи, которая образовывается за счет водородных связей имино- и карбоксильных групп. Наиболее распространены альфа-спираль и бета-структура.
- Третичная заключается в расположении и чередовании бета-структур, полипептидных цепей и альфа-спирали.
- Четвертичная формируется за счет водородных связей и электростатических взаимодействий.

Состав белков представлен комбинируемыми аминокислотами в разном количестве и порядке. По типу строения их можно поделить на две группы: простые и сложные, в состав которых входят неаминокислотные группы.
Важно! Тем, кто хочет похудеть или улучшить свою физическую форму, диетологи рекомендуют употреблять белковые продукты. Они надолго избавляют от чувства голода и ускоряют метаболизм.
Кроме строительной функции белки обладают рядом других полезных свойств, о которых речь пойдет дальше.
Мнение эксперта

Егорова Наталья Сергеевна
Врач-диетолог, г. Нижний Новгород
Хочу разъяснить касательно защитной, каталитической и регуляторной функций белков, поскольку это довольно сложная тема.
Большая часть веществ, регулирующих жизнедеятельность организма, имеет белковую природу, то есть состоит из аминокислот. Белки входят в структуру абсолютно всех ферментов — каталитических веществ, которые обеспечивают нормальное протекание абсолютно всех биохимических реакций в организме. А это значит, что без них невозможен энергетический обмен и даже построение клеток.
Из белков состоят гормоны гипоталамуса и гипофиза, которые, в свою очередь, регулируют работу всех внутренних желез. Гормоны поджелудочной железы (инсулин и глюкагон) по структуре также являются пептидами. Таким образом, белки оказывают непосредственно влияние на обмен веществ и многие физиологические функции в организме. Без них невозможен рост, размножение и даже нормальная жизнедеятельность индивида.
Ну и наконец касательно защитной функции. Все иммуноглобулины (антитела) имеют белковую структуру. А они обеспечивают гуморальный иммунитет, то есть защищают организм от инфекций и помогают не болеть.
Функции белков
Бодибилдеров в основном интересует функция роста, но кроме нее белки выполняют еще много задач, не менее важных:
| Функция | Примеры и комментарии |
| Строительная | Белки входят в клеточные мембраны, сухожилия, волосы, тем самым участвуют в формировании клеточных и внеклеточных структур. |
| Регуляторная | Гормоны белковой природы ускоряют процессы обмена веществ на 30%. Например, инсулин увеличивает образование жиров из углеводов, а также регулирует уровень глюкозы в крови. |
| Транспортная | Гемоглобин с кислородом транспортируются от легких ко всем тканям и органам, а они в свою очередь переносят углекислый газ в легкие. |
| Двигательная | Актин и миозин способствуют сокращению мышц. |
| Запасающая | Благодаря протеину в организме откладываются про запас полезные вещества, например, железо. |
| Защитная | Вырабатываемые антитела связывают и обезвреживают чужеродные белки и микроорганизмы. |
| Сигнальная | Молекулы белков принимают сигналы из внешней среды и передают команды в клетку. |
| Энергетическая | Когда организм израсходует жиры и углеводы, то берет энергию из белков. При распаде 1 г выделяется 17,6 кДж. |
| Каталитическая | ферменты ускоряют биохимические реакции, которые происходят в клетках. |
Иными словами, белок – это резервный источник энергии для полноценной работы организма. Когда расходуются все запасы углеводов, начинает расщепляться белок. Поэтому атлетам следует учитывать количество потребления высококачественного протеина, который помогает в наращивании и укреплении мышц. Главное, чтобы в состав потребляемого вещества входил весь набор незаменимых аминокислот.
Важно! Биологическая ценность белков обозначает их количество и качество усвоения организмом. Например, в яйце коэффициент равен 1, а в пшенице – 0.54. Это значит, что в первом случае их усвоится в два раза больше чем во втором.
Когда белок поступает в организм человека, он начинает расщепляться до состояния аминислот, а потом воды, углекислого газа и аммиака. После этого они по крови перемещаются к остальным тканям и органам.
Белковая пища
Мы уже выяснили, какие бывают белки, но как эти знания применить на практике? Не обязательно вникать в особенности их строения, чтобы достичь нужного результата (похудеть или нарастить массу), достаточно лишь определить, какую пищу нужно для этого есть.
Для составления белкового меню, рассмотрим таблицу продукции с большим содержанием компонента.
| Количество протеина | Продукты |
| Очень большое (более 15 гр.) | Рыба, соя, бобовые, мясо, творог (до 5% жирности). |
| Большое (10 – 15 гр.) | Свинина, куриные яйца, жирный творог, макароны и крупы (манная, овсяная, гречневая). |
| Умеренное (5 – 9,9 гр.) | Зеленый горошек, перловка, ржаной и пшеничный хлеб. |
| Малое (2 – 4,9) | Картофель, цветная капуста, шпинат, мороженое, кефир, сметана, молоко. |
| Очень малое (0,4 – 1,9 гр.) | Ягоды, фрукты и почти все овощи. |
Обратите внимание на скорость усвоения. Одни усваиваются организмов за короткий промежуток времени, а другие за более продолжительный. Это зависит от строения протеина. Если они добыты из яиц или молочных продуктов, то сразу поступают в нужные органы и мышцы, потому что содержатся в виде отдельных молекул. После термической обработки ценность немного уменьшается, но не критично, поэтому не нужно есть пищу сырой. Мясные волокна плохо перерабатываются, потому что изначально они предназначены для выработки силы. Варка упрощает процесс усвоения, так как во время обработки высокими температурами в волокнах разрушаются поперечные связи. Но даже в этом случае полное усвоение происходит через 3 – 6 часов.
Интересно! Если ваша цель – нарастить мышцы, съедайте за час до тренировки белковую еду. Подходит куриная или индюшиная грудка, рыба и кисломолочные продукты. Так вы усилите эффективность упражнений.
Не забывайте также и о растительном продовольствии. Большое количество вещества содержится в семенах и бобовых. Но на их извлечение организму необходимо потратить много сил и времени. Грибной компонент самый сложный для переваривания и усвоения, а вот соя легко достигает своей цели. Но одной сои не будет достаточно для полноценной работы организма, ее обязательно нужно комбинировать с полезными свойствами животного происхождения.
Качество белка
Биологическая ценность белков можно рассматривать с разных сторон. Химическую точку зрения и азот мы уже изучили, рассмотрим и другие показатели.
- Аминокислотный профиль означает, что белки, поступающие с пищей, должны соответствовать тем, которые уже есть в организме. Иначе синтез нарушится и приведет к распаду белковых соединений.
- Продукты с консервантами и те, которые подверглись сильной тепловой обработке, имеют меньше доступных аминокислот.
- В зависимости от скорости расщепления белков на простые компоненты, белки усваиваются быстрее или медленнее.
- Утилизация белков – показатель времени, на которое в организме задерживается образованный азот, и сколько в общем количестве получается перевариваемого протеина.
- Эффективность зависит от того, как ингредиент повлиял на прирост мышечной массы.
Также следует отметить уровень усвоения белков по составу аминокислот. За счет химической и биологической ценности можно определить продукцию с оптимальным источником протеина.
Рассмотрим список компонентов, входящих в рацион атлета:

Как мы видим, углеводная пища также входит в здоровое меню для совершенствования мышц. Не отказывайтесь от полезных компонентов. Только при правильном соотношении белков, жиров и углеводов, организм не ощутит стресса и будет видоизменяться в лучшую сторону.
Важно! В рационе должны преобладать белки растительного происхождения. Их соотношение к животным составляет 80% к 20%.
Чтобы получить максимальную пользу от белковых продуктов, не забывайте об их качестве и скорости усвоения. Старайтесь сбалансировать рацион так, чтобы организм насытился полезными микроэлементами и не страдал от дефицита витаминов и энергии. В завершение к сказанному отметим, что нужно заботиться о правильном метаболизме. Для этого старайтесь наладить питание и употреблять белковую пищу после обеда. Так вы предупредите ночные перекусы, а это благоприятно скажется на вашей фигуре и здоровье. Если вы хотите похудеть, кушайте мясо птицы, рыбу и кисломолочные продукты с низкой жирностью.

Добавить комментарий