Белки. Химические и физические свойства. Биологические функции.
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот |  |
| вторичная | локальное упорядочивание фрагмента полипептидной цепи в спирали |  |
| третичная | пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити) |  |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α-аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:

Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:

Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
Биологические функции белков
| каталитическая | ускоряют различные химические реакции в живых организмах | ферменты |
| структурная | строительный материал клеток | коллаген, белки клеточных мембран |
| защитная | защищают организм от инфекций | иммуноглобулины, интерферон |
| регуляторная | регулируют обменные процессы | гормоны |
| транспортная | перенос жизненно-необходимых веществ от одних частей организма к другим | гемоглобин переносит кислород |
| энергетическая | снабжают организм энергией | 1 грамм белка может обеспечить организм энергией в количестве 17,6 Дж |
| моторная (двигательная) | любые двигательные функции организма | миозин (мышечный белок) |
2. 3. Химический состав белков.
Белки являются сложными органическими соединениями, состоящими из аминокислот. Химический анализ показал, что белки состоят из следующих элементов:
Углерод 50-55 %
Водород 6-7 %
Кислород 21-23 %
Азот 15-17 %
Сера 0,3-2,5 %.
В составе отдельных белков обнаружены также фосфор, йод, железо, медь и др. макро- и микровещества.
Содержание основных химических элементов может различаться в отдельных белках, исключение составляет азот, среднее количество которого характеризуется наибольшим постоянством и составляет 16 %. В связи с этим существует способ определения количества белка по входящему в его состав азоту. Зная, что 6,25 грамм белка содержит 1 грамм азота, можно найти количество белка, умножив найденное количество азота на коэффициент 6,25.
2. 4. Аминокислоты.
Аминокислоты – карбоновые кислоты альфа-углеродный атом водорода которых замещен на аминогруппу. Белки состоят из аминокислот. В настоящее время известно более 200 различных аминокислот. В организме человека их около 60, а в состав белков входят только 20 аминокислот, которые называют природными или протеиногенными. 19 из них являются альфа-аминокислотами, это означает, что аминогруппа присоединена к альфа-углеродному атому карбоновой кислоты. Общая формула этих аминокислот выглядит следующим образом.
R


 h3N
CH
COOH
h3N
CH
COOH
Только аминокислота пролин не соответствует этой формуле, её относят к иминокислотам.
Химические названия аминокислот, для краткости сокращают, например, глутаминовая кислота ГЛУ, серин СЕР и т.д. для записи первичной структуры белков в последнее время стали пользоваться только однобуквенными символами.
Во всех аминокислотах есть общие группировки: -СН2, -NН2, -СООН, они придают общие химические свойства белкам, и радикалы, химическая природа которых разнообразна. Именно они определяют структурные и функциональные особенности аминокислот.
Классификации аминокислот основана на их физико-химических свойствах.
По строению радикалов:
Циклические — гомоциклические ФЕН, ТИР, гетероциклические ТРИ, ГИС.
Ациклические – моноаминомонокарбоновые ГЛИ, АЛА, СЕР, ЦИС, ТРЕ, МЕТ, ВАЛ, ЛЕЙ, ИЛЕЙ,НЛЕЙ, моноаминодикарбоновые АСП, ГЛУ, диаминомонокарбоновые ЛИЗ, АРГ.
По образованию в организме:
Заменимые – могут синтезироваться в организме из веществ белковой и небелковой природы.
Незаменимые – не могут синтезироваться в организме, поэтому должны поступать только с пищей – все циклические аминокислоты, ТРЕ, ВАЛ, ЛЕЙ, ИЛЕЙ.
Биологическое значение аминокислот:
Входят в состав белков организма человека.
Входят в состав пептидов организма человека.
Из аминокислот образованы в организме многие низкомолекулярные биологически активные вещества: ГАМК, биогенные амины и т.д.
Часть гормонов в организме – производные аминокислот (гормоны щитовидной железы, адреналин).
Предшественники азотистых оснований, входящих в состав нуклеиновых кислот.
Предшественники порфиринов, идущих на биосинтез гема для гемоглобина и миоглобина.
Предшественники азотистых оснований, входящих в состав сложных липидов (холина, этаноламина).
Участвуют в биосинтезе медиаторов в нервной системе (ацетилхолин, дофамин, серотонин, норадреналин и др.).
Свойства аминокислот:
Хорошо растворимы в воде.
В водном растворе существуют в виде равновесной смеси биполярного иона, катионной и анионной форм молекулы. Равновесие зависит от рН среды.
N

 h4—CH—COOH
Nh4—CH—COO
Nh3—CH—COO
h4—CH—COOH
Nh4—CH—COO
Nh3—CH—COO
R + ОН R R + Н
Катионная форма Биполярный ион Анионная форма

 Щелочная
среда рН
Кислая среда
Щелочная
среда рН
Кислая среда
Способны двигаться в электрическом поле, что используется для разделения аминокислот с помощью электрофореза.
Проявляют амфотерные свойства.
Могут играть роль буферной системы, т.к. могут реагировать как слабое основание и слабая кислота.
Белки (вещества) — Традиция
Белки́ (протеи́ны, полипепти́ды
[1]) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс. Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка
Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белкаБелки — важная часть питания животных и человека, поскольку в их организме не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются при биосинтезе белков организма или подвергаются дальнейшему распаду для получения энергии.
Определение аминокислотной последовательности первого белка — инсулина — методом секвенирования белков принесло Фредерику Сенгеру Нобелевскую премию по химии в 1958 году. Первые трёхмерные структуры белков гемоглобина и миоглобина были получены методом дифракции рентгеновских лучей, соответственно, Максом Перуцем и Джоном Кендрю в 1958 году [2][3], за что в 1962 году они получили Нобелевскую премию по химии.
История изучения[править]
Антуан Франсуа де Фуркруа, основоположник изучения белков Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот. В то время были исследованы такие белки, как альбумин («яичный белок»), фибрин (белок из крови) и глютен из зерна пшеницы. Голландский химик Геррит Мульдер провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу. Термин «протеин» для обозначения подобных молекул был предложен в 1838 году шведским химиком Якобом Берцелиусом
К концу XIX века было исследовано большинство аминокислот, которые входят в состав белков. В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков[6]. В начале XX века немецкий химик Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями. Он же осуществил первый анализ аминокислотной последовательности белка и объяснил явление протеолиза.
Однако центральная роль белков в организмах не была признана до 1926 года, когда американский химик Джеймс Самнер (впоследствии — лауреат Нобелевской премии) показал, что фермент уреаза является белком[7].
Сложность выделения чистых белков затрудняла их изучение. Поэтому первые исследования проводились с использованием тех полипептидов, которые могли быть очищены в большом количестве, то есть белков крови, куриных яиц, различных токсинов, а также пищеварительных/метаболических ферментов, выделяемых после забоя скота. В конце 1950-х годов компания Armour Hot Dog Co. смогла очистить килограмм бычьей панкреатической рибонуклеазы А, которая стала экспериментальным объектом для многих учёных.
Идея о том, что вторичная структура белков — результат образования водородных связей между аминокислотами, была высказана Уильямом Астбери в 1933 году, но Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В 1949 году Фред Сенгер определил аминокислотную последовательность инсулина, продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы. Первые структуры белков, основанные на дифракции рентгеновских лучей на уровне отдельных атомов были получены в 1960-х годах и с помощью ЯМР в 1980-х годах. В 2006 году Банк данных о белках (Protein Data Bank) содержал около 40 000 структур белков.
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или организмов. Эта область биохимии называется протеомикой. С помощью методов
2.3.3. Органические вещества клетки. Белки.
2.3.3. Органические вещества клетки. Белки.
Белки – это биологические гетерополимеры, мономерами которых являются аминокислоты. Белки синтезируются в живых организмах и выполняют в них определенные функции.
В состав белков входят атомы углерода, кислорода, водорода, азота и иногда серы.
Мономеры белков – аминокислоты – вещества, имеющие в своем составе неизменяемые части аминогруппу Nh3 и карбоксильную группу СООН и изменяемую часть – радикал. Именно радикалами аминокислоты отличаются друг от друга. Аминокислоты обладают свойствами кислоты и основания (они амфотерны), поэтому могут соединяться друг с другом. Их количество в одной молекуле может достигать нескольких сотен. Чередование разных аминокислот в разной последовательности позволяет получать огромное количество различных по структуре и функциям белков.
В белках встречается 20 видов различных аминокислот, некоторые из которых животные синтезировать не могут. Они получают их от растений, которые могут синтезировать все аминокислоты. Именно до аминокислот расщепляются белки в пищеварительных трактах животных. Из этих аминокислот, поступающих в клетки организма, строятся его новые белки.
Структура белковой молекулы – ее аминокислотный состав, последовательность мономеров и степень скрученности молекулы, которая должна умещаться в различных отделах и органоидах клетки, причем не одна, а вместе с огромным количеством других молекул.
1.Последовательность аминокислот в молекуле белка образует его первичную структуру. Она зависит от последовательности нуклеотидов в участке молекулы ДНК (гене), кодирующем данный белок. Соседние аминокислоты связаны пептидными связями, возникающими между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты.
2.Длинная молекула белка сворачивается и приобретает сначала вид спирали – вторичная структура белковой молекулы. Между СО и NH – группами аминокислотных остатков соседних витков спирали, возникают водородные связи, удерживающие цепь.
3.Молекула белка сложной конфигурации в виде глобулы (шарика), приобретает третичную структуру. Прочность этой структуры обеспечивается гидрофобными, водородными, ионными и дисульфидными S-S связями.
4.Некоторые белки имеют четвертичную структуру, образованную несколькими полипептидными цепями (третичными структурами). Четвертичная структура так же удерживается слабыми нековалентными связями – ионными, водородными, гидрофобными.
Однако прочность этих связей невелика и структура может быть легко нарушена. При нагревании или обработке некоторыми химическими веществами белок подвергается денатурации и теряет свою биологическую активность.
Нарушение четвертичной, третичной и вторичной структур обратимо. Разрушение первичной структуры необратимо.
Белки имеют видовую специфичность: каждый вид организмов обладает белками, не встречающимися у других видов.
Таблица. Образование структур (уровня пространственной организации) белков.


Функции белков.
Каталитическая (ферментативная) – белки ускоряют все биохимические процессы, идущие в клетке: расщепление питательных веществ в пищеварительном тракте, участвуют в реакциях матричного синтеза. Каждый фермент ускоряет одну и только одну реакцию (как в прямом, так и в обратном направлении). Скорость ферментативных реакций зависит от температуры среды, уровня ее рН, а также от концентраций реагирующих веществ и концентрации фермента.
Транспортная – белки обеспечивают активный транспорт ионов через клеточные мембраны, транспорт кислорода и углекислого газа, транспорт жирных кислот.
Защитная – антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь.
Структурная – одна из основных функций белков. Белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин – хрящи и сухожилия.
Сократительная – обеспечивается сократительными белками – актином и миозином.
Сигнальная – белковые молекулы могут принимать сигналы и служить их переносчиками в организме (гормонами). Следует помнить, что не все гормоны являются белками.
Энергетическая – при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры.
Таблица. Основные функции белков и пептидов.




Тематические задания.
Часть А
А1. Последовательность аминокислот в молекуле белка зависит от:
1) структуры гена
2) внешней среды
3) их случайного сочетания
4) их строения
А2. Человек получает незаменимые аминокислоты путем
1) их синтеза в клетках
3) приема лекарств
2) поступления с пищей
4) приема витаминов
А3. При понижении температуры активность ферментов
1) заметно повышается
2) заметно понижается
3) остается стабильной
4) периодически изменяется
А4. В защите организма от кровопотерь участвует
1) гемоглобин
2) коллаген
3) фибрин
4) миозин
А5. В каком из указанных процессов белки не участвуют?
1) обмен веществ
2) кодирование наследственной информации
3) ферментативный катализ
4) транспорт веществ
А6. Укажите пример пептидной связи:

Часть В
В1. Выберите функции, характерные для белков
1) каталитическая
2) кроветворная
3) защитная
4) транспортная
5) рефлекторная
6) фотосинтетическая
В2.
Установите соответствие между структурой белковой молекулы и ее особенностями
|
ОСОБЕННОСТИ СТРУКТУРЫ |
СТРУКТУРА БЕЛКОВОЙ МОЛЕКУЛЫ |
|
|
|
Часть С
С1. Почему продукты хранят в холодильнике?
С2. Почему продукты, подвергшиеся тепловой обработке, хранятся дольше?
СЗ. Объясните понятие «специфичность» белка, и какое биологическое значение имеет специфичность?
С4. Прочитайте текст, укажите номера предложений, в которых допущены ошибки и объясните их.
1) Большая часть химических реакций в организме катализируется ферментами.
2) Каждый фермент может катализировать множество типов реакций.
3) У фермента есть активный центр, геометрическая форма которого изменяется в зависимости от вещества, с которым фермент взаимодействует.
4) Примером действия фермента может быть разложение мочевины уреазой.
5) Мочевина разлагается на двуокись углерода и аммиак, которым пахнет кошачий лоток с песком.
6) За одну секунду уреаза расщепляет до 30000 молекул мочевины, в обычных условиях на это потребовалось бы около 3 млн. лет.
Роль белка в организме человека. Недостаток и переизбыток, симптомы, причины и лечение. Белковые продукты
Белок является органическим питательным веществом растительного или животного происхождения, необходимый для роста и обновления клеток в теле человека. Он играет роль строительного материала тканей, находится в мышцах, внутренних органах, костях и коже. Протеин регулирует работу всего организма, обеспечивает его полезными веществами.
Содержание записи:
Состав, структура белков
Белок состоит из цепочек различных аминокислот, которые соединены ковалентной пептидной связью. Полученные образования образуют макромолекулы, которые имеют различную длину и форму. В природе существует около 80 аминокислот, из которых создается неограниченное разнообразие соединений.
В состав образованных макромолекул чаще всего входят такие химические элементы, как: углерод, водород, кислород, азот. Реже – сера и фосфор. Каждый вид белкового соединение имеет определенную структуру. По ней можно судить о составе вещества, его форме, связях между компонентами.
| Структура белка | Описание |
| Первичная | Определяет состав и последовательность соединения аминокислот в цепи. |
| Вторичная | Пространственная форма полипептидной цепи показывает способ ее скручивания вследствие образования водородных связей. Они могут возникать как внутри одной цепи, так и между другими цепями. |
| Третичная | Представляет собой трехмерную закрученную спираль, которая образуется и удерживается при помощи дисульфидных мостиков. |
| Четвертичная | В таком соединении могут участвовать несколько пептидных цепей, соединенных между собой водородными или ионными связями. |

Свойства всех существующих в природе белков зависят от их первичной структуры. Она является индивидуальной, несет наследственную информацию и сохраняется в поколениях.
Каким бывает белок?
Роль белка в организме человека заключается в организации метаболических и физиологических процессов, поддержании иммунной системы тела, обеспечении роста и развития органов, восстановления клеток.
В синтезе белка человека участвуют 22 аминокислоты. Из них 12 шт. – это заменимые аминокислоты, которые могу синтезироваться в организме.
Остальные 10 шт. являются незаменимыми, они могут быть получены только с пищей. При их недостаточном количестве у человека может наступить истощение, произойти снижение иммунитета, измениться гормональный фон.
Все белковые соединения подразделяются на 2 большие группы:
- Полноценные белки – это соединения, в которых содержатся все незаменимые аминокислоты.
- Состав неполноценных белков отличается не полным содержанием в них всех незаменимых аминокислот.
Ценность протеина зависит от его составляющих. Чем большее количество полноценных белков содержится в нем, тем больше он принесет пользы.
Функции белка в организме
Полученные в результате синтеза, все белковые соединения можно условно разделить на несколько групп. Каждая из них выполняет свои определенные функции, которые регулируют работу организма.
Каталитическая функция
Одной из главных задач, которую выполняют белки, является каталитическая функция. При помощи действия биологических катализаторов, которые называются ферментами, происходит увеличение во много раз скорости химических реакций, проходящих в живой клетке.
 Нельзя переоценить роль белка в организме человека. Он выполняет жизненноважные функции для организма, в частности Каталитическую.
Нельзя переоценить роль белка в организме человека. Он выполняет жизненноважные функции для организма, в частности Каталитическую.Ферменты являются самым крупным классом белков, их количество составляет больше 2000. Именно они обеспечивают все метаболические процессы организма.
Структурная функция
Определенная группа протеинов занимается выполнением структурной функции. Они участвуют в формирование клеточных и внеклеточных структур, обеспечивают прочность и эластичность тканей.
Такими белковыми соединениями являются:
- Кератин, который содержится в ногтях, волосах человека.
- Коллаген, являющийся основой соединительной и костной ткани.
- Эластин является компонентом связок.
Защитная функция
Белок обладает способностью защищать человека от вирусов, бактерий, токсинов, попадающих в организм. Роль таких соединений выполняют антитела, которые синтезирует иммунная система. Они связывают чужеродные вещества, называемые антигенами и нейтрализуют их действие.
Другое защитное действие белков проявляется в способности некоторых их групп к свертываемости крови. В результате действия фибриногена и тромбина, возникает сгусток, который предохраняет человека от потери крови.
Регуляторная функция
Отдельный класс белковых соединений отвечает за регуляторную функцию. Протеины данного направления контролируют обмен веществ, передвижение клетки, ее развитие и видоизменение.

Это осуществляется за счет подвижности ферментов или за счет соединения их с другими веществами. Примерами таких соединений являются: глюкагон, тироксин, соматотропин.
Сигнальная функция
Сигнальная функция соединений основана на работе определенной группы белков, которые передают различные сигналы между клетками или органами тела. Они способствуют регуляции основных процессов, проходящих в организме. Например, такое вещество, как инсулин, обеспечивает необходимый уровень содержания глюкозы в крови.
Взаимодействие клеток между собой происходит при помощи сигнальных белковых соединений. Ими являются цитокины и факторы роста.
Транспортная функция
Данный вид белков активно участвует в транспортировке веществ через клеточные мембраны из одного места в другое. Например, гемоглобин, который входит в состав эритроцитов, переносит кислород из легких в другие органы тела, а из них отправляет назад углекислый газ.

Белок липопротеин транспортирует жиры из печени, инсулин переправляет глюкозу в ткани, а миоглобин создает запас кислорода в мышцах.
Запасная (резервная) функция
Обычно белок не накапливается в организме. Исключение составляют такие соединения: альбумин, содержащийся в яйце и козеин, который находится в козьем молоке. Также, при распаде гемоглобина железо образует с белком сложное соединение, которое тоже может откладываться в резерв.
Рецепторная функция
Данный вид белков находится в цитоплазме или мембранах рецепторов. Они способны принимать, задерживать, передавать сигналы, возникающие от внешнего раздражителя внутрь клетки.
Примерами таких соединений могут служить:
- опсин;
- фитохром;
- протеинкиназа.
Моторная (двигательная) функция
Некоторые виды белков обеспечивают возможность организму двигаться. Другой их важной задачей является изменение форм клеток и субклеточных частиц. Основными соединениями, отвечающими за моторную функцию, являются актины и миозины.

В результате их работы, происходит сокращение и расслабление всех мышц организма, движение внутренних органов.
Нормы белка в организме человека
Роль белка в организме человека имеет важное значение для обеспечения необходимыми питательными веществами клеток тела. Недостаточное употребление продуктов, содержащих полноценные белки, может привести к нарушению основных жизненно важных функций организма.
Количество употребляемого в пищу белка зависит от состояния здоровья, возраста человека, от его активности. Известны случаи индивидуальной непереносимости этого вещества.
Для взрослых
Так как белок невозможно накопить в организме, а его переизбыток может принести вред, то требуется каждый день употреблять в пищу определенное количество протеина. Для этого нужно знать суточную норму потребления белка.
Учеными разных стран проводятся исследования по установлению оптимального количества суточной нормы белка. Эти цифры расходятся между собой. Российские диетологи рекомендуют употреблять 1,0 – 1,2 г – на 1 кг веса человека. Американские врачи увеличивают эту цифру до 1,6 г – на 1 кг веса.

Лучше всего воспользоваться средними показателями. В этом случае взрослому человеку, который ведет малоподвижный образ жизни, требуется 1,2 – 1,3 г белка в сутки на 1 кг массы тела. Если вес человека составляет 80 кг, то за день он должен употребить около 100 г белка. Людям, занимающимся физическим трудом, нужно увеличить норму употребления белка до 1,5 г – на 1 кг веса.
Для детей
Детям белок необходим для правильного развития, роста, поэтому потребность в нем значительно выше, чем у взрослого человека. В самом раннем возрасте суточная норма употребления белка составляет от 3 до 4 г – на 1 кг веса. Для детей школьного возраста эта норма немного снижается, она колеблется от 2 до 3 г белка на 1 кг веса в сутки.
Особенно полезны детям молочные продукты, богатые полноценными белками. Они хорошо перевариваются и легко усваиваются молодым организмом.
При похудении
Многие известные диеты основаны на белковом питании. Людям, желающим похудеть, необходимо больше вводить в свой рацион продукты, содержащие белок. Суточная норма употребления протеина должна быть увеличена до 1,5 г – на 1 кг веса человека.
При проблемах со здоровьем
Многие проблемы со здоровьем возникают у людей при малом употреблении белка. Иногда, для того, чтобы улучшить свое самочувствие, человеку бывает достаточно сбалансировать свое питание, включить в рацион больше белковой пищи.
Мнения диетологов расходятся в том, сколько нужно употреблять белка людям, имеющих какое-либо заболевание. При заболеваниях печени и почек, для того, чтобы снизить с них нагрузку, специалисты рекомендуют уменьшить употребление белка до 0,7 г – на 1 кг веса. В любом случае, необходимую диету больному должен назначать лечащий врач индивидуально.
Для спортсменов
Людям, занимающимся спортом, требуется большое количество протеина для роста мышц тела и увеличения силы. Для них норма употребления белка в сутки должна составлять от 2 до 2,5 г – на 1 кг массы тела.

В некоторых силовых видах спорта, многодневных велосипедных гонках норма может быть увеличена до 3 – 3, 2 г протеина на 1 кг веса.
Симптомы и причины нехватки белка в организме
Чаще всего, основной причиной дефицита белка в организме является неправильное питание человека, употребление продуктов с его недостаточным содержанием. В этом случае организму не хватает аминокислот, необходимых для формирования новых соединений. Он начинает тратить собственные запасы, брать их из мышечной ткани.
Другой причиной белкового «голодания» человека могут быть серьезные заболевания, связанные с повышенным распадом белка. Ими являются: тяжелые инфекционные заболевания, наследственные нарушения обмена веществ, ожоги, патологии почек. Легкие формы нехватки белка обычно проходят без симптомов.
При более сложных случаях проявляются следующие симптомы:
- Человек становится подверженным частым простудам.
- Плохо заживают любые повреждения кожи: порезы, ссадины.
- Человек часто испытывает слабость, вялость, боли в мышцах и суставах.
- Из-за нехватки белка возможны скачки сахара в крови. Вследствие этого, человек испытывает постоянное чувство голода.
- Плохое состояние ногтей и волос.
- Возможны отеки на ногах.
При любых выше перечисленных симптомах недомогания необходимо обратиться к врачу, чтобы он поставил правильный диагноз и назначил лечение.
Признаки и причины переизбытка белка в организме
Роль белка в организме человека выражается в организации основных физиологических процессов, обеспечение жизнедеятельности клеток. Данное соединение является важнейшим компонентом всех пищевых продуктов.
Обычно проблемы, связанные с переизбытком белка, встречаются гораздо реже, чем с его недостатком. Но при употреблении большого количества продуктов с высоким его содержанием, у человека может возникнуть белковое отравление.
Избыточный белок, поступающий с продуктами питания, в печени превращается в глюкозу и мочевину, которые почками выводятся из организма. При длительном употреблении большого его количества могут произойти негативные изменения в организме: нарушение обмена веществ, остеопороз, болезни печени и почек.
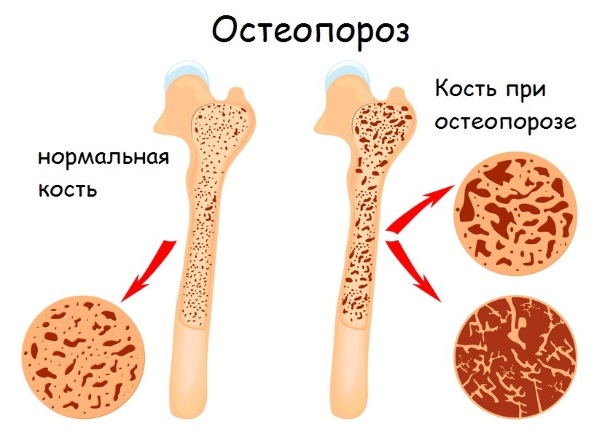
Также причиной переизбытка белка могут быть врожденные или приобретенные болезни человека. В этих случаях организм не может расщеплять определенные классы протеинов, которые в течение длительного времени постепенно накапливаются в нем.
Признаками переизбытка белка в организме являются:
- Постоянное чувство жажды.
- Возможны проблемы с пищеварением (запоры, вздутие кишечника, диарея).
- Перепады настроения и плохое самочувствие.
- Возможен набор веса.
- Неприятный запах изо рта.
- Гормональный сбой организма.
Анализы на белок, виды обследований
Для установления правильного диагноза врач выписывает пациенту назначение о прохождении необходимых анализов. По отклонению от нормы какого-либо показателя можно судить о существующих неполадках в организме.
Самыми распространенными из них являются анализы на белок, в которых исследуется и выявляется уровень его содержания в организме. Материалом для этого обычно служит кровь и моча.
Биохимия
Биохимический анализ крови позволяет определить содержание в ней альбумина и С-реактивного белка. Полученный результат дает информацию о работе почек, печени, поджелудочной железы, об обменных процессах в организме.
Нормальное содержание общего белка в крови составляет 6 – 8,3 г/дл. При необходимости врач может назначить дополнительные анализы для того, чтобы выяснить, какой конкретно белок вышел из нормы. Повышенный белок может быть признаком обезвоживания организма. Пониженный показатель общего белка может служить показателем заболевания печени или почек.
Простой анализ мочи
Общий анализ мочи определяет содержание в ней белка. Для такого исследования используется утренняя порция мочи. У здорового человека белка не должно быть в моче. Допускается небольшое его содержание – до 0,033 г/л.

Превышение этого показателя указывает о воспалительных процессах, происходящих в организмах. Также это может признаком хронического заболевания почек.
Анализ мочи
Анализ на общий белок в моче является более развернутым и позволяет оценить степень заболевания пациента. Этот метод определяет низкомолекулярные и специфические белки, которые не выявляются при простом анализе. Потеря большого количества белков с мочой приводит к внешним и внутренним отекам организма и может служить признаком почечной недостаточности.
При таком способе исследования используется суточная моча, которую пациент собирает в течение дня. Хранить ее следует в холодильнике при температуре от +2 до +8 град.
Лечение дефицита белка
Лечение дефицита белка у пациента обязательно проводится под наблюдением врача.
Обычно оно проходит одновременно по двум направлениям:
- Восполнение требуемого объема белка в организме, нормализация его обмена. Для этого следует придерживаться диеты с богатым содержанием белка.
- Медикаментозное лечение самого заболевания.
Лечение переизбытка белка
Для лечения переизбытка белка требуется в первую очередь отрегулировать питание, снизив употребление продуктов с высоким его содержанием. Так как избыток протеинов нарушает кислотно-щелочной баланс организма, следует употреблять в пищу овощи и фрукты с богатым содержанием калия: картофель, абрикосы, персики, виноград, чернослив.

Эти продукты ощелачивают организм и восстанавливают рН фактор.
Дополнительно врач назначает медикаментозные препараты, содержащие ферменты. Они помогают расщеплению белковых соединений, накопленные организмом.
Источники белка животного происхождения
Роль белка в организме человека незаменима, потому, что он является основным веществом, которое дает телу питание, энергию, участвует в обновлении клеток. Это соединение помогает человеку противостоять болезням, вести активный образ жизни.
Основным источником полноценного белка являются продукты питания животного происхождения. Одним из них является молоко. В 100 г напитка находится около 3 г важного белка, который содержит в себе правильное сочетание необходимых для человека аминокислот.
Во многих молочных продуктах отмечается наличие метионина – аминокислоты, которая обеспечивает нормальную работу печени. Много белка содержится в нежирном твороге. На 100 г продукта приходится около 18 г протеина. Мясо отличается высоким показателем содержания полноценного белка. В зависимости от сорта, в 100 г продукта его находится от 20 г до 30 г.

Белковая ценность рыбы и морепродуктов не уступает мясу. При этом данный продукт легче усваивается. Больше всего белка содержится в тунце, палтусе: на 100 г продукта его приходится от 20 г до 28 г. У яиц отмечается ценный аминокислотный состав. В одном курином яйце содержится около 12 г белка, причем в желтке его в 2 раза больше, чем в белке.
Источники белка растительного происхождения
Дополнительным источникам белка в питании человека являются: бобовые, овощи, фрукты, орехи. Единственным растением, в котором содержится полноценный белок – это соя. Его регулярно употребляют в пищу вегетарианцы или люди, ведущие здоровый образ жизни.
Основные продукты растительного происхождения и содержание в них белка:
| Продукт | Содержание белка, г – на 100 г продукта |
| Соя | 35 – 40 |
| Чечевица | 24 |
| Тыквенные семечки | 20 |
| Орехи | 20 – 25 |
| Тофу | 20 |
| Соевое молоко | 3 |
| Зеленый горошек | 5 |
| Брокколи | 3 |
| Шпинат | 3 |
| Какао-порошок | 24 |
| Сухофрукты | 3 – 5 |
| Гречневая крупа | 10 – 12 |
| Фасоль | 6 – 10 |
Правильное белковое питание для организма
Для сбалансированного питания, поддержания всех внутренних систем организма, человеку необходимо принимать достаточное количество белков, жиров и углеводов. Полное исключение одного из компонентов из рациона питания может привести к необратимым процессам.
Для правильного питания диетологами предлагается придерживаться следующего соотношения веществ: белки должны составлять около 30 % дневного рациона, жиры – 30 %, углеводы – 40 %. При этом, желательно, чтобы около 60 % дневной белковой нормы составляли полноценные белки.

При подсчете необходимого количества белка следует учитывать, что при термообработке его часть разрушается. В продуктах растительного происхождения белки усваиваются организмом на 60 %, а животного – до 90 %.
Особенности белкового питания для роста мышц
При любых интенсивных видах спорта важным значением является увеличение мышечной массы тела, повышение выносливости организма. Это достигается усиленными тренировками и особым питанием, при котором употребляются продукты с высоким содержанием белка.
Лучше всего будет, если меню белкового питания будет составлять врач или тренер спортсмена. Важно правильно рассчитать белковый рацион, количество калорий, углеводов и жиров.
В белковый рацион спортсмена должны входить: обезжиренные молочные продукты, постное мясо, отварной яичный белок, нежирная морская рыба. Питание должно быть дробным – 5 раз в день. После интенсивной тренировки рекомендуется принимать протеиновый коктейль.
В период набора мышечной массы процентное соотношение биологических веществ следующее: 70 % – белка, 30 % – жиры и углеводы. Максимальная продолжительность белковой диеты должна быть не более 1 месяца. Дольше этого времени ее применение может нанести вред организму.
Особенности белкового питания, желающим похудеть
Людям, желающим снизить свой вес, рекомендуется употреблять в пищу продукты с большим содержанием белка. Это позволит постепенно, без вреда своему здоровью избавиться от лишних килограммов.
Белковые продукты по сравнению с углеводными, имеют более низкий гликемический индекс, что способствует снижению сахара в крови и выброса большого количества инсулина. При их употреблении, организм тратит больше времени на переваривание. В результате человек дольше не испытывает чувство голода, у него снижается аппетит, тяга к различным перекусам.

При употреблении пищи, богатой белком, у человека улучшается обмен веществ. При этом организм расходует большее количество калорий, которые тратятся на поддержание и питание мышечной массы. Все это приводит к снижению веса.
Для постепенного похудения в ежедневном питании следует придерживаться следующей пропорции употребляемых веществ: белки должны составлять 50 %, жиры – 30 %, углеводы – 20 %. Рекомендуется после 18:00 употреблять только белковые продукты.
Роль, которую выполняет белок в организме человека, трудно переоценить. Его дефицит приводит к проблемам со здоровьем, снижению активности и жизненного тонуса. Переизбыток белка тоже вреден для человека. Чтобы этого не происходило, важно подобрать оптимальный рацион питания, при котором организм будет обеспечен всеми необходимыми веществами.
Оформление статьи: Лозинский Олег
Видео о роли белка в организме человека
Как белок влияет на организм? Сколько нужно есть белка:
Транспортные белки — Википедия
Тра́нспортные белки́ — собирательное название большой группы белков, выполняющих функцию переноса различных лигандов как через клеточную мембрану или внутри клетки (у одноклеточных организмов), так и между различными клетками многоклеточного организма. Транспортные белки могут быть как интегрированными в мембрану, так и водорастворимыми белками, секретируемыми из клетки, находящимися в пери- или цитоплазматическом пространстве, в ядре или органеллах эукариот.
Основные группы транспортных белков:
Транспортная функция белков — участие белков в переносе веществ в клетки и из клеток, в их перемещениях внутри клеток, а также в их транспорте кровью и другими жидкостями по организму.
Есть разные виды транспорта, которые осуществляются при помощи белков.
Перенос веществ через клеточную мембрану[править | править код]
У всех клеток есть мембрана, состоящая из двойного слоя липидов. В клетку должны поступать многие необходимые для жизни вещества (сахара, аминокислоты, ионы щелочных металлов), но липидный бислой для них практически непроницаем. Поэтому в состав мембраны входят транспортные белки, которые и осуществляют перенос полярных или заряженных соединений. Транспорт этих соединений в клетку делится на активный и пассивный. Пассивный транспорт — транспорт веществ из области с высокой концентрацией в область низкой без затрат энергии, то есть диффузия. Она делится на 2 варианта: простая и облегчённая.
В облегчённой диффузии участвуют белки-переносчики. Этот вариант может сопровождаться конформационными изменениями белка. Есть несколько путей переноса веществ в этом случае: когда участвует один белок и когда участвуют несколько. Если участвует один белок(транслоказа), то он связывает вещество, потом сближается с другой стороной мембраны, отдаёт связанное вещество и возвращается в исходное состояние. Если участвуют несколько белков, то один связывается с веществом, потом передаёт его другому и так далее, пока вещество не дойдёт по цепи до противоположной стороны мембраны.
Пассивный транспорт обеспечивают также белки-каналы. Каналообразующие белки образуют в мембране водные поры, через которые (когда они открыты) могут проходить вещества. особые семейства каналообразующих белков (коннексины и паннексины) формируют щелевые контакты, через которые низкомолекулярные вещества могут транспортироваться из одной клетки в другую (через паннексины и в клетки из внешней среды).
Активный транспорт происходит против градиента концентрации и протекает с затратой энергии. В активном транспорте участвуют белки-переносчики. Энергия, которая требуется для осуществления активного транспорта, обычно получается транспортными белками при расщеплении АТФ. Один из наиболее изученных белков, осуществляющих активный транспорт — Na+/K+-аденозинтрифосфатаза. За полный цикл работы этого насоса в клетку попадают из внешней среды 2 иона K+ и выбрасывается наружу 3 иона Na+.
Ещё один путь попадания веществ внутрь клетки — их поглощение путём эндоцитоза. В этом процессе также могут участвовать специальные транспортные белки. Например, гастромукопротеид (внутренний фактор Касла), который синтезируется в клетках слизистой оболочки желудка, обеспечивает поглощение путём эндоцитоза клетками подвздошной кишки витамина B12.
Этот перенос осуществляется между ядром и другими органоидами и цитоплазмой клетки. Например, перенос белков между ядром и цитоплазмой (ядерно-цитоплазматический транспорт) происходит благодаря ядерным порам, которые пронизывают двухслойную оболочку ядра. Они состоят примерно из тридцати белков — нуклеопоринов. Вещества переносятся из цитоплазмы в ядро клетки вместе с белками — транспортинами. Эти белки узнают вещества, предназначенные для транспорта в ядро, и связываются с ними. Затем этот комплекс белков заякоривается на белках ядерной поры и попадает в её канал, а затем в ядро. Там она связывается ещё с одним белком и распадается, а транспортины направляются обратно в цитоплазму.
Перенос белков из цитоплазмы к другим органоидам клетки происходит с помощью белков-переносчиков. В этом процессе участвуют также шапероны.
Также для транспортировки веществ внутри клеток используются микротрубочки — структуры, состоящие из белков тубулинов. По их поверхности могут передвигаться митохондрии и мембранные пузырьки с грузом (везикулы). Этот транспорт осуществляют моторные белки. Они делятся на два типа: цитоплазматические динеины и кинезины. Эти две группы белков различаются тем, от какого конца микротрубочки они перемещают груз: динеины от + -конца к — -концу, а кинезины в обратном направлении.
Транспорт веществ по организму в основном осуществляется кровью. Кровь переносит гормоны, пептиды, ионы от эндокринных желез к другим органам, переносит конечные продукты метаболизма к органам выделения, переносит питательные вещества и ферменты, кислород и углекислый газ.
Наиболее известный транспортный белок, осуществляющий транспорт веществ по организму — это гемоглобин. Он переносит кислород и диоксид углерода по кровеносной системе от лёгких к органам и тканям. У человека около 15 % углекислого газа транспортируется к лёгким с помощью гемоглобина. В скелетных и сердечной мышцах перенос кислорода выполняется белком, который называется миоглобин.
В плазме крови всегда находятся транспортные белки — сывороточные альбумины. Жирные кислоты, например, транспортируются альбуминами сыворотки крови. Кроме того, белки группы альбуминов, например, транстиретин, транспортируют гормоны щитовидной железы. Также важнейшей транспортной функцией альбуминов является перенос билирубина, желчных кислот, стероидных гормонов, лекарств (аспирин, пенициллины) и неорганических ионов.
Другие белки крови — глобулины переносят различные гормоны, липиды и витамины. Транспорт ионов меди в организме осуществляет глобулин — церулоплазмин, транспорт ионов железа — белок трансферрин, транспорт витамина B12 — транскобаламин.
Белковые вещества Белки применение — Справочник химика 21
Промышленное использование белковых веществ. Главное назначение белка — быть использованным в качестве питательного вещества. Но белковые вещества находят применение и в различных отраслях промышленности. Белок используется в текстильной промышленности для выделки шерстяных и шелковых тканей в кожевенном производстве широко используют шкуры животных из костей готовят клей (столярный клей). Белки идут для приготовления пластических масс. Так, напри мер, казеин из молока применяется для изготовления пластмассы — галалита, получаемого взаимодействием формалина с прессованным казеином. Казеин из молока может быть применен и для приготовления искусственной шерсти. [c.345]Белки находят широкое применение в промышленности как в чистом виде, так и в виде различных белковых изделий. Белковые вещества важны и как сырье для приготовления пластмасс. [c.238]
Промышленное значение белков. Белковые вещества находят широкое применение, особенно в производстве продовольственных и промышленных товаров. [c.298]
В результате применения метода меченых атомов выявлена исключительная динамичность белковых веществ. Белки, больше чем какие-либо иные вещества, подвергаются в организме обновлению, распаду и синтезу. Далее было установлено, что постоянному обновлению в известной мере подвергаются составные части таких, казалось бы, инертных образований, как сухожилия, связки, зубная эмаль и др. Все эти данные в значительной мере расширили наши представления об обмене веществ между организмами и окружающей их средой и поставили перед исследователями ряд новых проблем. [c.12]
Белковые вещества весьма чувствительны к повышению температуры и действию многих химических реагентов (органические растворители, кислоты, щелочи). Поэтому обычные методы органической химии, применяемые для вьщеления того или иного вещества из смеси (нагревание, перегонка, возгонка, кристаллизация и др.), в данном случае неприемлемы. Белки в этих условиях подвергаются денатурации, т.е. теряют некоторые существенные природные (нативные) свойства, в частности растворимость, биологическую активность. Разработаны эффективные методы выделения белков в мягких условиях, при низкой температуре (не выше 4°С), с применением щадящих нативную структуру химических реагентов. [c.23]
Получение и применение. Белки выделяют главным образом из растений и лискусственному получению белковых веществ. Так, синтезированы белки инсулин и рибонуклеаза. [c.450]
Низкая себестоимость растительных белковых веществ может снизить расходы на белковое питание людей однако их следует рассматривать не как заменители белков животного происхождения (суррогаты мяса), а как пищевые продукты с точно известными функциональными свойствами, употребление которых открывает новые возможности в кулинарии. Такой взгляд требует применения технологических процессов, гарантирующих хорошие питательные и органолептические качества, по которым эти азотсодержащие продукты приближаются к пище животного происхождения и служат ее дополнением. В частности, следовало бы, вероятно, отказаться от пропагандистских рекламных кампаний, таких, как проводимые в США по соевой муке, неблагоприятные вкусовые качества которой вследствие недостаточной обработки могут оттолкнуть некоторое число потенциальных потребителей, несмотря на благожелательное первоначальное отношение к этому продукту. [c.496]
Важная проблема молекулярной биологии и молекулярной биофизики состояла в чтении текстов нуклеиновых кислот. Решение этой проблемы сыграло существенную роль в возникновении генной инженерии — в практических применениях науки о генах. Задача генной инженерии — искусственное перераспределение генов и построение новых генов с целью создания новых белковых веществ и организмов, с целью получения нужных для медицины и сельского хозяйства белков в удобных для производства системах, таких, например, как культуры Е. соИ. [c.268]
Медицинское применение формальдегида основано на его способности свертывать белки. Свертываются от формальдегида и белковые вещества бактерий, что обусловливает их гибель. Одно из важнейших медицинских применений формальдегида — использование с целью дезинфекции, т. е. уничтожения болезнетворных микроорганизмов. Парами формалина (при его кипячении) окуривают дезинфицируемые помещения, растворами формальдегида обрабатываются руки хирургов, хирургические инструменты и т. д. Растворы формальдегида при.меняют для консервирования (сохранения) анатомических препаратов. [c.195]
Примером применения биосинтеза является получение меченых аминокислот с помощью одноклеточных водорослей вида хлорелла, культивируемых на среде, содержащей углерод С. В ходе биосинтеза концентрируется в белковом веществе хлореллы. Затем проводят кислотный гидролиз белка, в результате которого образуются аминокислоты, меченные по углероду. [c.303]
Белки находят очень широкое практическое применение вместе с жирами и углеводами они являются основными пищевыми продуктами. Многие белковые вещества применяются и в промышленности так, шерсть и шелк издавна служат для изготовления тканей шкуры животных используют для переработки в кожу из роговых белковых веществ готовят гребни, пуговицы и другие мелкие изделия. Из некоторых природных белков готовят клеящие вещества. Обычный столярный клей получают из обрезков шкур, рогов, копыт при кипячении их с водой. Из хрящей и костей получают прозрачный, бесцветный или слабожелтый клей, называемый желатиной. Большое значение имеет казеин — белковое вещество, входящее в состав молока и выделяющееся из него в виде творожистой массы. Из казеина готовят пластмассу галалит и различные ценные клейкие составы. [c.387]
Стабилизация и стабильность ферментов по отношению к денатурирующим воздействиям определяют сохранение нативной структуры (нативного состояния) молекул ферментных белков. Проблема стабилизации белковых веществ и, в частности ферментов, имеет громадное значение. Она важна и для производства ферментов, и для всех областей их применения, и, прежде всего, при теоретическом изучении любых свойств ферментов. В литературе имеется много различных сведений о стабилизации белков, но они чаще всего представляют собой отдельные, подчас разрозненные факты систематических обзоров по этой проблеме пока нет. [c.157]
Стабилизация активного белка, повышение его устойчивости, предохране

Добавить комментарий