Вода — Википедия
| Вода | |||
|---|---|---|---|
| |||
Вода в бассейне({{{изображение}}}) | |||
| Систематическое наименование | Оксид водорода Вода[1] | ||
| Традиционные названия | вода | ||
| Хим. формула | H2O | ||
| Состояние | жидкость | ||
| Молярная масса | 18,01528 г/моль | ||
| Плотность | 0,9982 г/см3[2] | ||
| Твёрдость | 1,5[4] | ||
| Динамическая вязкость | 0,00101 Па·с | ||
| Кинематическая вязкость | 0,01012 см²/с (при 20 °C) | ||
| Скорость звука в веществе | (дистиллированная вода) 1348 м/с | ||
| Температура | |||
| • плавления | 273,1 K (0 ° C) | ||
| • кипения | 373,1 K (99,974 ° C) °C | ||
| • разложения | 2200 °C | ||
| Тройная точка | 273,2 K (0,01 ° C), 611,72 Па | ||
| Критическая точка | 647,1 K (374 ° C), 22,064 МПа | ||
| Мол. теплоёмк. | 75,37 Дж/(моль·К) | ||
| Теплопроводность | 0,56 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | -285,83 кДж/моль | ||
| Удельная теплота испарения | 2256,2 кДж/кг[3] | ||
| Удельная теплота плавления | 332,4 кДж/кг[3] | ||
| Показатель преломления | 1,3945, 1,33432, 1,32612, 1,39336, 1,33298 и 1,32524 | ||
| Рег. номер CAS | 7732-18-5 | ||
| PubChem | 962 | ||
| Рег. номер EINECS | 231-791-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | ZC0110000 | ||
| ChEBI | 15377 | ||
| ChemSpider | 937 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
 71 % поверхности Земли покрывает вода
71 % поверхности Земли покрывает водаВода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой H2O: молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)[5][6]
.Вода является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии[7], возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле[8].
Всего на Земле около 1400 млн кубических километров воды. Вода покрывает 71 % поверхности земного шара (океаны, моря, озёра, реки, льды — 361,13 млн квадратных километров[9][10]). Бо́льшая часть земной воды (97,54 %) принадлежит Мировому океану — это солёная вода, непригодная для сельского хозяйства и питья. Пресная же вода находится в основном в ледниках (1,81 %) и подземных водах (около 0,63 %), и лишь небольшая часть (0,009 %) в реках и озерах. Материковые солёные воды составляют 0,007 %, в атмосфере содержится 0,001 % от всей воды нашей планеты
Происходит от др.-русск. вода, далее от праславянского *voda[13] (ср. ст.-слав. вода, болг. вода́, сербохорв. во̀да, словен. vóda, чеш. voda, слвц. voda, польск. woda, в.-луж., н.-луж. woda), затем от праиндоевропейского *wed-, родственно лит. vanduõ, жем. unduo, д.-в.-н. waʒʒar «вода», гот. watō, англ. water, греч. ὕδωρ, ὕδατος, арм. get «река», фриг. βέδυ, др.-инд. udakám, uda-, udán— «вода», unátti «бить ключом», «орошать», ṓdman— «поток», алб. uj «вода»[14][15]. Также родственно русским словам ведро, выдра. В рамках необщепринятой гипотезы о существовании некогда праностратического языка слово может сравниваться с гипотетическим прауральским *wete (ср., например, фин. vesi, эст. vesi
, коми va, венг. víz), а также с предполагаемыми праалтайскими, прадравидийским и пр. словами, и реконструироваться как *wetV для праязыка[16].С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название окись водорода.
- Гидроксид водорода: соединение гидроксильной группы OH— и катиона (H+)
- Гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «гидроксильного остатка» OH—
- Монооксид дигидрогена
- Дигидромонооксид
Физические свойства[править | править код]
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (H2S, CH4, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте и диметилсульфоксиду).
Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| Температура, °С | Удельная теплоёмкость воды, кДж/(кг*К) |
|---|---|
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах[19]:
| Модификация воды | Максимальная плотность при температуре, °С | Тройная точка при температуре, °С |
|---|---|---|
| Н2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| Н218O | 4,3 | 0,31 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути[20][21][22]. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[23]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
 Капля, ударяющаяся о поверхность воды
Капля, ударяющаяся о поверхность водыЧистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния[править | править код]
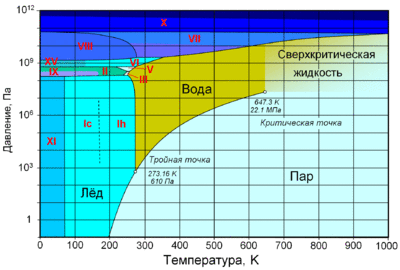
По состоянию различают:

При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[24]:
| Давление, атм. | Температура кипения (Ткип), °C |
|---|---|
| 0,987 (105 Па — нормальные условия) | 99,63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства[править | править код]
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации[править | править код]
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (H2O17 и H2O18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[18].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[18].
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства[править | править код]
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают как амфолит — и кислоту и основание одновременно (катион H+анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Воду можно получать:
- в ходе реакций —
- 2h3O2→2h3O+O2↑{\displaystyle {\mathsf {2H_{2}O_{2}\rightarrow 2H_{2}O+O_{2}\uparrow }}}
- NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}}
- 2Ch4COOH+CaCO3→Ca(Ch4COO)2+h3O+CO2↑{\displaystyle {\mathsf {2CH_{3}COOH+CaCO_{3}\rightarrow Ca(CH_{3}COO)_{2}+H_{2}O+CO_{2}\uparrow }}}
- h3SO4+2KOH→K2SO4+2h3O{\displaystyle {\mathsf {H_{2}SO_{4}+2KOH\rightarrow K_{2}SO_{4}+2H_{2}O}}}
- HNO3+Nh5OH→Nh5NO3+h3O{\displaystyle {\mathsf {HNO_{3}+NH_{4}OH\rightarrow NH_{4}NO_{3}+H_{2}O}}}
- 2Ch4COOH+Ba(OH)2→Ba(Ch4COO)2+2h3O{\displaystyle {\mathsf {2CH_{3}COOH+Ba(OH)_{2}\rightarrow Ba(CH_{3}COO)_{2}+2H_{2}O}}}
- Восстановлением водородом оксидов металлов —
- CuO+h3→Cu+h3O{\displaystyle {\mathsf {CuO+H_{2}\rightarrow Cu+H_{2}O}}}
Под воздействием очень высоких температур или электрического тока (при электролизе)[25], а также под воздействием ионизирующего излучения, как установил в 1902 году[26]Фридрих Гизель[en] при исследовании водного раствора бромида радия[27], вода разлагается на молекулярный кислород и молекулярный водород:
- 2h3O→2h3↑+O2↑{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}\uparrow +O_{2}\uparrow }}}
Вода реагирует при комнатной температуре:
- 2h3O+2Na→2NaOH+h3↑{\displaystyle {\mathsf {2H_{2}O+2Na\rightarrow 2NaOH+H_{2}\uparrow }}}
- со фтором и межгалоидными соединениями
- 2h3O+2F2→4HF+O2{\displaystyle {\mathsf {2H_{2}O+2F_{2}\rightarrow 4HF+O_{2}}}}
- h3O+F2→HF+HOF{\displaystyle {\mathsf {H_{2}O+F_{2}\rightarrow HF+HOF}}} (при низких температурах)
- 3h3O+2IF5→5HF+HIO3{\displaystyle {\mathsf {3H_{2}O+2IF_{5}\rightarrow 5HF+HIO_{3}}}}
- 9h3O+5BrF3→15HF+Br2+3HBrO3{\displaystyle {\mathsf {9H_{2}O+5BrF_{3}\rightarrow 15HF+Br_{2}+3HBrO_{3}}}}
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- Al2S3+6h3O→2Al(OH)3↓+3h3S↑{\displaystyle {\mathsf {Al_{2}S_{3}+6H_{2}O\rightarrow 2Al(OH)_{3}\downarrow +3H_{2}S\uparrow }}}
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
- 4h3O+3Fe→Fe3O4+4h3{\displaystyle {\mathsf {4H_{2}O+3Fe\rightarrow Fe_{3}O_{4}+4H_{2}}}}
- h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}
- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот
- с ацетиленом и другими алкинами
- с алкенами
- с нитрилами
Волновая функция основного состояния воды[править | править код]
В валентном приближении электронная конфигурация молекулы h3O{\displaystyle {\ce {h3O}}}
Тяжёлая вода — Википедия
| Тяжёлая вода | |||
|---|---|---|---|
| |||
| Систематическое наименование | оксид дейтерия | ||
| Традиционные названия | тяжёлая вода | ||
| Хим. формула | D2O | ||
| Состояние | жидкость | ||
| Молярная масса | 20,04 г/моль | ||
| Плотность | 1,1042 г/см³ | ||
| Динамическая вязкость | 0,00125 Па·с | ||
| Температура | |||
| • плавления | 3,81 °C | ||
| • кипения | 101,43 °C | ||
| Критическая точка | |||
| • давление | 21,86 МПа | ||
| Мол. теплоёмк. | 84,3 Дж/(моль·К) | ||
| Уд. теплоёмк. | 4,105 Дж/(кг·К) | ||
| Энтальпия | |||
| • образования | −294,6 кДж/моль | ||
| • плавления | 5,301 кДж/моль | ||
| • кипения | 45,4 кДж/моль | ||
| Давление пара | 10 мм рт. ст. при 13,1 °C 100 мм рт. ст. при 54 °C | ||
| Растворимость | |||
| • в воде | неограниченная | ||
| • в эфире | малорастворима | ||
| • в этаноле | неограниченная | ||
| Показатель преломления | 1,32844 (при 20 °C) | ||
| Рег. номер CAS | 7789-20-0 | ||
| PubChem | 24602 | ||
| Рег. номер EINECS | 232-148-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | ZC0230000 | ||
| ChEBI | 41981 | ||
| ChemSpider | 23004 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Тяжёлая вода́ — обычно этот термин применяется для обозначения тяжеловодородной воды, известной также как оксид дейтерия. Тяжеловодородная вода имеет ту же химическую формулу, что и обычная вода, но вместо двух атомов обычного лёгкого изотопа водорода (протия) содержит два атома тяжёлого изотопа водорода — дейтерия, а её кислород по изотопному составу соответствует кислороду воздуха[1]. Формула тяжеловодородной воды обычно записывается как D2O или 2H2O. Внешне тяжёлая вода выглядит как обычная — бесцветная жидкость без вкуса и запаха. Не радиоактивна.
Молекулы тяжеловодородной воды были впервые обнаружены в природной воде Гарольдом Юри в 1932 году, за что учёный был удостоен Нобелевской премии по химии в 1934 году. Уже в 1933 году Гилберт Льюис впервые выделил чистую тяжеловодородную воду. При электролизе обычной воды, содержащей наряду с обычными молекулами воды незначительное количество молекул полутяжёлой воды (НDО) и ещё меньшее количество молекул тяжёлой воды (D2O), включающих в себя тяжёлый изотоп водорода, остаток постепенно обогащается молекулами этих соединений. Из такого остатка после многократного повторения электролиза Льюису удалось выделить небольшое количество воды, состоящей почти на 100 % из молекул соединения кислорода с дейтерием и получившей название тяжёлой. Этот способ производства тяжёлой воды остаётся основным и сейчас, хотя используется в основном на окончательной стадии обогащения от 5—10 % до >99 % (см. ниже).
После открытия в конце 1938 года деления ядер и осознания возможности использования цепных ядерных реакций деления, индуцированных нейтронами, возникла необходимость в замедлителе нейтронов — веществе, позволяющем эффективно замедлять нейтроны, не теряя их в реакциях захвата. Наиболее эффективно нейтроны замедляются лёгкими ядрами, и самым эффективным замедлителем должны были бы быть ядра обычного водорода (протия), однако они обладают высоким сечением захвата нейтронов. Напротив, тяжёлый водород захватывает очень мало нейтронов (сечение захвата тепловых нейтронов у протия в более чем 100 тысяч раз выше, чем у дейтерия). Технически наиболее удобным соединением дейтерия является тяжёлая вода, причём она способна также служить теплоносителем, отводя выделяющееся тепло от области, где происходит цепная реакция деления. С самых ранних времён ядерной энергетики тяжёлая вода стала важным компонентом в некоторых реакторах, как энергетических, так и предназначенных для наработки изотопов плутония для ядерного оружия. Эти так называемые тяжеловодные реакторы имеют то преимущество, что могут работать на природном (необогащённом) уране без использования графитовых замедлителей, которые на этапе вывода из эксплуатации могут представлять опасность взрыва пыли и содержат наведённую радиоактивность (углерод-14 и ряд других радионуклидов)[2]. Однако в большинстве современных реакторов используется обогащённый уран с нормальной «лёгкой водой» в качестве замедлителя, несмотря на частичную потерю замедленных нейтронов.
Производство тяжёлой воды в СССР[править | править код]
 | Эта статья или раздел описывает ситуацию применительно лишь к одному региону (СССР), возможно, нарушая при этом правило о взвешенности изложения. Вы можете помочь Википедии, добавив информацию для других стран и регионов. |
Промышленное производство и применение тяжёлой воды началось с развитием атомной энергетики. В СССР при организации Лаборатории № 3 АН СССР (современный ИТЭФ) перед руководителем проекта А. И. Алихановым была поставлена задача создания реактора на тяжёлой воде. Это обусловило потребность в тяжёлой воде, и техническим советом Специального комитета при СНК СССР был разработан проект Постановления СНК СССР «О строительстве полупромышленных установок по производству продукта 180», работы по созданию производительных установок тяжёлой воды в кратчайшие сроки были поручены руководителю атомного проекта Б. Л. Ванникову, народному комиссару химической промышленности М. Г. Первухину, представителю Госплана Н. А. Борисову, народному комиссару по делам строительства СССР С. З. Гинзбургу, народному комиссару машиностроения и приборостроения СССР П. И. Паршину и народному комиссару нефтяной промышленности СССР Н. К. Байбакову[3]. Главным консультантом в вопросах тяжёлой воды стал начальник сектора Лаборатории № 2 АН СССР М. И. Корнфельд.
| Параметр | D2O | HDO | H2O |
|---|---|---|---|
| Температура плавления, °C | 3,82 | 2,04 | 0,00 |
| Температура кипения, °C | 101,4 | 100,7 | 100,0 |
| Плотность при 20 °C, г/см³ | 1,1056 | 1,054 | 0,9982 |
| Температура максимальной плотности, °C | 11,6 | 4,0 | |
| Вязкость при 20 °C, сантипуаз | 1,2467 | 1,1248 | 1,0016 |
| Поверхностное натяжение при 25 °C, дин·см | 71,87 | 71,93 | 71,98 |
| Молярное уменьшение объёма при плавлении, см³/моль | 1,567 | 1,634 | |
| Молярная теплота плавления, ккал/моль | 1,515 | 1,436 | |
| Молярная теплота парообразования, ккал/моль | 10,864 | 10,757 | 10,515 |
| pH при 25 °C | 7,41 | 7,266 | 7,00 |
В природных водах один атом дейтерия приходится на 6400—7600[5] атомов протия. Почти весь он находится в составе молекул полутяжёлой воды DHO, одна такая молекула приходится на 3200—3800 молекул лёгкой воды. Лишь очень незначительная часть атомов дейтерия формирует молекулы тяжёлой воды D2O, поскольку вероятность двум атомам дейтерия встретиться в составе одной молекулы в природе мала (примерно 0,5⋅10−7). При искусственном повышении концентрации дейтерия в воде эта вероятность растёт.
Биологическая роль и физиологическое воздействие[править | править код]
Тяжёлая вода токсична лишь в слабой степени, химические реакции в её среде проходят несколько медленнее по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Эксперименты над млекопитающими (мыши, крысы, собаки)[6] показали, что замещение 25 % водорода в тканях дейтерием приводит к стерильности, иногда необратимой[7][8]. Более высокие концентрации приводят к быстрой гибели животного; так, млекопитающие, которые пили тяжёлую воду в течение недели, погибли, когда половина воды в их теле была дейтерирована; рыбы и беспозвоночные погибают лишь при 90 % дейтерировании воды в теле[9]. Простейшие способны адаптироваться к 70 % раствору тяжёлой воды, а водоросли и бактерии способны жить даже в чистой тяжёлой воде[6][10][11][12][13]. Человек может без видимого вреда для здоровья выпить несколько стаканов тяжёлой воды, весь дейтерий будет выведен из организма через несколько дней. Так, в одном из экспериментов по изучению связи вестибулярного аппарата и непроизвольных движений глаз (нистагма) добровольцам предлагалось выпить от 100 до 200 граммов тяжёлой воды; в результате поглощения более плотной тяжёлой воды купулой (желатинообразной структурой в полукружных каналах) её нейтральная плавучесть в эндолимфе каналов нарушается, и возникают лёгкие нарушения пространственной ориентации, в частности нистагм. Этот эффект аналогичен возникающему при приёме алкоголя (однако в последнем случае плотность купулы уменьшается, поскольку плотность этилового спирта меньше плотности воды)[14].
Таким образом, тяжёлая вода гораздо менее токсична, чем, например, поваренная соль. Тяжёлая вода использовалась для лечения артериальной гипертензии у людей в суточных дозах от 10 до 675 г D2O в день[15].
В человеческом организме содержится в качестве естественной примеси столько же дейтерия, сколько в 5 граммах тяжёлой воды; этот дейтерий в основном входит в молекулы полутяжёлой воды HDO, а также во все прочие биологические соединения, в которых есть водород.[источник не указан 584 дня]
Тяжёлая вода накапливается в остатке электролита при многократном электролизе воды. На открытом воздухе тяжёлая вода быстро поглощает пары обычной воды, поэтому можно сказать, что она гигроскопична. Производство тяжёлой воды очень энергоёмко, поэтому её стоимость довольно высока. В 1935 году, сразу после открытия тяжёлой воды, её цена составляла ориентировочно 19 долларов за грамм[16]. В настоящее время тяжёлая вода с содержанием дейтерия 99 % ат., продаваемая поставщиками химических реактивов, при покупке 1 кг сто́ит около 1 евро за грамм[17], однако эта цена относится к продукту с контролируемым и гарантированным качеством химического реактива; при снижении требований к качеству цена может быть на порядок ниже.
Среди населения бытует миф о том, что при длительном кипячении природной воды концентрация тяжёлой воды в ней повышается, что якобы может вредно сказаться на здоровье, из-за публикации предположения В. В. Похлёбкина в книге «Чай. Его типы, свойства, употребление», вышедшей в 1968 году[18]. В действительности повышение концентрации тяжёлой воды при кипячении ничтожно. Академик Игорь Васильевич Петрянов-Соколов как-то подсчитал, сколько воды должно испариться из чайника, чтобы в остатке заметно повысилось содержание дейтерия. Оказалось, что для получения 1 литра воды, в которой концентрация дейтерия равна 0,15 %, то есть всего в 10 раз превышает природную, в чайник надо долить в общей сложности 2,1⋅1030 тонн воды, что в 300 млн раз превышает массу Земли[19]. Гораздо сильнее сказывается на вкусе и свойствах воды при кипячении повышение концентрации растворённых солей, переход в раствор веществ из стенок посуды и термическое разложение органических примесей.
Стоимость производства тяжёлой воды определяется затратами энергии. Поэтому при обогащении тяжёлой воды применяют последовательно разные технологии — вначале пользуются более дешёвыми технологиями, с бо́льшими потерями тяжёлой воды, а в конце — более энергозатратными, но с меньшими потерями тяжёлой воды.
С 1933 по 1946 годы единственным применявшимся методом обогащения был электролиз. В последующем появились технологии ректификации жидкого водорода и изотопного обмена в системах: водород — жидкий аммиак, водород — вода, сероводород — вода. Современное массовое производство во входном потоке использует воду, дистиллированную из электролита цехов получения электролитического водорода, с содержанием 0,1—0,2 % тяжёлой воды.
На первой стадии концентрирования применяется двухтемпературная противоточная сероводородная технология изотопного обмена, выходная концентрация тяжёлой воды 5—10 %. На второй — каскадный электролиз раствора щёлочи при температуре около 0 °C, выходная концентрация тяжёлой воды 99,75—99,995 %.
Крупнейшим в мире производителем тяжёлой воды является Канада, что связано с применением в её энергетике тяжеловодных ядерных реакторов CANDU.
Важнейшим свойством тяжёловодородной воды является то, что она практически не поглощает нейтроны, поэтому используется в ядерных реакторах для замедления нейтронов и в качестве теплоносителя. Она используется также в качестве изотопного индикатора в химии, биологии и гидрологии, агрохимии и др. (в том числе в опытах с живыми организмами и при диагностических исследованиях человека). В физике элементарных частиц тяжёлая вода используется для детектирования нейтрино; так, крупнейший детектор солнечных нейтрино SNO (Канада) содержит 1000 тонн тяжёлой воды.
Дейтерий — ядерное топливо для энергетики будущего, основанной на управляемом термоядерном синтезе. В первых энергетических реакторах такого типа предполагается осуществить реакцию D + T → 4He + n + 17,6 МэВ[20].
В некоторых странах (например, в Австралии) коммерческий оборот тяжёлой воды поставлен под государственные ограничения, что связано с теоретической возможностью её использования для создания «несанкционированных» реакторов на природном уране, пригодных для наработки оружейного плутония.
Полутяжёлая вода[править | править код]
Выделяют также полутяжёлую воду (известную также под названиями дейтериевая вода, монодейтериевая вода, гидроксид дейтерия), у которой только один атом водорода замещён дейтерием. Формулу такой воды записывают так: DHO или ²HHO. Следует отметить, что вода, имеющая формальный состав DHO, вследствие реакций изотопного обмена реально будет состоять из смеси молекул DHO, D2O и H2O (в пропорции примерно 2:1:1). Это замечание справедливо и для THO и TDO.
Сверхтяжёлая вода[править | править код]
Сверхтяжёлая вода содержит тритий, период полураспада которого более 12 лет. По своим свойствам сверхтяжёлая вода (T2O) ещё заметнее отличается от обычной: кипит при 104 °C, замерзает при +9 °C и имеет плотность 1,21 г/см³[21]. Известны (то есть получены в виде более или менее чистых макроскопических образцов) все девять вариантов сверхтяжёлой воды: THO, TDO и T2O с каждым из трёх стабильных изотопов кислорода (16O, 17O и 18O). Иногда сверхтяжёлую воду называют просто тяжёлой водой, если это не может вызвать путаницы. Сверхтяжёлая вода имеет высокую радиотоксичность.
Тяжелокислородные изотопные модификации воды[править | править код]
Термин тяжёлая вода применяют также по отношению к тяжелокислородной воде, у которой обычный лёгкий кислород 16O заменён одним из тяжёлых стабильных изотопов 17O или 18O. Тяжёлые изотопы кислорода существуют в природной смеси, поэтому в природной воде всегда есть примесь обеих тяжелокислородных модификаций. Их физические свойства также несколько отличаются от свойств обычной воды; так, температура замерзания 1H218O составляет +0,28 °C[4].
Тяжелокислородная вода, в частности, 1H218O, используется в диагностике онкологических заболеваний (из неё на циклотроне получают изотоп фтор-18, который используют для синтеза препаратов для диагностики онкозаболеваний, в частности 18-фдг).
Общее число изотопных модификаций воды[править | править код]
Если подсчитать все возможные нерадиоактивные соединения с общей формулой Н2О, то общее количество возможных изотопных модификаций воды всего девять (так как существует два стабильных изотопа водорода и три — кислорода):
- Н216O − лёгкая вода, или просто вода
- Н217O
- Н218O − тяжелокислородная вода
- HD16O − полутяжёлая вода
- HD17O
- HD18O
- D216O − тяжёлая вода
- D217O
- D218O
С учётом трития их число возрастает до 18:
- T216O — сверхтяжёлая вода
- T217O
- T218O
- DT16O
- DT17O
- DT18O
- HT16O
- HT17O
- HT18O
Таким образом, кроме обычной, наиболее распространённой в природе «лёгкой» воды 1H216O, в общей сложности существует 8 нерадиоактивных (стабильных) и 9 радиоактивных «тяжёлых вод».
Всего же общее число возможных «вод» с учётом всех известных изотопов водорода (7) и кислорода (17) формально равняется 476. Однако распад почти всех радиоактивных изотопов водорода и кислорода происходит за секунды или доли секунды (важным исключением является тритий, период полураспада которого более 12 лет). Например, все более тяжёлые, чем тритий, изотопы водорода живут порядка 10−20 с; за это время никакие химические связи просто не успевают образоваться, и, следовательно, молекул воды с такими изотопами не бывает. Радиоизотопы кислорода имеют периоды полураспада от нескольких десятков секунд до наносекунд. Поэтому макроскопические образцы воды с такими изотопами получить невозможно, хотя молекулы и микрообразцы могут быть получены. Интересно, что некоторые из этих короткоживущих радиоизотопных модификаций воды легче, чем обычная «лёгкая» вода (например, 1H215O).
- ↑ Петрянов И. В. Самое необыкновенное вещество // Химия и жизнь. — 1965. — № 3. — С. 2—14.
- ↑ http://www-pub.iaea.org/MTCD/publications/PDF/ngwm-cd/PDF-Files/paper%2017%20%28Holt%29.pdf
- ↑
 документа Протокол № 9 заседания Специального комитета при Совнаркоме СССР. Москва, Кремль 30 ноября 1945 года в Викитеке
документа Протокол № 9 заседания Специального комитета при Совнаркоме СССР. Москва, Кремль 30 ноября 1945 года в Викитеке - ↑ 1 2 Water properties
- ↑ Зельвенский Я. Д. Дейтерий // Химическая энциклопедия: в 5 т. / И. Л. Кнунянц (гл. ред.). — М.: Советская энциклопедия, 1990. — Т. 2: Даффа—Меди. — С. 16—17. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
- ↑ 1 2 D. J. Kushner, Alison Baker, and T. G. Dunstall. Pharmacological uses and perspectives of heavy water and deuterated compounds (англ.) // Can. J. Physiol. Pharmacol. (англ.)русск. : journal. — 1999. — Vol. 77, no. 2. — P. 79—88. — DOI:10.1139/cjpp-77-2-79. — PMID 10535697.
- ↑ Лобышев В. Н., Калиниченко Л. П. Изотопные эффекты D2O в биологических системах. — М.: Наука, 1978. — 215 с.
- ↑ Vertes A. Physiological effects of heavy water. Elements and isotopes: formation, transformation, distribution (англ.). — Dordrecht: Kluwer Acad. Publ., 2004. — 112 p.
- ↑ Trotsenko, Y. A., Khmelenina, V. N., Beschastny, A. P. (1995) The Ribulose Monophosphate (Quayle) Cycle: News and Views. Microbial Growth on C1 Compounds, in: Proceedings of the 8th International Symposium on Microbial Growth on C1 Compounds (Lindstrom M. E., Tabita F. R., eds.). San Diego (USA), Boston: Kluwer Academic Publishers, pp. 23-26
- ↑ Мосин О. В., Швец В. И., Складнев Д. А., Игнатов И. Микробный синтез дейтерий-меченного L-фенилаланина факультативной метилотрофной бактерией Brevibacterium Methylicum на средах с различными концентрациями тяжелой воды // Биофармацевтический журнал. — 2012. — Т. 4, вып. 1. — С. 11—22.
- ↑ Мосин О. В., Игнатов И. Изотопные эффекты дейтерия в клетках бактерий и микроводорослей при росте на тяжелой воде (D2O) // Вода: химия и экология. — 2012. — Вып. 3. — С. 83—94.
- ↑ Crespi H. L. Fully deuterated microorganisms: tools in magnetic resonance and neutron scattering. Synthesis and Applications of Isotopically Labeled Compounds / in: Proceedings of an International Symposium. Baillie T, Jones J.R eds. Amsterdam: Elsevier. 1989. pp. 329—332.
- ↑ Mosin O. V., Ignatov I. Microbiological Synthesis of 2H-Labeled Phenylalanine, Alanine, Valine, and Leucine/Isoleucine with Different Degrees of Deuterium Enrichment by the Gram-Positive Facultative Methylotrophic Bacterium Вrevibacterium Methylicum (англ.) // International Journal of BioMedicine. — 2013. — Vol. 3, iss. 2. — P. 132—138.
- ↑ Money K. E., Myles W. S. Heavy water nystagmus and effects of alcohol (англ.) // Nature. — 1974. — Vol. 247, no. 5440. — P. 404—405. — DOI:10.1038/247404a0. — Bibcode: 1974Natur.247..404M. — PMID 4544739.
- ↑ Патент США № 5 223 269 от 29 июня 1993. Method and composition for the treatment of hypertension. Описание патента на сайте Ведомства по патентам и товарным знакам США.
- ↑ Pharmacologist drinks heavy water in experiment (англ.). Science News Staff (9 February 1935). Дата обращения 7 сентября 2013.
- ↑ Deuterium oxide, 99 atom % D | D2O | Sigma-Aldrich
- ↑ Дейтерий — в чайнике? // Химия и жизнь. — 1969. — № 2. — С. 24—25.
- ↑ Илья Леенсон. Тяжелая вода (неопр.). Энциклопедия Кругосвет. Дата обращения 7 сентября 2013.
- ↑ Андреев Б. М., Зельвенский Я. Д., Катальников С. Г. Тяжелые изотопы водорода в ядерной технике. — М.: Энергоатомиздат, 1987.
- ↑ Зельвенский Я. Д. Тритий // Химическая энциклопедия: в 5 т. / Н. С. Зефиров (гл. ред.). — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан—Ятрохимия. — С. 5—7. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
Структурированная вода — Википедия
Структури́рованная вода́ — термин, чаще всего встречающийся в текстах по нетрадиционной медицине и эзотерике, используемый для обозначения некой «воды с изменённой относительно равновесия к окружающей среде структурой». Зачастую структурированная вода предлагается в качестве «сверхлекарства», способного якобы лечить заболевания, признаваемые неизлечимыми медициной.
Научно доказано лишь существование эффекта упорядочения молекул воды при адсорбции молекул воды на поверхностях, имеющих специфическое чередование положительно и отрицательно заряженных групп атомов, а также при растворении некоторых полимеров, в частности белковых макромолекул, что используется для описания некоторых свойств клеточной жидкости. Это упорядочение не является ни полным по всему объёму жидкости, ни стабильным во времени. Такая структура разрушается в течение непродолжительного времени самостоятельно вследствие теплового движения молекул воды и полностью разрушается при внесении возмущения в структурированную среду (например, при перемешивании). Полное упорядочение воды в стабильную структуру (возникновение дальнего порядка) происходит при её замерзании, но эта структура почти полностью разрушается при размораживании.
Также есть данные о том, что при оттаивании замёрзшей воды в жидкой фазе сохраняются небольшие группы молекул с «ближним порядком», напоминающим порядок молекул льда. Это подтверждается рентгеноструктурным анализом[1]. Однако при взбалтывании или нагревании до 30 °C (например, если её выпить) вода становится полностью аморфной. Этот эффект характерен не только для воды, но и для других веществ вблизи температуры плавления, так ещё в 60х годах, было обнаружено, что расплав монокристаллического германия некоторое время сохраняет молекулярную структуру монокристалла и при охлаждении с большей вероятностью образуется монокристаллический германий. Если же расплав перемешать или сильнее нагреть, то после охлаждения образуется германий с поликристаллической структурой.
С идеей структурированной воды тесно связано предположение гомеопатов о «памяти воды». Основоположник гомеопатии Ганеман считал, будто сильное разведение препаратов превращает вещества, усиливающие симптомы болезни, в лекарства. В XVII веке учёные выяснили примерное количество молекул в одном моле вещества — число Авогадро. Оказалось, что обычные гомеопатические препараты разбавлены настолько сильно, что не содержат ни одной молекулы «действующего» вещества. Тогда гомеопаты придумали «память воды», с тех пор это базовая идея для теоретических основ гомеопатии. Согласно этой идее, вода якобы на молекулярном уровне обладает «памятью» о веществе, некогда в ней растворённом, и сохраняет свойства раствора первоначальной концентрации после того, как в нём не остаётся ни одной молекулы ингредиента. Результаты некоторых опытов якобы действительно указывали на возможность «памяти воды», однако повторно проводившиеся эксперименты не приносили подтверждений реальности феномена[2]. Научное сообщество не принимает концепцию памяти воды[2]. В частности, эксперименты, проведённые в ИТЭБ РАН, показали, что «вода не помнит о прошлом наличии в ней этих [ранее содержавшихся] веществ, также она не помнит и о прошлых внешних физических воздействиях на неё»[3]. Премия в один миллион долларов, объявленная за проверяемый опыт, демонстрирующий память воды, никем не получена[4][5]. В бюллетене «В защиту науки», издаваемом Комиссией по борьбе с лженаукой и фальсификацией научных исследований при Президиуме РАН, концепция существования памяти воды охарактеризована как лженаука[6].
Научные споры вокруг понятия «память воды» разразились в начале 80-х годов XX века после скандальной публикации в журнале Nature статьи[7][8] известного французского иммунолога Жака Бенвениста[en] (Jacques Benveniste: родился 12 марта 1935 года, умер 3 октября 2004 года), в то время возглавлявшего так называемый «200-й отдел» в парижском институте INSERM (Institut National de la Santé et de la Recherche Médicale). Статье предшествовала многолетняя дискуссия между — с одной стороны, последователями и практиками гомеопатии, с другой — представителями академической науки. Гомеопаты утверждали, что вода сохраняет новоприобретённые свойства даже после того, как вещество или препарат разбавлены в ней до практически «нулевой» концентрации; другими словами — обладает своего рода «памятью». Оппоненты считали, что подобное утверждение нарушает все существующие научные представления о законах химии.
В 1983 году Жак Бенвенист[en], впоследствии ставший дважды лауреатом Шнобелевской премии, получил от гомеопата Бернара Пуатвена[9] приглашение принять участие в изучении биохимических растворов малых концентраций. Бенвенист, знакомый с гомеопатическими теориями и относившийся к ним скептически, в свою очередь, предложил группе коллег провести серию научных экспериментов по изучению воздействия на человеческий организм антител, последовательно сокращая их концентрацию в заданном объёме воды. Согласно всем известным законам химии, реакция организма на препарат должна была бы снижаться с уменьшением концентрации и по достижении последней нулевой отметки прекратиться вообще. Бенвенист и его команда, однако, зарегистрировали совершенно иную картину: по мере того, как концентрация антител в растворе падала, сила воздействия препарата то снижалась, то возрастала вновь, а главное, в конечном итоге не сошла к нулю, как ожидали исследователи.
Статью об исследовании учёный отослал для публикации в журнал Nature. Редакция журнала высказала опасение, что публикация этого материала даст гомеопатам-практикам возможность утверждать о научных доказательствах основ гомеопатии, даже если впоследствии утверждения автора будут опровергнуты. В пользу ошибочности исследования говорило также то, что оно требует слишком больших изменений в уже известных физических и химических законах.
Редактор журнала Nature Джон Мэддокс[en] заметил: «Наш ум не столько закрыт, сколько не готов изменить представление о том, как устроена современная наука». Однако у редакции журнала не было причин отклонять статью, поскольку на то время в ней не было обнаружено методологических ошибок.
В конце концов, был найден компромисс. Статью опубликовали в № 333 Nature. Ей предшествовала заметка Мэддокса, в которой тот предостерегал читателей от вынесения преждевременных суждений и приводил несколько примеров нарушения известных законов физики и химии, которые неизбежны, если утверждения Бенвениста верны. Мэддокс также предложил воспроизвести эксперимент под контролем группы, включавшей в себя самого Мэддокса, Джеймса Рэнди (основателя Фонда Джеймса Рэнди) и Уолтера Стюарта (физика и внештатного сотрудника Национального института здоровья США)[10].
Группа приехала в лабораторию Бенвениста и повторила эксперимент. В первой серии опыты проводились в точности как было описано в статье Бенвениста. Полученные данные очень близко совпали с опубликованными в статье. Однако Мэддокс заметил, что в процессе исследования экспериментаторы были осведомлены, в каких колбах находится антиген, а в каких нет. Во второй серии опытов Мэддокс потребовал соблюсти условия «двойного слепого» метода исследования. В помещении велось видеонаблюдение, надписи на пробирках были зашифрованы. Хотя все (включая группу Мэддокса) были уверены, что результат повторится, эффект немедленно исчез[11].
Отчёт был опубликован в ближайшем выпуске Nature. В заключительной части говорилось: «Нет никаких оснований для предположения, что antiIgE в высоком разведении сохраняют свою биологическую активность. Гипотеза о том, что вода обладает памятью о прошлых растворах, является столь же ненужной, как и надуманной». Изначально Мэддокс предполагал, что кто-то в лаборатории подшутил над Бенвенистом, однако позже он заметил: «Мы уверены, что лаборатория способствовала и лелеяла заблуждения Бенвениста в интерпретации данных». Мэддокс также указал, что работу двух сотрудников учёного оплачивала гомеопатическая компания Boiron[12].
В том же номере журнала был опубликован ответ Бенвениста, в котором он упрекал группу Мэддокса в предвзятости. Он также указал, что гомеопатическая компания, оплачивавшая работу его сотрудников, оплатила также счёт за отель группы Мэддокса[11].
В ответ (в телепередаче «Quirks and Quarks») Мэддокс отверг обвинения и настаивал на том, что возможность использования результатов сообществом гомеопатов требовала немедленной перепроверки экспериментов. Провал в «двойном слепом» тестировании явно указывает на влияние «эффекта экспериментатора» на первоначальный результат. Мэддокс также заметил, что вся процедура проверки была полностью согласована обеими сторонами. И лишь после неудачи Бенвенист начал это опровергать.
В 1997 году Бенвенист основал собственную компанию Digibio, в которой занялся ещё более экзотическими опытами (в частности, утверждал о возможности передачи биологической информации по телефону и через Интернет).
В числе тех, кто поддержал Бенвениста, был нобелевский лауреат 1973 года физик Брайан Джозефсон. В 1999 году журнал Time сообщил о том, что Бенвенист и Джозефсон, с одной стороны, и Американское физическое общество (APS), с другой, пришли к соглашению о проведении эксперимента вслепую в рамках Фонда Джеймса Рэнди (за доказательство существования эффекта «памяти воды» полагался 1 миллион долларов США)[13]. Однако опыты проведены не были[14].
В 2000 году был проведён независимый тест на предмет возможности передачи свойств «структурированной» воды на расстоянии: его профинансировало американское Министерство обороны. Используя ту же аппаратуру, что и команда Бенвениста, группа американских учёных не смогла обнаружить ни малейших следов эффекта, описанного в оригинальном отчёте. Было замечено, что положительный эффект достигается, только если в эксперименте участвует хотя бы один человек из лаборатории Бенвениста. Французский учёный, признав существование такой закономерности, заявил, что вода реагирует лишь на присутствие «симпатизирующих» ей людей, что само по себе доказывает существование у неё «памяти».[15]
В 2002 году международная группа учёных во главе с профессором Мадлен Эннис из Королевского университета в Белфасте заявила о том, что ей удалось доказать реальность эффекта, описанного Бенвенистом. Рэнди немедленно предложил тот же 1 миллион программе BBC Horizon, которая взялась провести наглядную демонстрацию эксперимента. Однако в ходе опытов, проведённых под наблюдением вице-президента Королевского общества профессора Джона Эндерби, заявления Эннис не подтвердились.
В журнале Focus (№ 168) в разделе «Тайны» была опубликована статья о гомеопатии. В ней, среди прочих, приводятся и такие мнения:
- Совершенно ясно, что вода просто не может «хранить» в себе информацию. Это полностью противоречит всему, что мы знаем о жидкостной структурной динамике. Структура воды, между тем, меняется гораздо стремительнее, чем структуры других жидкостей. — Доктор Джаред Смит, Национальная лаборатория Беркли, Калифорния.
- Это примитивный и ложный аргумент. Тот факт, что водородные связи создаются и разрушаются почти мгновенно, не вызывает сомнений, но он вовсе не означает, что эти меняющиеся структуры не способны нести в себе информацию. Можно провести аналогию с народным танцем: каждый участник постоянно меняет партнёров, но рисунок танца остаётся неизменным. — Профессор Мартин Чаплин, Лондонский университет Саутбэнк[16].
- В 2002 году Луи Рей выполнил[17]термолюминесцентный анализ растворов малых концентраций. Некоторые из таких растворов не содержали ни одной молекулы прежде растворённого в них вещества. Между тем, их термолюминесцентный «отпечаток» оставался таким же, каким бы он был, если бы вещество было по-прежнему растворено в воде.
Предположение о существовании «памяти воды» породило множество спекуляций. В 1999 году в Японии вышла книга Масару Эмото «Послания воды» («Messages from Water»), в которой утверждалось, что вода совершенно определённым образом меняет свою структуру под воздействием тех или иных человеческих эмоций. В качестве доказательств автор привёл фотографии кристалликов льда, которые выглядят «красиво» (если на воду заранее воздействовали положительными раздражителями — приятной музыкой, мыслями, эмоциями) или «уродливо» (если раздражитель был отрицательный). Масару организовал торговлю так называемой «структурированной водой». Доктор Дин Рэдин (Institite of Noetic Sciences, Калифорния) вызвался повторить опыты Эмото: он сфотографировал кристаллики льда (из воды, на которую до этого молились 2000 японцев), поместил их рядом с фотографиями обычных кристаллов и предложил независимому жюри из 100 человек вслепую оценить «эстетическое состояние» кристаллов. По его утверждению, эстетическая оценка «освящённых» кристаллов намного выше, чем оценка кристаллов льда из обычной воды[источник не указан 1133 дня]. Оба «исследователя» не приводят сведений о том, каким образом отбирались кристаллы воды для показа испытуемым.
Физика[править | править код]
В 1967 году советские ученые Н. Федякин и Б. Дерягин исследовали в лабораторных условиях ассоциированные формы воды, получая их в тонких кварцевых капиллярах. Эти данные впоследствии не нашли подтверждения в их же дальнейших экспериментах.
Теория кластерной структуры воды была опровергнута как теоретически в начале 80-х годов применением теории перколяции, так и экспериментально измерением времени жизни межмолекулярных водородных связей (порядка пикосекунд)[18]. Другие методы, однако, показывают возможность существования ближнего порядка — методом Рамановской спектроскопии Сейкали показывает возможные положения молекул воды в кластерах порядка 100 молекул[19][20][21]. Другие авторы сообщают о кластерах размерами до 3 нм[22][23][24]. В воде обнаружены когерентные дальнодействующие диполь-дипольные взаимодействия субпикосекундной длительности на расстояниях до 2 нм, аналогичные тем, которые наблюдаются во льду.[25]
Медицина и биология[править | править код]
Современная медицина и биология не имеет научных доказательств утверждениям тех, кто приписывает структурированной воде поразительные целебные свойства; см., например, статью академика РАН Эдуарда Круглякова[26]. Тем не менее, нобелевский лауреат вирусолог Люк Монтанье в интервью журналу Nature за декабрь 2010 года высказался в защиту Бенвениста как учёного, который «был отвергнут всеми, потому что смотрел далеко вперёд», но «думал в основном правильно»[27][28].
В настоящее время научных сведений об использовании «памяти воды» нет.
Ссылки на «память воды» в отношении применения водных растворов для лечения заболеваний на данный момент не имеют научных оснований.
- ↑ Кнунянц И. Л. Краткая химическая энциклопедия. — T.1 — М.: Советская энциклопедия, 1967.
- ↑ 1 2 P. Ball, Here lies one whose name is writ in water. // Nature. 8 August 2007, doi:10.1038/news070806-6.
- ↑ Г. Р. Иваницкий, А. А. Деев, Е. П. Хижняк. Может ли существовать долговременная структурно-динамическая память воды? (рус.) // Успехи физических наук. — Российская академия наук, 2014. — Т. 184, № 1. — С. 43—74. — DOI:10.3367/UFNr.0184.201401b.0043.
- ↑ Миллион за доказательство памяти воды — Фонд Джеймса Рэнди
- ↑ Homeopathy: The Test
- ↑ Сергеев, А. Г. Синекдоха отвечания, или Защита гомеопатическая // В защиту науки. — 2017. — № 19. — С. 90.
…существуют десятки настоящих лженаук, таких как астрология и хиромантия, экстрасенсорика и парапсихология, криптобиология и биоэнергетика, биорезонанс и иридодиагностика, креационизм и телегония, уфология и палеоастронавтика, эниология и дианетика, нумерология и соционика, физиогномика и графология, информациология и универсология, лозоходство и контактерство, дерматоглифическое тестирование и геопатогенные зоны, геополитика и лунный заговор, теории эфира и торсионных полей, памяти воды и волновой генетики
- ↑ homeoinfo.com: Статья Бенвениста в Nature (недоступная ссылка) (недоступная ссылка)
- ↑ J. Benveniste; E. Dayenas, F. Beauvais, J. Amara et all (30 June 1988). «Human basophil degranulization triggered by very dilute antiserum against IgE». Nature 333: 816—818.
- ↑ Mr. Bernard Poitevin, Editor-in-chief, La Revue d’Homéopathie. Bormes-les-Mimosas, France
- ↑ Access : When to believe the unbelievable : Nature
- ↑ 1 2 https://web.archive.org/web/20060526044137/http://br.geocities.com/criticandokardec/benveniste02.pdf (недоступная ссылка — история, копия)
- ↑ Science: The Water That Lost Its Memory — TIME
- ↑ Leon Jaroff, Michael Brunton, Bruce Crumley. Homeopathic E-Mail (англ.). Time (17 May 1999). Архивировано 22 августа 2011 года.
- ↑ А Nobel Laureate reneges
- ↑ Can specific biological signals be digitized?
- ↑ BBC Focus. № 168. Mysteries: Homeopathy (неопр.) (недоступная ссылка). Дата обращения 25 января 2008. Архивировано 12 января 2008 года.
- ↑ L. Rey, Thermoluminescence of ultra-high dilutions of lithium chloride and sodium chloride (недоступная ссылка), Physica A 323, 2003, pp. 67-74
- ↑ F. N. Keutsch and R. J. Saykally, Water clusters: Untangling the mysteries of the liquid, one molecule at a time, Proc. Natl. Acad. Sci. U.S.A. 98 (2001) 10533-10540.
- ↑ Saykally, R. et al. (2005) Unified Description of Temperature-Dependent Hydrogen Bond Rearrangements in Liquid Water, PNAS, Vol. 102, № 40, pp. 14171-14174.
- ↑ Fowler, P. W., Quinn, C. M., Redmond, D. B. (1991) Decorated fullerenes and model structures for water clusters, The Journal of Chemical Physics, Vol. 95, No 10, p. 7678.
- ↑ Ignatov, I., Mosin, O. V. (2013) Structural Mathematical Models Describing Water Clusters, Journal of Mathematical Theory and Modeling, Vol. 3, No 11, pp. 72-87.
- ↑ Sykes, М. (2007) Simulations of RNA Base Pairs in a Nanodroplet Reveal Solvation-Dependent Stability, PNAS, Vol. 104, № 30, pp. 12336-12340.
- ↑ Loboda, O, Goncharuk, V. (2010) Theoretical Study on Icosahedral Water Clusters,Chemical Physics Letters, Vol. 484, № 4-6, pp. 144—147.
- ↑ Tokmachev, A.M., Tchougreeff, A.L., Dronskowski, R. (2010) Hydrogen-Bond Networks in Water Clusters: An Exhaustive Quantum-Chemical, European Journal of Chemical Physics And Physical Chemistry, Vol. 11, № 2, pp. 384—388.
- ↑ Elton, D. C. & Fernández-Serra, M. The hydrogen-bond network of water supports propagating optical phonon-like modes.// Nature Commun. 7:10193 doi: 10.1038/ncomms10193 (2016).
«The local structure of liquid water as a function of temperature is a source of intense research. This structure is intimately linked to the dynamics of water molecules, which can be measured using Raman and infrared spectroscopies. The assignment of spectral peaks depends on whether they are collective modes or single-molecule motions. Vibrational modes in liquids are usually considered to be associated to the motions of single molecules or small clusters. Using molecular dynamics simulations, here we find dispersive optical phonon-like modes in the librational and OH-stretching bands. We argue that on subpicosecond time scales these modes propagate through water’s hydrogen-bond network over distances of up to 2 nm. In the long wavelength limit these optical modes exhibit longitudinal-transverse splitting, indicating the presence of coherent long-range dipole-dipole interactions, as in ice. Our results indicate the dynamics of liquid water have more similarities to ice than previously thought…In this work, we have presented several lines of evidence for short-lived optical phonons that propagate along the H-bond network of water. The longitudinal and transverse nonlocal susceptibility exhibit dispersive peaks with dispersion relations resembling optical phonons. As the temperature is lowered, the resonance frequencies and LO-TO splittings of these modes converge towards the values for phonons in ice Ih. By comparing our results with a recent study of ice XI we believe both modes likely consist of coupled wagging and rocking librations…The large spatial range and coherent propagation of these modes is surprising and implies the existence of an extended hydrogen-bond network, in contrast to earlier ideas about the structure of water which emphasize dynamics as being confined within small clusters. Simulations with larger simulation boxes are needed to fully quantify the extent of the longitudinal modes. The ability of water to transmit phonon modes may be relevant to biophysics, where such modes could lead to dynamical coupling between biomolecules, a phenomena that is currently only being considered at much lower frequencies.
- ↑ Мыльный пузырь из структурированной воды в газете «Наука в Сибири», № 39 (2275), октябрь 2000 г.
- ↑ Почему научное сообщество бывает чересчур жёстким — Газета. Ru
- ↑ Montagnier, L., Aissa, J. Del Giudice, E., Lavallee, C. Tedeschi, A., G Vitiello, G., DNA Waves and Water, J. Phys. Conf. Ser. 2011; (306) 1:1-10.
- Эйзенберг Д., Кауцман В. Структура и свойства воды: Пер. с англ. — Ленинград: Гидрометиоиздат, 1975. — 280 с.
- «Вода в биологических системах и их компонентах». Межведомств.сб./ЛГУ; Отв.ред. О. Ф. Безруков.-Л., Изд-во ЛГУ, 1983, 172 с (Молекулярная физика и биофизика водных систем; Вып.5).
- Китайгородский А. И. «Молекулярные кристаллы».
- Синюков В. В. Структура одноатомных жидкостей, воды и водных растворов электролитов.
- Линг Г. Физическая теория живой клетки. Незамеченная революция. Санкт-Петербург: Наука, 2008, 376 с.
- Иваницкий Г. Р., Деев А. А., Хижняк Е. П. Может ли существовать долговременная структурно-динамическая память воды? (рус.) // Успехи физических наук. — Российская академия наук, 2014. — Т. 184. — С. 43—74. — DOI:10.3367/UFNr.0184.201401b.0043.
- Пономаренко Г.Н., Турковский И.И. Свободная энергия и биологические процессы // Биофизические основы физиотерапии. — Учебное пособие. — М.: Медицина, 2006. — С. 39—42. — 176 с.
На русском языке[править | править код]
На английском языке[править | править код]
- DigiBio — Jacques Benveniste’s water memory research company.
Другие материалы[править | править код]
- BBC Focus. № 168. Mysteries: Homeopathy (англ.) Архивировано из первоисточника 2009/05/11.
- John Langone. The Water That Lost Its Memory (англ.) // Time : magazine. — 1988. — 8 August.
- J. Benveniste; E. Dayenas, F. Beauvais, J. Amara et all. Human basophil degranulization triggered by very dilute antiserum against IgE (англ.) // Nature : journal. — 1988. — 30 June (vol. 333). — P. 816—818. Архивировано 26 мая 2006 года.
- J. Maddox; J. Randi, W. W. Stewart. «High-dilution» experiments a delusion (англ.) // Nature. — 1988. — 28 July (vol. 334). — P. 287—290. Архивировано 26 мая 2006 года.
- J. Maddox; J. Randi, W. W. Stewart. «High-dilution» experiments a delusion (англ.) // Nature. — 1988. — 28 July (vol. 334). — P. 291. Архивировано 26 мая 2006 года.
- P. Coles. Benveniste controversy rages on in the French press (англ.) // Nature : journal. — 1988. — 28 July (vol. 334). — P. 372.
- J. Benveniste; P. Jurgens, W. Hsueh and J. Aissa. Transatlantic Transfer of Digitized Antigen Signal by Telephone Link (англ.) // Journal of Allergy and Clinical Immunology (англ.)русск. : journal. — 1997. — 21 February.
- J. Benveniste; Aissa, J., Guillonnet. The molecular signal is not functional in the absence of «informed water» (англ.) // Medical Hypotheses (англ.)русск. : journal. — Vol. 54, no. A163 (abstr.).
- J. Benveniste; Thomas Y., Schiff M., Belkadi L., Jurgens P., Kahhak L. Activation of human neutrophils by electronically transmitted phorbol-myristate acetate (англ.) // The FASEB Journal (англ.)русск. : journal. — Federation of American Societies for Experimental Biology (англ.)русск.. — Vol. 13, no. 1. — P. 33—39.
- Jonas, Wayne B.; John A. Ives, Florence Rollwagen, Daniel W. Denman, Kenneth Hintz, Mitchell Hammer, Cindy Crawford, and Kurt Henry. Can specific biological signals be digitized? (англ.) // The FASEB Journal (англ.)русск. : journal. — Federation of American Societies for Experimental Biology (англ.)русск., 2006. — January (vol. 20, no. 1). — P. 23—28. — this paper includes an excellent references list.
- Hirst S. J.; Hayes N. A., Burridge J., Pearce F. L., Foreman JC. Human basophil degranulation is not triggered by very dilute antiserum against human IgE (англ.) // Nature : journal. — 1993. — 9 December (vol. 366, no. 5). — P. 525—527.
- Ovelgonne, J. H.; Bol, A. W., Hop, W. C., van Wijk, R. Mechanical agitation of very dilute antiserum against IgE has no effect on basophil staining properties (англ.) // Experientia : journal. — 1992. — 15 May (vol. 48, no. 5). — P. 504—508.
- Belon, P., Cumps, J., Ennis, M., Mannaioni, P., Sainte-Laudy, J., Roberfroid, M., Wiegant, F. Inhibition of human basophil degranulation by successive histamine dilutions: Results of a European multi-centre trial (англ.) // Inflammation Research (англ.)русск. : journal. — 1999. — April (vol. 48, no. Suppliment 1). — P. 17—18.
- Ennis M.; Brown V. Flow-cytometric analysis of basophil activation: inhibition by histamine at conventional and homeopathic concentrations (англ.) // Inflammation Research (англ.)русск. : journal. — 2001. — April (vol. 50, no. Supplement 2). — P. 47—48.
- Homeopathy: The test (неопр.) (26 ноября 2003). — Homeopathy is back where it started without any credible scientific explanation. That won’t stop millions of people putting their faith in it, but science is confident. Homeopathy is impossible.. Дата обращения 4 марта 2007. Архивировано 22 августа 2011 года.
- Email from Madeleine Ennis detailing differences between the BBC Horizon program’s experiment and her own (неопр.) (недоступная ссылка) (9 декабря 2003). Дата обращения 8 августа 2007. Архивировано 28 сентября 2007 года.
- Совместимы ли мракобесие и инновации? Эдуард Павлович Кругляков, академик «Троицкий вариант» № 23(117), 20 ноября 2012 года
Вода (фильм, 2006) — Википедия
 Ледяной кристалл якобы после воздействия на него Симфонии № 40 Моцарта. Кадр из фильма «Великая тайна воды».
Ледяной кристалл якобы после воздействия на него Симфонии № 40 Моцарта. Кадр из фильма «Великая тайна воды».«Вода»[1] (также известен под названием «Великая тайна воды») — псевдонаучный[2][3][4] фильм телеканала «Россия». Впервые был показан в эфире 9 апреля 2006 года. В фильме, снятом в научно-популярном жанре, высказывается ряд паранаучных и псевдонаучных взглядов на свойства воды, которые преподносятся его авторами в качестве научных.
Свои суждения о «структурировании воды» высказали авторы неакадемических исследований из Англии, Израиля, Китая, России, США, Японии и других стран. В фильме также принимали участие богословы различных вероисповеданий, высказавшие мнения о воде с позиции своих конфессий.
17 ноября 2006 года фильм получил три премии ТЭФИ, в том числе за лучший документальный фильм. Фильм вызвал резкую критику научной общественности, в том числе со стороны Комиссии по борьбе с лженаукой и фальсификацией научных исследований Российской академии наук[2].
В числе учёных, принимавших участие в фильме, были:
- Курт Вютрих, лауреат Нобелевской премии по химии в 2002 году;
- Инюшин Виктор Михайлович[5], биофизик, доктор биологических наук, профессор, заведующий кафедрой биофизики Казахского национального университета имени аль-Фараби, заведующий лабораторией биофизической экологии.
- Герберт Клима, доктор наук, профессор Венского института ядерной физики, Австрия;
- Казначеев, Влаиль Петрович, академик Российской академии медицинских наук, Новосибирск, Россия;
- Рустом Рой (англ.)русск., почетный профессор в отставке Пенсильванского университета, специалист по материаловедению, сторонник нетрадиционной медицины, науки и религии[6];
- Мартин Чаплин (Martin Chaplin), профессор, заведующий лабораторией Лондонского университета Южного побережья (англ.)русск., Великобритании[7];
- Воейков, Владимир Леонидович, доктор наук, профессор биологического факультета МГУ;
- Вячеслав Звонников, доктор медицинских наук, профессор, Россия;
- Ван Гуйхуа, главный агроном академии агрономической науки, Китай;
- Перл Лаперла (Dr. Pearl Laperla), доктор альтернативной медицины (степень за работу по акупунктуре[8]), специалист по аюрведическим практикам (в фильме выдаётся за иммунолога), Невада, США, участвовала также в аналогичном фильме «Плесень»;
- Константин Коротков, доктор технических наук, профессор, действительный член РАЕН;
- Александр Солодилов, доктор физико-математических наук, член-корреспондент РАЕН, основатель школы «Телос», генеральный директор ООО «Телос-Сибирь».
Неакадемические исследователи:
- Аллоис Грубер, исследователь;
- Леонид Извеков, исследователь, заведующий лабораторией по исследованию структуры воды, генеральный директор ОАО «Аква-система»[9], Россия;
- Масару Эмото, исследователь, Япония.
Богословы и религиозные деятели:
В адрес фильма прозвучало много критики как со стороны учёных, так и со стороны журналистов.
Комиссия по борьбе с лженаукой Российской академии наук крайне резко отозвалась о фильме. В бюллетене комиссии отмечается:
В апреле 2006 г. телеканал «Россия» показал мастерски снятый фильм «Великая тайна воды», который иначе как пасквилем на мировую науку назвать нельзя.
В конце 2006 г. фильм получил три премии «ТЭФИ». Тем самым телевизионных дел мастера убедительно продемонстрировали, что для них самое главное — рейтинг, даже если он достигается ценой грубого обмана. А то, что при этом совершенно беззастенчиво попирается наука, что людям навязываются средневековые представления, организаторам премиального балагана безразлично…[2]
В том же номере бюллетеня приводится пример того, как снимались сюжеты с учёными, выступавшими в фильме:
Фильм возмутил научную общественность. Правда, есть «учёные», которые осознали, что на науке много не заработаешь, зато на обмане людей можно делать большие деньги. Подобных перевёртышей в науке мало. Но именно они собраны в фильме. Нелишне повторить, что исключением среди них является лауреат Нобелевской премии Курт Вютрих, который сообщил мне, что российские телевизионщики снимали в США его рассказ о воде целый час. Однако в фильм включили лишь три малозначительных фрагмента по 20 секунд. Его рассказ мастеров обмана мало интересовал. Им было важно назвать в этом пасквиле имя крупного уважаемого учёного[2].
В № 7 бюллетеня комиссии РАН (2010 г.) С. Г. Кара-Мурза в статье об обскурантизме на телевидении заявляет, что позиционирование таких фильмов, как «Великая тайна воды», научно-популярными препятствует восстановлению авторитета науки в обществе[4].
В предисловии к бюллетеню № 5 Комиссии РАН по борьбе с лженаукой (2009 г.) фильм оценивается как внесший «ощутимый вклад в стимулирование лженауки на новые „исследования“ воды, граничащие с чудом»[3].
По словам телекритика Ирины Петровской:
«Великая тайна воды» — это очень красивая такая история, очень красивая с точки зрения телевизионной картинки, но при этом очень сомнительная с точки зрения соответствия научной истине, потому что там доказываются такие вещи, что вода, как живой организм, она имеет память, она реагирует на агрессивные слова. Это может быть очень интересно. Но дело в том, что немедленно люди, связанные с наукой, имеющие отношение к науке, сказали, что это полнейшее мракобесие.
— Радиостанция «Эхо Москвы» / Передачи / Человек из телевизора / Суббота, 18.11.2006: Ирина Петровская[10]
Алексей Паевский в статье «Пипл хлебает», вышедшей в Газета.ру под рубрикой «Мракобесие»[11], отметил «банальное незнание школьной программы» у авторов фильма и привёл несколько примеров грубых фактических ошибок:
- в фильме звучит вопрос «Почему из всех жидкостей у воды самое высокое поверхностное натяжение?», однако из веществ, которые при нормальных условиях находятся в жидком агрегатном состоянии, наибольшее поверхностное натяжение имеет ртуть — 465⋅10−3 Н/м, вода — только 73⋅10−3 Н/м.
- в фильме звучит фраза «…только вода — единственное вещество на планете — может находиться в трёх состояниях (жидком, твердом и газообразном)», однако в трёх состояниях может находиться практически любое вещество, даже одновременно, см. «тройная точка».
- в фильме звучит фраза «Почему она (вода) является самым мощным растворителем на Земле?», однако даже уксусная кислота (не говоря об азотной или серной) является, по мнению Паевского, значительно лучшим растворителем.
Как пишет Паевский, «эти подтасовки возникли на экране в течение буквально одной минуты. А фильм длится больше часа». Он считает, что эти ложные утверждения авторов являются преднамеренным обманом: «Авторы до того уверены, что пипл схавает или, вернее, схлебает их сказку, что обманывают даже в тех местах, где их может уличить абсолютно ничего не понимающий в науке человек». Паевский указывает на то, что Эмото Масару, представленный в фильме как «исследователь воды», является одновременно главным спонсором фильма и создателем религиозной секты, продающей «„намоленную воду“ по 35 долларов за пять унций. Получается, что канал „Россия“ предоставил бесплатную (?) рекламу в прайм-тайм товару под названием „Indigo Water — геометрически совершенная вода с посланием вашему телу“».
Марина Аствацатурян, научный обозреватель радио «Эхо Москвы», считает, что вода стала «объектом сотворения псевдонаучных сенсаций, часть из которых сконцентрирована в так называемом „научно-популярном“ фильме „Великая тайна воды“». Аствацатурян утверждает, что фильм насыщен «обилием несоответствий действительности» и приводит некоторые их примеры:
- «полтора литра воды впитывается через кожу, когда мы принимаем душ или ванну» — легко опровергается взвешиванием до и после душа.
- согласно фильму, суперматерик Гондвана существовал 3,5 млн лет назад — на самом деле он последний раз откололся от суперматерика Пангея ещё 180 млн лет назад и раскололся 100 млн лет назад.
- авторы фильма акцентируют внимание на загадочности процесса поднятия воды по стволам деревьев, однако капиллярные силы известны со школьного курса физики.
Впрочем, это имеет такое же отношение к свойствам воды, как фильм, показанный по федеральному, то есть существующему на деньги налогоплательщика, каналу, к науке (о спасении которой заговорила власть) и к её популяризации. То есть никакого отношения.
— Радиостанция «Эхо Москвы» / Передачи / Гранит науки / Четверг, 20.04.2006[12]
Виктор Матизен в статье в «Новых известиях» раскритиковал награждение фильма премией «Лавр»: «Отдав премию паранаучной и притом заведомо недобросовестной ленте, Совет „Лавра“, в котором доминируют представители телеканалов, фактически выдал „великую тайну“ самого телевидения — его готовность обрабатывать мозги любыми средствами»[13].
Фильм вызвал критику представителей Русской православной церкви, обвинивших создателей в оккультном и эзотерическом содержании, выдаваемом за науку, а также в дезориентации верующих[14][15]. Георгий Белодуров отметил, что большинство участвующих в фильме «академиков» являются академиками РАЕН[15].
Всеволод Твердислов, доктор физико-математических наук, профессор, заведующий кафедрой биофизики физического факультета МГУ в комментарии для интернет-портала «Православие и мир» отметил следующее:
Отвратительно и то, что показали его 19 января, когда православные празднуют Крещение, и то, что вставили высказывания митрополита Смоленского Кирилла, нынешнего Патриарха. Он говорит правильные вещи, но потом, после его высказываний, идет очередная псевдонаучная белиберда. Все это талантливо смешано в одну кашу, чтобы внушить зрителю, будто и Церковь поддерживает эту белиберду[16].
- Три премии ТЭФИ, в номинациях: «Документальный фильм», «Режиссёр телевизионного документального фильма/сериала», «Оператор телевизионного документального фильма/сериала»[17][18].
- Премия «Лавр» в разряде «лучший научно-популярный фильм».
- ↑ «Вода», информация на сайте канала «Россия 1»
- ↑ 1 2 3 4 Академик Э. П. Кругляков. Лженаука — путь в Средневековье (неопр.). Бюллетень «В защиту науки», №2. «Наука». Дата обращения 26 января 2011. Архивировано 16 февраля 2012 года.
- ↑ 1 2 Кругляков Э. П. Бюллетень «В защиту науки», №5 (неопр.). «Наука» (2009). Дата обращения 26 января 2011. Архивировано 12 марта 2012 года.
- ↑ 1 2 Кара-Мурза С. Г. От просвещения к мракобесию (неопр.). Бюллетень «В защиту науки», №7. «Наука» (2010). Дата обращения 26 января 2011. Архивировано 12 марта 2012 года.
- ↑ Э. П. Кругляков в статье «Лженаука» пишет о Инюшине следующее: «А недавно появился „учёный“ из Казахстана В. Инюшин, который с помощью „биоплазмы“, — корешков и семян растений в кастрюле — предсказывает землетрясения… с оплатой своих трудов из бюджета России. По поводу успешных предсказаний сведений нет, но деньги этот мошенник получает исправно.» [1][2]
- ↑ http://www.rustumroy.com/ Домашняя страница Рустума Роя
- ↑ M.Chaplin, Water structure and Science
- ↑ Список участников 4-й ежегодной конференции по естественному здоровью, ароматерапии и траволечению (неопр.) (недоступная ссылка). Дата обращения 9 июня 2010. Архивировано 26 июля 2008 года.
- ↑ О компании | Структурированная вода
- ↑ Петровская И. Радиостанция «Эхо Москвы» / Передачи / Человек из телевизора / Суббота, 18.11.2006
- ↑ Пипл хлебает
- ↑ Радиостанция «Эхо Москвы» / Передачи / Гранит науки / Четверг, 20.04.2006
- ↑ Виктор Матизен. Репутацию подмочили «Водой». Премия «Лавр» раскрыла великую тайну телевидения // Новые известия. — М., 2006. — № 11 декабря. Архивировано 20 сентября 2008 года.
- ↑ Александр Пикалев. «Плесень» — кушать подано! (неопр.) (недоступная ссылка). сайт РАЦИРС (3 фев 2009). Архивировано 22 фев 2009.
- ↑ 1 2 Белодуров Г. Фильм «Вода»: документальная ложь // Журнал «Нескучный сад»
- ↑ Фильм “Великая тайны воды” или лженаука на ТВ (неопр.). Православие и мир. Дата обращения 21 мая 2016.
- ↑ Lenta.ru: Масс-медиа: Коварная «ТЭФИ»
- ↑ ПОБЕДИТЕЛИ КОНКУРСА «ТЭФИ-2006»-«ПРОФЕССИИ» Архивировано 25 июня 2012 года.
Бутилированная вода — Википедия
 | Эта статья или раздел описывает ситуацию применительно лишь к одному региону, возможно, нарушая при этом правило о взвешенности изложения. Вы можете помочь Википедии, добавив информацию для других стран и регионов. |
Бутилированная вода — пищевой продукт, представляющий собой воду, разлитую в стеклянные или пластиковые бутылки для розничного распространения. Объём тары колеблется от 0,33-литровых бутылочек до 19-литровых бутылей для кулеров. Содержимое бутылок может представлять собой:
Критерии качества питьевой бутилированной воды[править | править код]
 Автомат разливает воду в бутылки равного объёма
Автомат разливает воду в бутылки равного объёмаВ отличие от столовых и минеральных вод, не имеющих чётких критериев отнесения вод к данной категории (кроме параметра общей минерализации), для питьевых бутилированных вод разработана нормативная документация, чётко регламентирующая состав и позволяющая классифицировать бутилированную воду как «Питьевую воду первой категории» и «Питьевую воду высшей категории».
В настоящее время в России основные требования по качеству и безопасности питьевой бутилированной воды определяются двумя нормативными документами:
- ГОСТ 32220-2013 «Питьевая вода, расфасованная в ёмкость»;
- СанПиН 2.1.4.1116-2002 «Питьевая вода. Гигиенические требования к качеству воды, расфасованной в ёмкости. Контроль качества»;
- [[Гл II Р 9. «Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю)», утверждённые решением Комиссии Таможенного союза от 28.05.2010 № 299]]
Согласно этим документам питьевая вода должна быть безопасна для потребления человеком по микробиологическим, паразитологическим и радиологическим показателям, безвредна по химическому составу, иметь благоприятные органолептические свойства. Соответствующая таким требованиям вода может потребляться человеком неограниченно на протяжении всей его жизни. В настоящее время оценку соответствия (сертификацию) питьевой воды проводят по 86 показателям безопасности (9 — критерии эстетических свойств, 55 — критерии безвредности химического состава, 2 — критерии радиационной безопасности, 11 — критерии эпидемической безопасности, 9 — критерии физиологической полноценности макро- и микроэлементного состава). По общему солесодержанию питьевая вода не должна превышать 1 г/дм³.
ГОСТ Р 52109-2003[править | править код]
19-литровые бутыли с водойДанный ГОСТ распространяется на питьевую воду, расфасованную в ёмкости и предназначенную для питьевых целей, а также для приготовления пищевых продуктов, в том числе детского питания, напитков, пищевого льда, и устанавливает общие технические условия производства, поставки, реализации и использования.
Согласно ГОСТ Р 52109-2003, расфасованную воду, в зависимости от качества водоподготовки, подразделяют на две категории:
- питьевая вода первой категории
- питьевая вода высшей категории — выдвигаются более жёсткие требования к процессу водоподготовки, химическому составу, органолептическим, радиологическим и другим показателям.
Прочие критерии отнесения воды к конкретной категории определяются СанПиН 2.1.4.1116-02 «Питьевая вода. Гигиенические требования к качеству воды, расфасованной в ёмкости. Контроль качества».
СанПиН 2.1.4.1116-2002[править | править код]
Данные санитарно-эпидемиологические правила и нормативы устанавливают гигиенические требования к качеству питьевой воды, расфасованной в ёмкости: бутылки, контейнеры, пакеты, предназначенной для питьевых целей и приготовления пищи, а также требования к организации контроля её качества.
 | Настоящие санитарные правила имеют целью обеспечить население высококачественной и оптимальной по содержанию биогенных элементов расфасованной водой для укрепления здоровья и предотвратить появление в торговой сети и специальных службах обеспечения (при чрезвычайных ситуациях) некачественных расфасованных вод, потребление которых может привести к нарушению здоровья населения.П.2.1 СанПиН |  |
СанПиН 2.1.4.1116-02 регламентирует:
- 8 критериев эстетических свойств питьевых вод
- 54 критерия химического состава
- 2 показателя радиационной безопасности
- 10 микробиологических и паразитологических показателей
- 9 нормативов характеризующих физиологическую полноценность макро- и микроэлементного состава расфасованной воды
Так же, данный СанПиН регламентирует 3 вида консервантов (среди которых присутствует наиболее популярный — диоксид углерода).
Ёмкости с бутилированной водой могут быть помечены как:
- «бутилированная»
- «питьевая»
- «артезианская»
- «минерализованная»
- «очищенная»
- «ключевая»
- «колодезная»
- «газированная».
Бутилированная вода также подразделяется на воду для персонального и хозяйственного употребления. Последняя, как правило, негазированная вода в ПЭТ бутылях (3 и более литров).
Бутилированная вода подразделяется на минеральную и питьевую.
Минеральная вода — это вода соответствующим образом зарегистрированного подземного источника (скважины) с сохранённым первоначальным составом минеральных веществ. Минеральные воды оказывают лечебный эффект, но при соблюдении ряда условий (определённой температуры, схемы приёма и, зачастую, немедленного потребления у источника). Пить минеральную воду литрами и считать это лечением — заблуждение, а иногда и вред. Лечиться водой можно и нужно, но желательно на курорте или, если вне курорта, то под обязательным контролем врача.
С осознанием этой проблемы, проведя маркетинговые исследования, производители бутилированной воды сегодня увеличивают предложение столовой и питьевой воды на рынке абсолютно безвредных по показателю минерализации, то есть упор в продвижении своего товара они делают на чистоту бутилированной воды в сравнении с проблемной водой из-под крана и лучшую «жаждоутоляемость» в противовес газированным напиткам. Средняя минерализация такой воды 0,1-0,35 г/л считается безопасной и рекомендована для повседневного потребления. При розливе природной воды по СанПиНам не допускается изменение состава добываемой воды. Если же производитель очищает воду с помощью оборудования, то ужесточаются требования именно к составу, а не к источнику. В любом случае оценить качество воды можно только с помощью химического и микробиологического анализа.
Розлив бутилированной воды производят при помощи специальных машин. Существуют как полуавтоматические устройства для розлива, так и комплексные полностью автоматические линии для розлива и упаковки готовой бутилированной продукции. В зависимости от требуемой производительности и количества использования ручного человеческого труда подбирают наиболее подходящий состав машин и аппаратов участка розлива.[1]
«Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю)», утверждённые решением Комиссии Таможенного союза от 28.05.2010 г.№ 299 Глава II Раздел 9. Требования к питьевой воде, расфасованной в ёмкости
Живая вода — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 апреля 2018; проверки требуют 55 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 апреля 2018; проверки требуют 55 правок.Жива́я вода́ — в народных сказках волшебная вода, обладающая способностью возвращать к жизни убитого героя[1].
В фольклоре означает воду, обладающую определёнными волшебными или сверхъестественными свойствами. Например, в сказках живая вода способна оживлять мёртвое тело. Зачастую используется наряду с мёртвой водой, которая обладает возможностью залечивать раны. В сказке братьев Гримм «Живая вода» глоток живой воды мог исцелить больного отца трёх королевичей. В волшебных сказках живая вода добывается «за морем».
Алишер Навои упоминает, что Искандер в конце своей жизни безуспешно пытался найти живую воду (оби хайат)[2].
Сказочное искание живой воды и вечной молодости оказалось близко христианскому учению о всеобщем воскрешении, вечной жизни и полном исцелении[3][4].
В переносном смысле может означать всё, что одухотворяет, благотворно действует, пробуждает интерес[5].
В Евангелии[править | править код]
В Библии «живая вода» является эпитетом вечной жизни[6]
Одно из первых упоминаний о живой воде имеется в Евангелии:
В последний же великий день праздника стоял Иисус и возгласил, говоря: кто жаждет, иди ко Мне и пей. Кто верует в Меня, у того, как сказано в Писании, из чрева потекут реки воды живой. Сие сказал Он о Духе, Которого имели принять верующие в Него.
Виноградная водка[править | править код]
Латинское выражение aqua vitae (букв. «вода жизни») обозначало этиловый спирт, полученный дистилляцией вина. Термин введён испанским врачём и алхимиком Арнольдом из Виллановы (ок. 1240—1311)[7]. От этого термина произошли названия алкогольных напитков аквавит (скандин.) и оковита (укр.)[8].
- ↑ МАС, 1981—1984.
- ↑ Стена Искандара, XXIII
- ↑ Неёлов Е. М. От волшебной сказки к литературе: фольклорная трансформация евангельской традиции в учении Н. Ф. Федорова о воскрешении // «Проблемы исторической поэтики», 1994 — С. 269
- ↑ Черноусова И. П. Фольклорно-языковая картина мира, представленная в диалоговой модели (на материале русской волшебной сказки) // Вестник Челябинского государственного университета, 2013 — С. 119
- ↑ Фёдоров, 2008.
- ↑ Живая вода // Вихлянцев В. П. Новый библейский словарь : к русской канонической Библии синодального перевода 1876 года — М.: Эдитус, 2016. — 561 с. — ISBN 978-5-00058-387-6
- ↑ Душенко К. В., Багриновский Г. Ю. Aqua vitae // Большой словарь латинских цитат и выражений / Под науч. ред. Д. О. Торшилова. — М.: Азбука-Аттикус, 2017. — С. 59. — 912 с.
- ↑ Оковитка // Толковый словарь живого великорусского языка : в 4 т. / авт.-сост. В. И. Даль. — 2-е изд. — СПб. : Типография М. О. Вольфа, 1880—1882.
- Живая вода // Фразеологический словарь русского литературного языка / Сост. А. И. Фёдоров. — М.: Астрель, АСТ, 2008.
Тритиевая вода — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 июня 2018; проверки требуют 5 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 июня 2018; проверки требуют 5 правок.Три́тиевая вода́ (сверхтяжёлая вода) — вода, в молекулах которой атомы протия (лёгкого водорода) замещены атомами трития (тяжёлого радиоактивного изотопа водорода). В чистой форме называется оксидом трития (T2O или 3H2O) или супертяжёлой водой. Из-за собственной радиоактивности чистый T2O имеет высокую коррозионную активность — при спонтанном бета-распаде трития в 3He происходит выделение атомарного кислорода. Кроме того из-за собственной радиоактивности происходит радиолиз воды с выделением трития и кислорода. Удельная объёмная активность тяжёлой воды составляет 2650 Ки/мл, поэтому она не может быть получена в больших количествах в неразбавленном виде. Тритиевая вода, участвуя в метаболизме почти одинаковым образом с обычной водой, обладает высокой радиотоксичностью.
Для T2O температура плавления — 274,70 К (+1,25 °C), тройная точка — 277,64 К (+4,49 °C), температура кипения +101,6 °C, плотность — 1,21459 г/см³[1]. В других источниках данные о температуре плавления и кипения несколько отличаются.[2]
Тритиевая вода (HTO) в следовых количествах содержится в обычной воде, однако распределение её неравномерно.
Тритиевую (сверхтяжёлую) воду не следует путать с дейтериевой (тяжёлой) водой.
Разновидности тритиевой воды HTO, DTO и Т2О применяются в качестве радиоактивных индикаторов влагонепроницаемости вещества.
Тритиевая вода также применяется как меченое соединение для исследования водного обмена. Кроме того, тритиевая вода используется как исходное вещество для синтеза других производных трития и для изотопного обмена атомов водорода.
- ↑ Тритий // Химическая энциклопедия. — Т. 5. — М.: Научное издательство «Большая Российская энциклопедия». — 1998.
- ↑ http://www.chemport.ru/chemical_substance_1311.html — «Физические величины» под ред. Григорьева И. С., Мейлихова Е. З., М.:Энергоатомиздат 1991 стр. 297

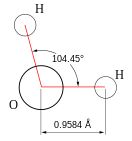
 (
(
 (
( документа Протокол № 9 заседания Специального комитета при Совнаркоме СССР. Москва, Кремль 30 ноября 1945 года в Викитеке
документа Протокол № 9 заседания Специального комитета при Совнаркоме СССР. Москва, Кремль 30 ноября 1945 года в Викитеке
Добавить комментарий