Формула жира в химии
Общая формула жиров
Природные жиры, как правило, являются смесью различных триглицеридов, а не индивидуальными веществами.
Схема образования типичного триглицерида:
Чаще всего в состав жиров входят остатки следующих кислот:
|
Насыщенные кислоты |
|
|---|---|
|
Пальмитиновая кислота C15H31COOH |
|
|
Стеариновая кислота C17H35COOH |
|
|
Ненасыщенные кислоты |
|
|
Линолевая кислота C17H31COOH |
|
|
Олеиновая кислота C17H33COOH содержит 1 двойную связь |
|
|
Линоленовая кислота C17H29COOH содержит 3 двойные связи |
|
В состав триглицерида могут входить неодинаковые кислотные остатки (что характерно и для природных жиров). Пример молекулы триглицерида, слева – глицерин, справа – радикалы жирных кислот: пальмитиновой кислоты, олеиновой кислоты, альфа-линолевой кислоты.
Твердые жиры состоят в основном из триглицеридов, содержащих преимущественно остатки насыщенных (предельных, твердых) кислот, жидкие – из триглицеридов, содержащих преимущественно остатки непредельных (ненасыщенных, жидких) кислот.
Жидкие жиры можно превратить в твердые с помощью реакции гидрогенизации:
Для жиров, как сложных эфиров, характерна реакция гидролиза. В присутствии минеральных кислот гидролиз протекает с образованием глицерина и соответствующих карбоновых кислот (обратимый процесс). При участии щелочей гидролиз идет до конца, в этом случае образуются мыла – соли жирных кислот и щелочных металлов:
Примеры решения задач по теме «формула жира»
| Понравился сайт? Расскажи друзьям! | |||
Жиры | CHEMEGE.RU
| Жиры – это сложные эфиры, образованные глицерином и высшими одноосновными карбоновыми кислотами (жирными кислотами). . |
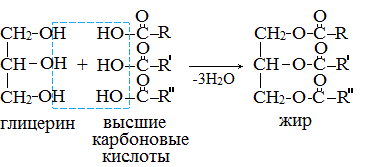
Жиры образуются при взаимодействии глицерина и высших карбоновых кислот:
| Жирные (высшие) кислоты | |
| Предельные кислоты | Непредельные кислоты |
| Масляная кислота С3Н7 -СООН | Олеиновая кислота С17Н33СООН (содержит одну двойную связь в радикале) СН3—(СН2)7—СН = СН—(СН2)7—СООН |
| Пальмитиновая кислота С15Н31 — СООН | Линолевая кислота С17Н31СООН (две двойные связи в радикале) СН3-(СН2)4-СН = СН-СН2-СН = СН-СООН |
| Стеариновая кислота С17Н35 — СООН | Линоленовая кислота С17Н29СООН (три двойные связи в радикале) СН3СН2СН=CHCH2CH=CHCH2CH=СН(СН2)4СООН |
Общее название жиров – триацилглицерины (триглицериды).
Существует несколько способов назвать молекулу жира.
Например, жир, образованный тремя остатками стеариновой кислоты, будет иметь следующие названия:
Жиры растворимы в органических растворителях и нерастворимы в воде. С водой жиры не смешиваются.
| Животные жиры — предельные | Растительные жиры (масла) — непредельные |
| Твёрдые, образованы предельными кислотами – стеариновой и пальмитиновой. Все животные жиры, кроме рыбьего – твёрдые. | Жидкие, образованы непредельными кислотами – олеиновой, линолевой и другими. Все растительные жиры, кроме пальмового масла – жидкие. |
1. Гидролиз (омыление) жиров
Жиры подвергаются гидролизу в кислой или щелочной среде или под действием ферментов.
1.1. Кислотный гидролиз
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
| Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин |
1.2. Щелочной гидролиз — омыление жиров
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
| Например, при гидролизе тристеарата глицерина гидроксидом натрия образуется стеарат натрия. |
2. Гидрирование (гидрогенизация) ненасыщенных жиров
Гидрогенизация жиров — это процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира.
При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
| Например, триолеат глицерина при гидрировании превращается в тристеарат глицерина: |
| Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее, какая масса йода может присоединиться по двойным связям к 100 г жира. |
3. Мыло и синтетические моющие средства
При щелочном гидролизе жиров образуются мыла – соли высших жирных кислот.
Стеарат натрия – твёрдое мыло.
Стеарат калия – жидкое мыло.
Моющая способность мыла зависит от жесткости воды. Оно хорошо мылится и стирает в мягкой воде, плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы Ca2+ и Mg2+ дают с высшими кислотами нерастворимые в воде соли.
| Например, тристеарат глицерина взаимодействует с сульфатом кальция |
Поэтому наряду с мылом используют синтетические моющие средства.
Их производят из других веществ, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты.
Спирт реагирует с серной кислотой с образованием алкилсульфата.
Далее алкилсульфат гидролизуется щелочью:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли этих веществ растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Поделиться ссылкой:
Жиры | Химия онлайн
Общее название таких соединений — триглицериды или триацилглицерины, где ацил — остаток карбоновой кислоты -C (O) R.
В состав природных триглицеридов входят остатки насыщенных (предельных) кислот (пальмитиновой C15H31COOH, стеариновой C17H35COOH) и ненасыщенных (непредельных) кислот (олеиновой C17H33COOH, линолевой C17H29COOH).
В состав молекул триглицеридов могут входить разнородные кислотные радикалы, но остаток глицерина является составной частью всех жиров:

Общая формула жиров (триглицеридов): 
где R1, R2, R3 – углеводородные радикалы высших карбоновых кислот.

Жиры содержатся во всех растениях и животных. Они представляют собой смеси (например, сливочное масло содержит около 20 остатков различных кислот, остальные жиры – по 5-8) полных сложных эфиров глицерина и не имеют четко выраженной температуры плавления.
Биологическая роль жиров
Жиры в природе
История открытия жиров
Классификация жиров
Номенклатура жиров
Физические свойства жиров
Незаменимые жирные кислоты
Получение жиров
Применение жиров
Сложные эфиры — номенклатура, получение, химические свойства. Жиры. Мыла » HimEge.ru
Важнейшими представителями сложных эфиров являются жиры.
Жиры – это сложные эфиры глицерина и высших одноатомных карбоновых кислот. Общее название таких соединений – триглицериды или триацилглицерины, где ацил – остаток карбоновой кислоты -C(O)R. В состав природных триглицеридов входят остатки насыщенных кислот (пальмитиновой C15H31COOH, стеариновой C17H35COOH) и ненасыщенных (олеиновой C17H33COOH, линолевой C17H31COOH). Высшие карбоновые кислоты, которые входят в состав жиров имеют всегда четное количество атомов углерода (С8 – С18) и неразветвленный углеводородный остаток. Природные жиры и масла – это смеси глицеридов высших карбоновых кислот.
Состав и строение жиров могут быть отражены общей формулой:
Этерификация — реакция образования сложных эфиров.
В состав жиров могут входить остатки как предельных, так и непредельных карбоновых кислот в различных сочетаниях.
В обычных условиях жиры, содержащие в своем составе остатки непредельных кислот, чаще всего бывают жидкими. Их называют маслами. В основном, это жиры растительного происхождения — льняное, конопляное, подсолнечное и другие масла (исключения пальмовое и кокосовое масла – твердые в обычных условиях). Реже встречаются жидкие жиры животного происхождения, например рыбий жир. Большинство природных жиров животного происхождения при обычных условиях – твердые (легкоплавкие) вещества и содержат в основном остатки предельных карбоновых кислот, например бараний жир.
Состав жиров определяет их физические и химические свойства.
Жиры нерастворимы в воде, не имеют четкой температуры плавления и значительно увеличиваются в объеме при плавлении.
Агрегатное состояние жиров твердое, это связано с тем, что в состав жиров входят остатки предельных кислот и молекулы жиров способны к плотной упаковке. В состав масел, входят остатки непредельных кислот в cis – конфигурации, следовательно плотная упаковка молекул невозможна, и агрегатное состояние – жидкое.
Жиры (масла) являются сложными эфирами и для них характерны реакции сложных эфиров.
Понятно, что для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Наиболее важная в практическом плане реакция – гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения маргарина — твердого жира из растительных масел. Условно этот процесс можно описать уравнением реакции:
Все жиры, как и другие сложные эфиры, подвергаются гидролизу:
Гидролиз сложных эфиров- обратимая реакция. Чтобы сместить равновесие в сторону образования продуктов гидролиза, его проводят в щелочной среде (в присутствие щелочей или Na2CO3). В этих условиях гидролиз жиров протекает обратимо, и приводит к образованию солей карбоновых кислот, которые называются мылами. Гидролиз жиров в щелочной среде называют омылением жиров.
При омылении жиров образуются глицерин и мыла – натриевые и калиевые соли высших карбоновых кислот:
Омыление – щелочной гидролиз жиров, получение мыла.
Мыла – смеси натриевых (калиевых) солей высших предельных карбоновых кислот (натриевое мыло – твердое, калиевое — жидкое).
Мыла являются поверхностно-активными веществами (сокращенно: ПАВами, детергентами). Моющее действие мыла связано с тем, что мыла эмульгируют жиры. Мыла образуют мицеллы с загрязняющими веществами (условно — это жиры с различными включениями).
Липофильная часть молекулы мыла растворяется в загрязняющем веществе, а гидрофильная часть оказывается на поверхности мицеллы. Мицеллы заряжены одноименно, следовательно отталкиваются, при этом загрязняющее вещество и вода превращается в эмульсию (практически – это грязная вода).
В воде также происходит гидролиз мыла, при этом создается щелочная среда.
Мыла нельзя использовать в жесткой и морской воде, так как образующиеся при этом стеараты кальция (магния) в воде нерастворимы.
Практическое пособие по химии
РАБОЧИЕ ТЕТРАДИ |
Продолжение. Начало см. в № 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 26,
28, 29, 30,
31, 32, 33,
34, 35, 36,
37, 38, 39,
40/2004
где R, R’ и R» – углеводородные радикалы высших
карбоновых (жирных) кислот, преимущественно от С3
до С17. Карбоновые кислоты могут быть различными,
но всегда нормального строения и, как правило, с
четным числом атомов углерода.
Жиры – главная составная часть жировых клеток
животных и растений – являются одним из
важнейших пищевых резервов организма. При
окислении жиров выделяется значительно больше
энергии, чем при окислении углеводов и белков.
Три наиболее распространенные в природе жирные
кислоты – это предельные кислоты: пальмитиновая
(С16), стеариновая (С18) – и
непредельная олеиновая (С18) кислота. У
большинства ненасыщенных жирных кислот,
входящих в состав жиров, масел и биологических
мембран, преобладающим является цисизомер,
трансизомер встречается редко. Чем выше степень
ненасыщенности жирной кислоты, тем ниже ее
температура плавления (табл. 16).
Таблица 16
Наиболее распространенные в биообъектах жирные кислоты
| Структурная формула | Название | Температура плавления, °С |
|---|---|---|
Насыщенные жирные кислоты |
||
| СН3(СН2)10СООН СН3(СН2)12СООН СН3(СН2)14СООН СН3(СН2)16СООН СН3(СН2)18СООН |
Лауриновая10 Миристиновая10 Пальмитиновая10 Стеариновая10 Арахиновая |
4410 5810 6310 7010 7710 |
Ненасыщенные жирные кислоты |
||
| СН3(СН2)5СН=СН(СН2)7СООН СН3(СН2)7СН=СН(СН2)7СООН СН3(СН2)4(СН=СНСН2)2(СН2)6СООН СН3СН2(СН=СНСН2)3(СН2)6СООН СН3(СН2)4(СН=СНСН2)4(СН2)2СООН |
Пальмитин-олеиновая10 Олеиновая10 Линолевая10 Линоленовая10 Арахидоновая |
–110 1610 –510 –1110 –4910 |
Названия жиров. Природные жиры (триацилглицерины) являются триэфирами глицерина и жирных кислот. Обычное название этих соединений – триглицериды. Известны не только глицериды одинаковых кислот (простые глицериды), но и преимущественно разных кислот (смешанные глицериды). Например:
Животные жиры содержат главным образом глицериды предельных кислот и являются твердыми веществами. Растительные жиры, часто называемые маслами, содержат глицериды непредельных карбоновых кислот. Это, например, жидкие подсолнечное, конопляное и льняное масла.
|
Химические свойства жиров
Жиры под влиянием ферментов или в присутствии кислотных катализаторов гидролизуются с образованием глицерина и карбоновых кислот:
Гидролиз жиров в щелочной среде дает глицерин и растворимые соли карбоновых кислот:
В результате окисления жиров наряду с освобождением энергии образуется довольно много воды. При недостатке питьевой воды это позволяет легче переносить жажду:
Гидрирование жиров – превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Так в промышленности получают маргарин:
Задача. Напишите структурные формулы всех возможных триглицеридов, образованных остатками (по одному) олеиновой, пальмитиновой и стеариновой кислот.
Решение
Возможны три варианта, различающиеся расположением остатков названных кислот при центральном атоме С-2 глицерина:
УПРАЖНЕНИЯ
1. 2-Олеил-1,3-дистеарилглицерин, содержащийся в кокосовом масле, гидрируют (Н2, Pt) по двойной связи в тристеарин. Напишите уравнение реакции гидрирования. Укажите, какому веществу соответствует температура плавления +43 °С и какому +72 °С.
2. Дайте названия жирам, образованным
глицерином и: а) линолевой кислотой;
б) пальмитин-олеиновой кислотой; в) комбинацией
этих двух кислот. Приведите их структурные
формулы.
3. Какие жирные кислоты образуются при гидролизе 2-линолеил-1,3-диолеилглицерина? Какой другой триацилглицерин дает такие же жирные кислоты и в той же пропорции? Составьте уравнение реакции гидролиза одного из этих жиров.
4. Напишите две возможные формулы жира, имеющего в молекуле 57 атомов углерода и вступающего в реакцию с бромом в мольном соотношении 1:2.
5. При сгорании 1 моль жира образуется 57 моль углекислого газа и 54 моль воды. Напишите две возможные формулы жира, образованного кислотами с четным числом углеродных атомов.
6. Образец жира может вступить в реакцию с 0,4 моль водорода. Продукт гидрирования вступает в реакцию гидролиза с 0,6 моль NaOH, при этом образуется соль только одной кислоты, масса соли равна 183,6 г. Вычислите относительную молекулярную массу жира и приведите одну из возможных его формул.
7. Образец жира вступает в реакцию кислотного гидролиза. Масса продуктов гидролиза на 2,7 г больше массы исходного жира. В результате гидролиза образовалась только одна кислота массой 38,4 г. Вычислите молекулярную масcу жира и приведите одну из возможных его формул.
1.
2.
3.
Другой возможный триацилглицерин:
4. Углеродный состав молекулы жира складывается из трех атомов С глицерина и трех остатков карбоновых кислот Сх, Су, Сz. Причем 3 + х + у + z = 57. Если х = у = z, то 3х = 54, х = 18, или в молекуле кислотной компоненты жира 18 атомов С. Кроме того, в формуле жира должны содержаться две двойные связи:
5. Поскольку из 1 моль жира образуется 57
моль СО2, в молекуле этого жира 57 атомов С
(ср. с упражнением 4). Число атомов Н в формуле
жира: 2•54 = 108. За вычетом 5 атомов Н остатка
глицерина на три остатка кислоты приходится 103
атома Н: 35 + 35 + 33 и др.
Две возможные формулы жира:
6. При гидролизе жиров на связывание
образующихся кислот в виде солей расходуется
трехкратное мольное количество щелочи. Поэтому (жира) = 1/3(NaOH) = 0,2 моль.
Расход водорода в реакции гидрирования: (Н2) = 0,4 моль –
свидетельствует о том, что в молекуле жира
имеется две двойные связи. Количество вещества
соли, образующейся при гидролизе, (СnH2n+1COONa) = 0,6
моль, ее масса m(соли) = 183,6 г.
Молярная масса соли:
М(соли) = m/ = 183,6/0,6 = 306 г/моль.
Подставим значения атомных масс элементов в общую формулу соли СnH2n+1COONa (сумма Аr элементов формулы равна Мr(соли)) и найдем n:
12n + 2n + 1 + 44 + 23 = 306, 14n = 238, n = 17.
Возможная формула жира:
7. Прибавка по массе продуктов
гидролиза обусловлена присоединившейся водой.
Причем количество вещества воды (в моль) в три
раза больше количества вещества гидролизуемого
жира: (Н2О) = 3(жира).
А вот количества веществ гидролизной воды и
образующейся кислоты одинаковы:
(Н2О) = (RCOOH).
Проведем необходимые расчеты:
(Н2О) = m/M = 2,7/18 = 0,15 моль;
М(RCOOH) = 38,4/0,15 = 256 г/моль, R = С15Н31;
М(жира) = 3М(С15Н31СООН) + М(глицерина) – 3М(Н2О) = = 3•256 + 92 – 54 = 806 г/моль.
Формула жира:
Ответы@Mail.Ru: формула жира
Жиры — органические соединения, представляющие собой сложные эфиры трехатомного спирта глицерина и высших или средних жирных кислот. Срдержится во всех животных и растительных тканях. Общую формулу жиров можно записать так: О ? Ch3 — O — C — R О ? CH — O — C — R1 О ?’ Ch3 — O — C — R2 Все природные жиры — смесь глицеридов, не только симметричных, т. е. с тремя одинаковыми остатками жирных кислот, но и смешанных. Симметричные глицериды встречаются чаще в растительных маслах. Животные жиры отличаются весьма разнообразным составом жирных кислот. Жирные кислоты, входящие в состав триглициридов, определяют их свойства. Триглицириды способны вступать во все химические реакции, свойственные эфирам. Наибольшее значение имеет реакция омыления, в результате которой из триглицирида образуется глицерин и жирные кислоты. O Ch3-O-C-R O Ch3OH CH-O-C-R + 3 h3O = CHOH + 3 R COOH O Ch3OH жирная кислота Ch3-O-C-R глицерин триглицирид Омыление происходит как при гидролизе, так и при действии кислот или щелочей.
<img src=»//content.foto.my.mail.ru/mail/dmitrikorneev/_answers/i-1477.jpg» > Жиры, или триглицериды — природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот; входят в класс липидов. Наряду с углеводами и белками, жиры — один из главных компонентов клеток животных, растений и микроорганизмов. Жидкие жиры растительного происхождения обычно называют маслами — так же, как и сливочное масло. Природные жиры содержат в своём составе три кислотных радикала, имеющих неразветвлённую структуру и, как правило, чётное число атомов углерода (содержание «нечетных» кислотных радикалов в жирах обычно менее 0,1 %). Жиры гидрофобны, практически нерастворимы в воде, хорошо растворимы в органических растворителях и обычно плохо растворимы в спирте.
Физические свойства жиров | Химия онлайн
По агрегатному состоянию при комнатной температуре жиры (смеси триглицеридов) – твердые, мазеобразные или жидкие вещества. Агрегатное состояние жиров определяется природой жирных кислот.
Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение — рыбий жир). Они состоят главным образом из триглицеридов насыщенных (предельных) карбоновых кислот.
Растительные жиры — масла (подсолнечное, соевое, хлопковое и др.) — жидкости (исключение — кокосовое масло, масло какао-бобов). В состав триглицеридов масел входят остатки ненасыщенных (непредельных) карбоновых кислот.
Все жиры легче воды и практически не растворимы в воде, но при добавлении мыла или других поверхностно-активных веществ (эмульгаторов), они способны образовывать стойкие водные эмульсии. Жиры ограниченно растворимы в спирте и хорошо растворимы во многих неполярных и малополярных растворителях – эфире, бензоле, хлороформе, бензине.
Жиры не имеют четкой температуры плавления (т.е. плавятся в некотором диапазоне температур). Определенной температурой плавления характеризуются лишь индивидуальные триглицериды.
Температура плавления жира тем выше, чем больше в нем содержание предельных кислот. Она также зависит от длины углеводородной цепи жирной кислоты, температура плавления увеличивается с ростом длины углеводородного радикала.
Причиной снижения температуры плавления триглицеридов с остатками ненасыщенных кислот является наличие в них двойных связей с цис-конфигурацией. Это приводит к существенному изгибу углеродной цепи, нарушающему упорядоченную (параллельную) укладку длинноцепных радикалов кислот.
Сравним пространственное строение ненасыщенной и насыщенной и кислот с равным числом углеродных атомов в цепи: олеиновой C17H33COOH и стеариновой C17H35COOH.
На молекулярной модели олеиновой кислоты виден изгиб цепи по связи С=С, препятствующий плотной упаковке молекул.
В углеродной цепи стеариновой кислоты отсутствуют изгибы, поэтому ее молекулы способны к плотной параллельной укладке.
Чем плотнее упаковка молекул вещества, тем выше температуры его фазовых переходов (т.плав., т.кип.). Соответственно, температура плавления тристеарата глицерина (71 oC) существенно больше, чем у триолеата (–17 oC).
Видеоопыт «Определение непредельности жиров»
Жиры

Добавить комментарий