Простетическая группа — это… Что такое Простетическая группа?
 | В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 16 июня 2012. |
Простетическая группа — небелковый (и не производный от аминокислот) компонент, связанный с белком, который выполняет важную роль в биологической активности соответствующего белка. Простетические группы могут быть органическими (витамины, углеводы, липиды) или неорганическими (например, ионы металлов).
Простетические группы прочно связаны с белками и даже могут быть присоединены ковалентными связями. Часто играют важную роль в функционировании ферментов. Белок без простетической группы называется «апобелок
Примером может являться гем, который является простетической группой в молекуле гемоглобина.
Простетические группы — это подкласс кофакторов. Они отличаются от коферментов тем, что простетические группы постоянно связаны с ферментами, в то время как коферменты связаны с ферментами непостоянно.
 Коферменты Коферменты | |
|---|---|
| Коферменты | витамины: NAD, NADP (B3) · Кофермент A · Тетрагидрофолат (B9), Дигидрофолат, Метилентетрагидрофолат · Аскорбиновая кислота (C) · Витамин К · Кофермент F420 |
| Органические простетические группы | витамины: Тиаминпирофосфат (B1) · FMN, FAD (B2) · Пиридоксальфосфат (B6) · Биотин (H, B7) · Метилкобаламин, Кобамамид) |
| Металлы — простетические группы | Ca2+ · Cu2+ · Fe2+, Fe3+ · Mg2+ · Mn2+ · Mo · Ni2+ · Se · Zn2+ |
— транспортные формы — Биохимия
Поскольку липиды являются в основе своей гидрофобными молекулами, то они транспортируются в водной фазе крови в составе особых частиц – липопротеинов.
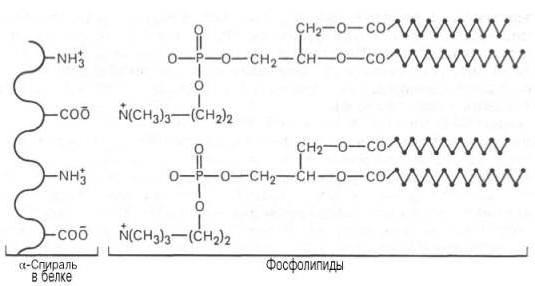
Структуру транспортных липопротеинов можно сравнить с орехом, у которых имеется скорлупа и ядро. «Скорлупа» липопротеина является гидрофильной, ядро – гидрофобное.
- поверхностный гидрофильный слой формируют
- «ядро» формируют неполярные эфиры холестерола (ХС) и триацилглицеролы (ТАГ), которые и являются транспортируемыми жирами. Их соотношение колеблется в разных типах липопротеинов. Также к центру обращены жирнокислотные остатки фосфолипидов и циклическая часть холестерола.
Схема строения любого транспортного липопротеина
Выделяют четыре основных класса липопротеинов:
- липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП),
- липопротеины низкой плотности (ЛПНП, β-липопротеины, β-ЛП),
- липопротеины очень низкой плотности (ЛПОНП, пре-β-липопротеины, пре-β-ЛП),
- хиломикроны (ХМ).
Свойства и функции липопротеинов разных классов зависят от их состава, т.е. от вида присутствующих белков и от соотношения триацилглицеролов, холестерола и его эфиров, фосфолипидов.
Cравнение размера и свойств липопротеинов
Функции липопротеинов
Функциями липопротеинов крови являются
1. Перенос к клеткам тканей и органов
- насыщенных и мононенасыщенных жирных кислот в составе триацилглицеролов для последующего депонирования или использования в качестве энергетических субстратов,
- полиненасыщенных жирных кислот в составе эфиров холестерола для использования клетками в синтезе фосфолипидов или образования эйкозаноидов,
- холестерола в качестве мембранного материала,
- фосфолипидов в качестве мембранного материала,
Хиломикроны и ЛПОНП ответственны, в первую очередь, за транспорт жирных кислот в составе ТАГ. Липопротеины высокой и низкой плотности – за транспорт свободного холестерола и жирных кислот в составе его эфиров. ЛПВП способны также отдавать клеткам часть своей фосфолипидной оболочки.
2. Удаление избытка холестерола с мембран клеток.
3. Транспорт жирорастворимых витаминов.
4. Перенос стероидных гормонов (наряду со специфическими транспортными белками).
Апобелки липопротеинов
Белки в липопротеинах обычно называются апобелками, выделяют несколько их типов – А, В, С, D, Е. В каждом классе липопротеинов находятся соответствующие ему апобелки, выполняющие свою собственную функцию:
1. Структурная функция («стационарные» белки) – связывают липиды и формируют белок-липидные комплексы:
- апоВ-48 – присоединяет триациллицеролы,
- апоВ-100 – связывает как триацилглицеролы, так и эфиры холестерина,
- апоА-I – акцептирует фосфолипиды,
- апоА-IV – связывается с холестеролом.
2. Кофакторная функция («динамические
» белки) – влияют на активность ферментов метаболизма липопротеинов в крови:- апоС-II — кофактор гепаринзависимой липопротеинлипазы,
- апоС-III – кофактор печеночной ТАГ-липазы и ингибитор липопротеинлипазы,
- апоА-I, апоА-II и апоС-I – кофакторы лецитин-холестерол-ацилтрансферазы,
- апоЕ – ингибитор липопротеинлипазы.
3. Векторная функция (белки-маркеры, стационарные) – обеспечивают направленный транспорт липопротеинов:
- апоВ-48, апоВ-100 и апоА-I – связываются со своими рецепторами клеток-мишеней,
- апоЕ помогает взаимодействию векторных апобелков с рецепторами.
Названия апобелков B-48 и B-100 возникли не случайно. Длина мРНК гена апоВ равна 14 тысяч оснований и молекулярная масса «целого 100%-го» белка апоB-100 составляет 512 кДа. В мРНК имеется глутаминовый кодон СAA, который в результате процессинга мРНК превращается в терминирующий кодон UAA (стоп-кодон). В результате трансляции этой мРНК образуется укороченный апоB – апоВ-48 (241 кДа), который содержит N-концевые аминокислотные остатки апоВ-100.
Простетическая группа – это небелковый компонент сложных веществ
Простетическая группа – это непептидный компонент сложных белков, который обеспечивает выполнение их биологических функций. Чаще всего говорят о простетических группах ферментов. Простетические группы прочно соединены с белковой частью ковалентными связями. Они могут быть веществами неорганической (ионы металлов) и органической (углеводы, витамины) природы.
Простетические группы белков
Сложные белки классифицируются в зависимости от строения простетической группы. Выделяют следующие классы сложных белков:
- Гликопротеины: истинные и протеогликаны. Простетические группы первых представлены моносахаридами, дезоксисахаридами, сиаловыми кислотами, олигосахаридами. К истинным гликопротеинам относятся все глобулины плазмы крови, иммуноглобулины, интерфероны, фибриноген, гормоны кортикотропин, гонадотропин. Простетическая группа протеогликанов представлена высокомолеклярными гетерополисахаридами – гликозаминогликанами. Примеры углеводов – гиалуроновая кислота, хондроитиновая кислота, гепарин. Углеводная часть соединяется с белковой ковалентно-гликозидной связью за счет гидроксильной группы треонина, серина или аминогруппы лизина, глутамина, аспарагина.
- Липопротеины. Простетической группой являются липиды различного состава. Белковая часть может соединяться с липидной ковалентными связями, тогда формируются нерастворимые липопротеины, выполняющие в основном структурные функции; и нековалентными связями, тогда образуются растворимые липиды, выполняющие в основном транспортные функции. Белки (апопротеины) растворимых липопротеинов формируют поверхностный гидрофильный слой, липиды – гидрофобное ядро, в котором находятся транспортируемые вещества липидной природы. К растворимым липопротеинам относятся все липопротеиновые комплексы, которые представляют собой скорее конгломераты белков и липидов переменного состава.
- Фосфопротеины. Простетическая группа – это ортофосфорная кислота. Ее остаток соединяется с белковой частью сложноэфирными связями за счет гидроксогрупп серина и треонина. К фосфопротеинам относится казеин, вителлин, овальбумин.
- Металлопротеины. К ним относится более ста ферментов. Простетическая группа представлена ионом одного или нескольких разных металлов. Например, в состав трансферрина и ферритина входят ионы железа, алкогольдегидрогеназы – цинка, цитохромоксидазы – меди, протеиназ – ионы магния и калия, АТФ-азы – ионы натрия, магния, кальция и калия.
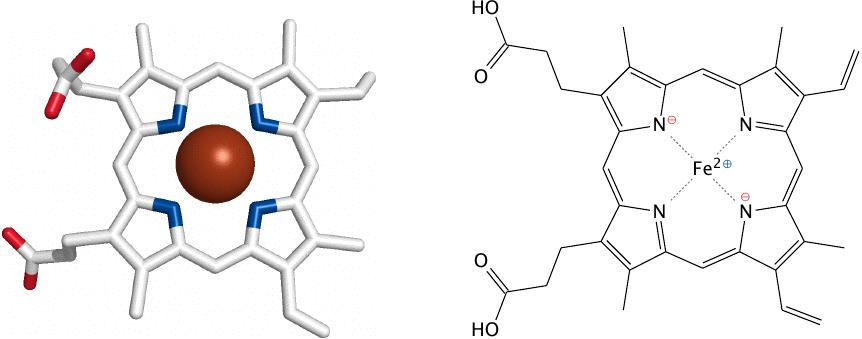
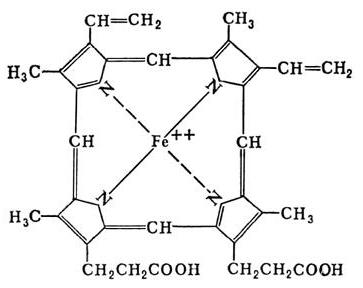
- Хромопротеины имеют окрашенную простетическую группу. У человека и высших животных представлены в основном гемопротеинами и флавопротеинами. Небелковой частью гемопротеинов является гем. Гем входит в состав гемоглобина, миоглобина, цитохромов, каталаз, пероксидаз. Простетической группой флавопротеинов является ФАД.
6. Нуклеопротеины. Простетическая группа – это нуклеиновые кислоты – ДНК или РНК. Белковая часть нуклеопротеинов содержит много положительно-заряженных аминокислот – лизина и аргинина, поэтому имеет основные свойства. Сами нуклеиновые кислоты обладают кислыми свойствами. Взаимодействие между белковой и небелковой частью осуществляется, таким образом, за счет ион-ионного взаимодействия. Присоединение основной белковой части к довольно «рыхлой» кислой молекуле ДНК позволяет получить компактную структуру – хроматин, которая обеспечивает хранение наследственной информации.
Простетические группы ферментов
Около 60% известных ферментов являются простыми веществами. Их активный центр сформирован только из аминокислот. В этом случае связь фермент-субстрат осуществляется за счет кислотно-основного взаимодействия. Для протекания ряда реакций в организме такого простого взаимодействия недостаточно. Тогда в реакции участвуют не только субстрат и фермент, но и другие соединения небелковой природы, которые называют кофакторами. Различают два подкласса кофакторов: коферменты и простетические группы. Первые соединены с белковой частью фермента слабыми нековалентными связями, благодаря чему могут выполнять функцию переносчиков между отдельными ферментами. Простетические группы прочно соединены ковалентными связями с апоферментом и выполняют функцию внутриферментного переносчика. Примеры простетических групп некоторых ферментов представлены в таблице.
| Таблица. Простетические группы, их источники синтеза и соответствующие ферменты | ||
| Простетическая группа | Источник синтеза | Примеры ферментов |
| FAD, FMN | Рибофлавин | Аэробные и некоторые анаэробные дегидрогеназы |
| Пиридоксальфосфат | Пиридоксин | Аминотрансферазы, декарбоксилазы |
| Тиаминпирофосфат | Тиамин | Декарбоксилазы, трансферазы |
| Биотин | Биотин | Карбоксилазы |
| Гем | Глицин, сукцинат, ферритин | Цитохромы, гемоглобины, миоглобин, каталазы, пероксидазы |
Простетические группы липидов
В этом случае простетическая группа – это нелипидная часть сложных липидов, например, фосфолипидов, гликолипидов, сульфолипидов.
Простетическая группа
Простетическая группа, prosthetic group – это небелковый (неаминокислотный) компонент сложных белков, необходимый для биологической активности белка [1]. Простетическая группа может быть как органическим соединением ( витамином [2], углеводом [3] или липидом [4]), так и неорганическим (ионом металла). Простетические группы тесно связаны с белками, обычно ковалентными связями [5], часто необходимы для функционирования ферментов [6].
Белок без характерной для него простетической группы называется аполипопротеином [7], белок с характерной
простетической группой – голопротеином [8] (соответственно, в случае ферментов – апоферментом и холоферментом).Простетические группы – подкласс кофакторов, отличающихся от ферментов постоянной связью с белком (в то время как у коферментов связь временная). В ферментах, простетические группы обычно вовлечены в активные участки.
Одним из примеров простетической группы является гем [9] в составе гемоглобина [10]. Другие примеры органических простетических групп – производные витаминов: тиамин (витамин B1), пирофосфат тиамина, пиридоксаль-фосфат и биотин. Именно из-за включения витаминов B, в качестве простетической группы, витамины так необходимы в рационе питания человека.
Неорганические простетические группы обычно являются ионами переходных металлов, например железа (в составе гема, например, в составе цитохром-c-оксидазы и гемоглобина), цинка (в составе углеродистой ангидразы), магния (в составе отдельных киназ) и молибдена (в составе нитратной редуктазы).
Примечания
Примечания и пояснения к статье «Простетическая группа».
При написании статьи о простетических группах, в качестве источников использовались материалы информационных и справочных интернет-порталов, сайтов новостей NCBI.NLM.NIH.gov, ProteinStructures.com, ScienceDaily.com, FEN.NSU.ru, Википедия, а также следующие печатные издания:
- Гауровиц Ф. «Химия и функции белков». Издательство «Мир», 1965 год, Москва,
- Скальный А. В., Рудаков И. А. «Биоэлементы в медицине» Издательство «Оникс», 2004 год, Москва,
- Степанов В. М. «Молекулярная биология. Структура и функции белков. Классический университетский учебник». Издательство «Издательство Московского государственного университета», 2005 год, Москва,
- Коничев А. С., Севастьянова Г. А. «Молекулярная биология. Высшее профессиональное образование». Издательство «Академия», 2008 год, Москва .
Апобелок — Справочник химика 21
С молибденом в организме может конкурировать вольфрам. Так, у крыс, получающих с пищей вольфрам в количестве 100 ч. на млн., образуется вольфрамсодержащая сульфитоксидаза, которая уже неспособна нормально функционировать. Однако при этом в еще больших количествах накапливается не содержащий металла апобелок. У этих крыс образуется также и неактивная, не содержащая металла ксантиноксидаза . Очевидно, вольфрам каким-то образом препятствует включению молибдена в молекулы ферментов. Большая часть молибдена в азотфиксирующих бактериях Azotoba ter находится в специальном белке, предназначенном для накопления молибдена. [c.86]Классификация по форме молекул была уже рассмотрена, остановимся несколько подробнее на классификации по степени сложности. По этому принципу белки делят на протеины (простые белки), состоящие только из остатков аминокислот, и протеиды (сложные белки), состоящие из белковой (апобелок) и небелковой частей (простетическая группа).
Необходимым компонентом при образовании хиломикронов и ЛПОНП является апобелок В. При редком заболевании абеталипопротеинемии апопро-теин В не синтезируется и соответственно не образуются липопротеины, в состав которых входит этот апобелок в результате в клетках кишечника и печени накапливаются капельки липидов. [c.262]
Как фосфолипиды, так и апобелок С-11 являются кофакторами липопротеинлипазы. Аро-С-П имеет специфический участок связывания фосфолипидов, которым он присоединяется к липопрбтеину. Таким образом, хиломикроны и ЛПОНП обеспечивают фермент, катализирующий их метаболизм, как субстратом, так и кофакторами. Гидролиз триацилглицеролов происходит при контакте липопротеинов с ферментом, связанным с эндотелием. В процессе гидролиза триацилглицерол превращается сначала [c.263]
В живых организмах протекают различные химические реакции среди которых следует вьщелить окислительно-восстанови-тельные, продуктами этих реакций являются свободные радикалы. Для защиты от разрушительного действия свободных радикалов организмы используют компоненты антиоксидантной защиты в составе которых пероксидаза. Фермент способен катализировать оксидазные, оксигеназные и пероксидазные реакции. Сложное строение пероксидазы полипептидная цепь, гемин, кальций и поверхностные моносахариды, последние защищают апобелок от разрушительного действия свободных радикалов. При этом моносахариды располагаются вдалеке от активного центра и не влияют на каталитические свойства пероксидазы, но способны ориентировать фермент в мембранных структурах клетки и ее органелл. Как представитель гемсодержащих белков, пероксидаза способна катализировать реакции с участием перекиси водорода, восстанавливая последнюю до воды и при этом окисляя различные неорганические и органические соединения. Продуктами ферментативной реакции могут быть свободные радикалы или фермент-субстратный радикальный комплекс, эффективно окисляющий даже медленно окисляемые в индивидуальных реакциях субстраты. Для выполнения разнообразных каталитических функций на поверхности холофермента располагается протяженная субстратсвязывающая площадка, представленная двумя участками, где могут связываться субстраты гидрофобной и гидрофильной природы. Причем в месте локализации гидрофобных субстратов проявляется карбоксильная группа, модификация которой замедляет протекание каталитического процесса. рК этой группы может колебаться в пределах 4,5—5,5. [c.208]
Апофермент (апобелок)—белок, для проявления активности которого требуется простетическая группа. [c.540]
Липопротеины
26
Липиды 200401ХИМИЯ И ОБМЕН ЛИПИДОВ.
ЛИПИДЫ — органические вещества, характерные для живых организмов, нерастворимые в воде, но растворимые в органических растворителях и друг в друге.
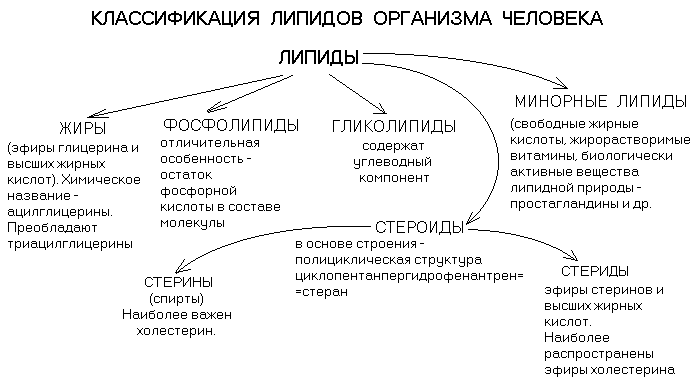
Группы липидов отличаются по степени гидрофобности. Фосфолипиды и гликолипиды являются полярными липидами.
Холестерин занимает промежуточное положение между полярными и абсолютно гидрофобными липидами.
Абсолютно гидрофобными являются триглицериды и эфиры холестерина.
Большинство липидов (кроме стеринов и некоторых минорных липидов) содержат высшие жирные кислоты (ВЖК).
В состав мембран входят только ФОСФОЛИПИДЫ (ФЛ), ГЛИКОЛИПИДЫ (ГЛ) и ХОЛЕСТЕРИН (ХС).
ЖИРНЫЕ КИСЛОТЫ, ХАРАКТЕРНЫЕ ДЛЯ ОРГАНИЗМА ЧЕЛОВЕКА
Кислота называется жирной, если число углеродных атомов в ее молекуле больше четырех. Преобладают длинноцепочечные жирные кислоты (число атомов углерода 16 и выше). Количество углеродных атомов и двойных связей обозначается двойным индексом. Например: С18:1 (9-10). В данном случае 18 – число атомов углерода и 1 – количество двойных связей. В скобках указывается местоположение двойных связей (по номерам углеродных атомов).
Студенты должны знать количество углеродных атомов и двойных связей в молекулах следующих жирных кислот:
С16:0 — пальмитиновая,
С18:0 — стеариновая,
С18:1 – олеиновая (9:10),
С18:2 – линолевая (9-10,12-13),
С18:3 — линоленовая (9-10, 12-13, 15-16),
С20:4 — арахидоновая (5-6, 8-9, 12-13, 15-16).
Жирные кислоты, имеющие двойную связь в положении 3, обладают очень выраженным антиатеросклеротическим действием (линоленовая). Особенно много 3-содержащих жирных кислот находится в рыбьем жире и других морепродуктах. В организме человека такие жирные кислоты не синтезируются.
Жирные кислоты, входящие в состав организма человека, имеют общие черты строения:
Чётное число атомов углерода.
Линейная (неразветвлённая) углеродная цепь.
Полиненасыщенные жирные кислоты имеют ТОЛЬКО ИЗОЛИРОВАННЫЕ двойные связи (между соседними двойными связями не меньше двух одинарных).
Двойные связи имеют только цис-конфигурацию.
По количеству двойных связей жирные кислоты можно разделить на НАСЫЩЕННЫЕ (нет двойных связей), МОНОНЕНАСЫЩЕННЫЕ (есть одна двойная связь) и ПОЛИНЕНАСЫЩЕННЫЕ (две или более двойных связей).
Свободные жирные кислоты встречаются в очень небольшом количестве. В основном они находятся в составе других липидов. При этом они связаны с другими компонентами липидов сложноэфирной связью (эстерифицированы).
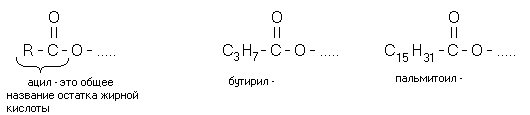
ФОРМЫ СУЩЕСТВОВАНИЯ ЛИПИДОВ В ОРГАНИЗМЕ ЧЕЛОВЕКА
Жировые включения, которых больше всего в адипоцитах. Это форма существования триглицеридов.
Биомембраны. Они не содержат триглицеридов, зато в них присутствуют фосфолипиды, гликолипиды и холестерин.
Липопротеины. Могут включать в себя липиды всех классов.
Липопротеины — это сферические частицы, в которых можно выделить гидрофобную сердцевину, состоящую из триглицеридов (ТРГ) и эфиров холестерина (ЭХС), и амфифильную оболочку, в составе которой – фосфолипиды, гликолипиды и белки.

Белки оболочки называются апобелками. Холестерин (ХС) обычно занимает промежуточное положение между оболочкой и сердцевиной. Компоненты частицы связаны слабыми типами связей и находятся в состоянии постоянной диффузии – способны перемещаться друг относительно друга.
Основная роль липопротеинов – транспорт липидов, поэтому обнаружить их можно в биологических жидкостях.
При изучении липидов плазмы крови оказалось, что их можно разделить на группы, так как они отличаются друг от друга по соотношению компонентов. У разных липопротеинов наблюдается различное соотношение липидов и белка в составе частицы, поэтому различна и плотность.
Липопротеины разделяют по плотности методом ультрацентрифугирования, при этом они не осаждаются, а всплывают (флотируют). Мерой всплывания является константа флотации, обозначаемая Sf (сведберг флотации). В соответствии с этим показателем различают следующие группы липопротеинов:

Липопротеины можно разделить и методом электрофореза. При классическом щелочном электрофорезе разные липопротеины ведут себя по-разному. При помещении липопротеинов в электрическое поле хиломикроны остаются на старте. ЛОНП и ЛПП можно обнаружить во фракции пре-глобулинов, ЛНП — во фракции -глобулинов, а ЛВП — -глобулинов:

Определение липопротеинового спектра плазмы крови применяется в медицине для диагностики атеросклероза.
Все эти липопротеины отличаются по своей функции.
1. Хиломикроны (ХМ) — образуются в клетках кишечника, их функция: перенос экзогенного жира из кишечника в ткани (в основном — в жировую ткань), а также — транспорт экзогенного холестерина из кишечника в печень.
2. Липопротеины Очень Низкой Плотности (ЛОНП) — образуются в печени, их роль: транспорт эндогенного жира, синтезированного в печени из углеводов, в жировую ткань.
3. Липопротеины Низкой Плотности (ЛНП) — образуются в кровеносном русле из ЛОНП через стадию образования Липопротеинов Промежуточной Плотности (ЛПП). Их роль: транспорт эндогенного холестерина в ткани.
4. Липопротеины Высокой Плотности (ЛВП) — образуются в печени, основная роль — транспорт холестерина из тканей в печень, то есть удаление холестерина из тканей, а дальше холестерин выводится с желчью.
При определении содержания в крови липопротеинов различной плотности их обычно разделяют методом электрофореза. При этом ХМ остаются на старте, ЛОНП оказываются во фракции пре-глобулинов, ЛНП и ЛПП находят во фракции -глобулинов, а ЛВП — 2-глобулинов. Если в крови повышено содержание -глобулинов (ЛНП) — это означает, что холестерин откладывается в тканях (развивается атеросклероз).
РОЛЬ АПОБЕЛКОВ В СОСТАВЕ ЛИПОПРОТЕИНОВ
Белковые компоненты липопротеинов особенно важны. Они называются «аполипопротеинами» и обозначаются латинскими буквами (апоА, апоВ, апоС и так до апоG).
ФУНКЦИИ АПОБЕЛКОВ.
1. Апобелки выполняют функцию эмульгаторов, потому что являются амфифильными веществами.
2. Некоторые из аполипопротеинов являются регуляторами активности ферментов липидного обмена.
3. Могут обладать собственной ферментативной активностью.
Могут выступать в качестве лигандов клеточных рецепторов для липопротеинов.
Многие апобелки осуществляют транспорт липидов из одного липопротеина в другой.
ОБМЕН ЖИРА (ТРИАЦИЛГЛИЦЕРИНА)
Химическое название жиров — ацилглицерины, то есть жиры. Это сложные эфиры глицерина и высших жирных кислот. «Ацил-» — это означает «остаток жирных кислот» (не путать с «ацетил-» — остатком уксусной кислоты). В зависимости от количества ацильных радикалов жиры разделяются на моно-, ди- и триглицериды. Если в составе молекулы 2 радикала жирных кислот, то жир называется ДИАЦИЛГЛИЦЕРИНОМ. Если в составе молекулы 1 радикал жирных кислот, то жир называется МОНОАЦИЛГЛИЦЕРИНОМ.
В организме человека и животных преобладают ТРИАЦИЛГЛИЦЕРИНЫ (содержат три радикала жирных кислот).

Свойства жира определяются составом жирных кислот.
Функции жира:
1. ЭНЕРГЕТИЧЕСКАЯ.
В отличие от углеводов жиры составляют энергетический резерв организма. Преимущество жира в качестве энергетического резерва заключается в том, что жиры являются более восстановленными веществами по сравнению с углеводами (в молекулах углеводов при каждом углеродном атоме есть кислород – группы “–CHOH-“; у жира имеются длинные углеводородные радикалы, в которых преобладают группы “-CH2-“ — в них нет кислорода). От жира можно отнять больше водорода, который затем проходит по цепи митохондриального окисления с образованием АТФ.
Калорийность углеводов и белков: ~ 4 ккал/грамм.
Калорийность жира: ~ 9 ккал/грамм.
Преимуществом жира как энергетического резерва, в отличие от углеводов, является гидрофобность – он не связан с водой. Это обеспечивает компактность жировых запасов — они хранятся в безводной форме, занимая малый объем.
В среднем, у человека запас чистых триацилглицеринов составляет примерно 13 кг. Этих запасов могло бы хватить на 40 дней голодания в условиях умеренной физической нагрузки. Для сравнения: общие запасы гликогена в организме – примерно 400 гр.; при голодании этого количества не хватает даже на одни сутки.
2.ЗАЩИТНАЯ.
Жировая ткань:
а) защищает органы от механических повреждений.
б) участвует в терморегуляции.
Образование запасов жира в организме человека и некоторых животных рассматривается как приспособление к нерегулярному питанию и к обитанию в холодной среде. Особенно большой запас жира у животных, впадающих в длительную спячку (медведи, сурки) и приспособленных к обитанию в условиях холода (моржи, тюлени). У плода жир практически отсутствует, и появляется только перед рождением.
ИСТОЧНИКИ ЖИРА В ОРГАНИЗМЕ:
1. Пищевой жир (экзогенный)
2. Эндогенный жир, синтезируется в печени из углеводов.
определение, состав, строение, структура, функции, классификация и характеристика. Чем отличаются простые белки от сложных?
Сложный белок, кроме собственно белкового компонента, содержит дополнительную группу иной природы (простетическую). В качестве данного компонента выступают углеводы, липиды, металлы, остатки фосфорной кислоты, нуклеиновые кислоты. Чем отличаются простые белки от сложных, на какие виды подразделяют эти вещества, и каковы их особенности, расскажет эта статья. Главное отличие рассматриваемых веществ – их состав.
Сложные белки: определение
Это двухкомпонентные вещества, в состав которых входит простой белок (пептидные цепи) и небелковое вещество (простетическая группа). В процессе их гидролиза образуются аминокислоты, небелковая часть и продукты распада. Чем отличаются простые белки от сложных? Первые состоят только из аминокислот.
Классификация и характеристика сложных белков
Эти вещества делятся на виды в зависимости от типа дополнительной группы. К сложным белкам относятся:
- Гликопротеины – белки, молекулы которых содержат углеводный остаток. Среди них выделяют протеогликаны (компоненты межклеточного пространства), включающие в свою структуру мукополисахариды. К гликопротеидам относятся иммуноглобулины.
- Липопротеиды включают липидный компонент. К ним относятся аполипопротеины, выполняющие функцию обеспечения липидного транспорта.
- Металлопротеины содержат ионы металлов (меди, марганца, железа и др.), связанные через донорно-акцепторное взаимодействие. В эту группу не входят гемовые белки, включающие соединения профиринового кольца с железом и подобные им по структуре соединения (хлорофилл, в частности).
- Нуклеопротеиды – белки, имеющие нековалентные связи с нуклеиновыми кислотами (ДНК, РНК). К ним относится хроматин – компонент хромосом.
- 5. Фосфопротеиды, к которым относится казеин (сложный белок творога), включают ковалентно соединенные остатки фосфорной кислоты.
- Хромопротеины объединяет окрашенность простетического компонента. Данный класс включает гемовые белки, хлорофиллы и флавопротеиды.
Особенности гликопротеинов и протеогликанов
Эти белки являются сложными веществами. Протеогликаны содержат большую долю углеводов (80-85%), у обычных гликопротеидов содержание составляет 15-20%. Уроновые кислоты присутствуют только в молекуле протеогликанов, их углеводы отличаются регулярным строением с повторяющимися звеньями. Какова структура и функции сложных белков гликопротеинов? Их углеводные цепи включают только 15 звеньев и имеют нерегулярное строение. В структуре гликопротеинов связь углевода с белковым компонентом обычно осуществляется через остатки таких аминокислот, как серин или аспаргин.

Функции гликопротеинов:
- Входят в состав клеточной стенки бактерий, костной соединительной и хрящевой ткани, окружают волокна коллагена, эластина.
- Играют защитную роль. Например, данную структуру имеют антитела, интерфероны, факторы свертываемости крови (протромбин, фибриноген).
- Являются рецепторами, которые взаимодействуют с эффектором – небольшой небелковой молекулой. Последняя, присоединяясь к белку, приводит к изменению его конформации, что приводит к определенному внутриклеточному ответу.
- Выполняют гормональную функцию. К гликопротеинам относится гонадотропный, адренокортикотропный и тиреотропный гормоны.
- Транспортируют вещества в крови и ионы через клеточную мембрану (трансферрин, транскортин, альбумин, Na+ ,К+ -АТФаза).
К гликопротеиновым ферментам относятся холинэстераза и нуклеаза.
Подробнее о протеогликанах
Обычно сложный белок протеогликан включает в свою структуру большие углеводные цепи с повторяющимися дисахаридными остатками, состоящими из какой-либо уроновой кислоты и аминосахара. Олиго- или полисахаридные цепи называются гликанами. Первые обычно содержат 2-10 мономерных единиц.
В зависимости от структуры углеводных цепей выделяют их различные типы, например, кислые гетерополисахариды с большим количеством кислотных групп или гликозаминогликаны, включающие аминогруппы. К последним относятся:
- Гиалуроновая кислота, которую активно применяют в косметологии.
- Гепарин, препятствующий свертываемости крови.
- Кератансульфаты – компоненты хрящевой ткани и роговицы.
- Хондроитинсульфаты входят в состав хряща и синовиальной жидкости.
Данные полимеры – компоненты протеогликанов, которые заполняют межклеточное пространство, удерживают воду, смазывают подвижные части суставов, являются их структурными составляющими. Гидрофильность (хорошая растворимость в воде) протеогликанов позволяет им в межклеточном пространстве создавать преграду для крупных молекул и микроорганизмов. С их помощью создается желеобразный матрикс, в который погружены волокна других важных белков, например, коллагена. Его тяжи в среде протеогликана имеют древовидную форму.
Особенности и типы липопротеидов
Сложный белок липопротеид отличается хорошо выраженной двойственной гидрофильной и гидрофобной природой. Ядро молекулы (гидрофобную часть) образуют неполярные эфиры холестерола и триацилглицериды.
Снаружи в гидрофильной зоне располагаются белковая часть, фосфолипиды, холестерол. Выделяют несколько разновидностей белков липопротеидов в зависимости от их структуры.
Основные классы липопротеидов:
- Сложный белок высокой плотности (ЛВП, α-липопротеины). Перемещает холестерин к печени и периферическим тканям.
- Низкой плотности (ЛНП, β-липопротеины). Кроме холестерина транспортируют триацилглицериды и фосфолипиды.
- Очень низкой плотности (ЛОНП, пре-β-липопротеины). Выполняют функцию, подобную ЛНП.
- Хиломикроны (ХМ). Транспортируют жирные кислоты и холестерин из кишечника после поступления пищи.
Такая сосудистая патология, как атеросклероз, возникает в результате неправильного соотношения разных типов липопротеинов в крови. По характеристике состава можно выявить несколько тенденций изменения структуры фосфолипидов (от ЛВП до хиломикронов): уменьшение доли белка (от 80 до 10%) и фосфолипидов, увеличение процента триацилглицеридов (от 20 до 90%).
Среди металлопротеинов много важных ферментов
Металлопротеин может включать в себя ионы нескольких металлов. Их наличие влияет на ориентацию субстрата в активном (каталитическом) центре фермента. Ионы металлов локализуются в активном центре и играют важную роль в проведении каталитической реакции. Часто ион выполняет функцию акцептора электронов.
Примеры металлов, содержащихся в структуре ферментных металлопротеинов:
- Медь включена в состав цитохромоксидазы, которая наряду с гемом содержит ион данного металла. Фермент участвует в процессе образования АТФ при работе дыхательной цепи.
- Железо содержат такие ферменты, как ферритин, выполняющий функцию депонирования железа в клетке; трансферрин – переносчик железа в крови; каталаза ответственна за реакцию обезвреживания перекиси водорода.
- Цинк – металл, характерный для алкогольдегидрогеназы, участвующей в окислении этилового и подобных ему спиртов; лактатдегидрогеназа – фермент в метаболизме молочной кислоты; карбоангидраза, катализирующая образование угольной кислоты из CO2 и H2O; щелочная фосфатаза, выполняющая гидролитическое расщепление эфиров фосфорной кислоты с различными соединениями; α2-макроглобулин – антипротеазный кровяной белок.
- Селен входит в состав тиреопероксидазы, участвующей в процессе образования гормонов щитовидной железы; глутатионпероксидазы, выполняющей антиоксидантную функцию.
- Кальций характерен для структуры α-амилазы – фермента гидролитического расщепления крахмала.
Фосфопротеины
Что входит в состав сложных белков фосфопротеинов? Для данной категории характерно присутствие фосфатной группы, которая связана с белковой частью через аминокислоты с гидроксилом (тирозин, серин или треонин). Какие функции выполняет фосфорная кислота, находясь в структуре белка? Она изменяет структуру молекулы, придает ей заряд, повышает растворимость, влияет на свойства белка. Примерами фосфопротеинов являются казеин молока и яичный альбумин, но в основном к данной категории сложных белков относятся ферменты.
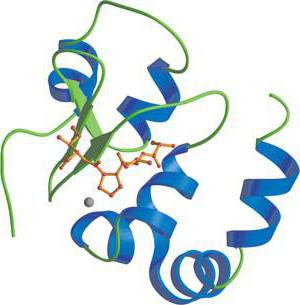
Фосфатная группа играет важную функциональную роль, так как многие белки связаны с ней не постоянно. В клетке все время происходят процессы фосфорилирования и дефосфорилирования. В результате выполняется регуляция в работе белков. Например, если гистоны – белки, соединенные с нуклеиновыми кислотами переходят в фосфорилированное состояние, то активность генома (генетического материала) возрастает. От фосфорилирования зависит активность таких ферментов, как гликогенсинтаза и гликогенфосфорилаза.
Нуклеопротеины
Нуклеопротеины – белки, соединенные с нуклеиновыми кислотами. Они – неотъемлемая часть хранения и регуляции генетического материала, работы рибосом, выполняющих функцию синтеза белка. Самые простейшие формы жизни вирусов можно назвать рибо- и дезоксирибонуклеопротеинами, так как они состоят из генетического материала и белков.
Как происходит взаимодействие дезоксирибонуклеиновой кислоты (ДНК) и гистонов? В хроматине выделяют 2 вида белков, связанных с ДНК (гистоновые и негистоновые). Первые участвуют на начальной стадии компактизации ДНК. Молекула нуклеиновой кислоты обвивается вокруг протеинов с формированием нуклеосом. Образовавшаяся нить похожа на бусины, из них формируются суперспирализованная структура (хроматиновая фибрилла) и суперспираль (хромонема интерфазы). За счет действия гистоновых белков и протеинов более высоких уровней обеспечивается сокращением размерности ДНК в тысячи раз. Достаточно сравнить размер хромосом и длину нуклеиновой кислоты, чтобы оценить важность белков (6-9 см и 10-6 мкм, соответственно).
Какие бывают хромопротеины
Хромопротеины содержат весьма разнообразные группы, которые объединяет только одно – наличие окраски в простетическом компоненте. Сложные белки данной категории подразделяются на: гемопротеины (содержат в структуре гем), ретинальпротеины (витамин А), флавопротеины (витамин В2), кобамидпротеины (витамин В12).
Гемопротеины классифицируются в зависимости от функций на не ферментативные (гемоглобиновый и миоглобиновый белок) и ферменты (цитохромы, каталазы, пероксидазы).
Флавопротеины содержат в качестве простетического компонента производные витамина В2 флавинмононуклеотид (ФМН) или флавинадениндинуклеотид (ФАД). Данные ферменты также участвуют в окислительно-восстановительных превращениях. К ним относятся оксидоредуктазы.
Что такое цитохромы?
Как было описано выше, гем состоит из порфирина. В его структуру входят 4 пиррольных кольца и двухвалентное железо. Особая группа гемовых ферментов – цитохромы, различающиеся составом аминокислот и числом пептидных цепей, специализированы на проведении окислительно-восстановительных реакций, за счет которых обеспечивается перенос электронов в дыхательной цепи. Данные ферменты участвуют в микросомальном окислении – начальных реакциях биотрансформации ксенобиотиков, приводящих к их обезвреживанию, и обмене многих экзогенных и экзогенных веществ, например, стероидов, насыщенных жирных кислот.
Влияние простетической группы
Простетическая группа, входящая в состав сложных белков, влияет на его свойства: изменяет его заряд, растворимость, термопластичность. Например, таким действием обладают остатки фосфорной кислоты или моносахаридов. Углеводная часть, включенная в состав сложного белка, защищает его от протеолиза (разрушения в результате процесса гидролиза), влияет на проникновение молекул через клеточную мембрану, их секрецию и сортировку. Липидный фрагмент позволяет создавать белковые каналы для транспорта плохо растворимых в воде (гидрофобных) соединений.
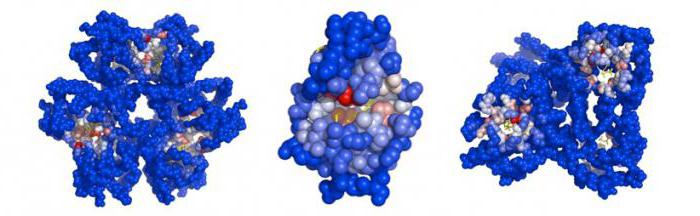
Строение и функции сложных белков полностью зависят от простетической группы. Например, с помощью железосодержащего гема в гемоглобине происходит связывание кислорода и углекислого газа. За счет нуклеопротеидов, формируемых в результате взаимодействия гистонов, протаминов с ДНК или РНК, происходит защита генетического материала, его компактное хранение, связывание РНК в процессе синтеза белков. Нуклеопротеидами называют устойчивые комплексы белков и нуклеиновых кислот.
Заключение
Таким образом, сложные белки выполняют большой спектр функций в организме. Поэтому потребление макро- и микроэлементов так важно для поддержания здоровья. Металлы входят в состав многих ферментов. Зная биохимию, особенности своего здоровья и экологическое состояние места проживания, можно скорректировать режим собственного питания. Например, выделяют территории, отличающиеся дефицитом какого-либо элемента. Его дополнительное внесение в рацион в виде добавок позволяет восполнить недостаток.

Добавить комментарий